查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





Fahr病是以颅内对称性钙化为影像学特征的运动障碍疾病,其中具有遗传背景的病例称为原发性家族性脑钙化症(primary familial brain calcification,PFBC)。
目前发现的遗传方式及对应基因有:常染色体显性遗传(SLC20A2、PDGFRB、PDGFB、XPR1),常染色体隐性遗传(MYORG、JAM2)。70%的Fahr病患者未发现明确的致病基因,因此,基因检测阴性并不能排除Fahr病,家族史和影像学对诊断更为重要。
Fahr病的发病机制假说:常染色体显性遗传病例可通过无机磷转运异常、破坏血脑屏障和周细胞稳态等途径致病(详见图1)。常染色体隐性遗传病例的发病机制不明但功能试验证实致病,如MYORG编码产物参与成肌细胞分化,调节星形细胞内质网蛋白糖基化;JAM2编码产物高表达于神经血管单位相关细胞,参与细胞间黏附、调节细胞极性和内皮细胞通透性、维持血脑屏障功能。
Fahr病的发病率约为4.5/100000。多为中年起病,男女比例无差异。常染色体显性遗传的临床外显率近2/3,表型异质性较大,帕金森综合征是最常见的运动表型,但1/3患者仅有非运动表型(多为认知障碍);1/3患者确诊时无临床症状。无症状但存在严重脑钙化的中年患者随时间推移仍有很高的风险出现临床症状。常染色体隐性遗传者临床外显率>90%,钙化累及的脑区更多,容易出现广泛皮层下和小脑半球钙化,临床上也更常出现小脑性共济失调、智能减退、精神异常等症状。
Fahr病为排他性诊断。当影像学提示以基底节区为著的对称性脑钙化且除外继发因素时,即可考虑该诊断。需除外的继发性因素包括但不限于:①钙磷代谢异常:如甲状旁腺功能减退症、假性甲状旁腺功能减退症。②布氏杆菌、HIV、弓形虫等感染。③铅、一氧化碳等中毒。④系统性红斑狼疮等自身免疫病。⑤Cockayne综合征、Aicardi-Goutières综合征、Coat’s综合征等其他遗传病。
治疗:暂无延缓钙化进展的方法,以对症治疗为主,抗帕金森病药物、抗精神病药物部分有效。使用双磷酸盐和维生素D治疗的临床证据不足。
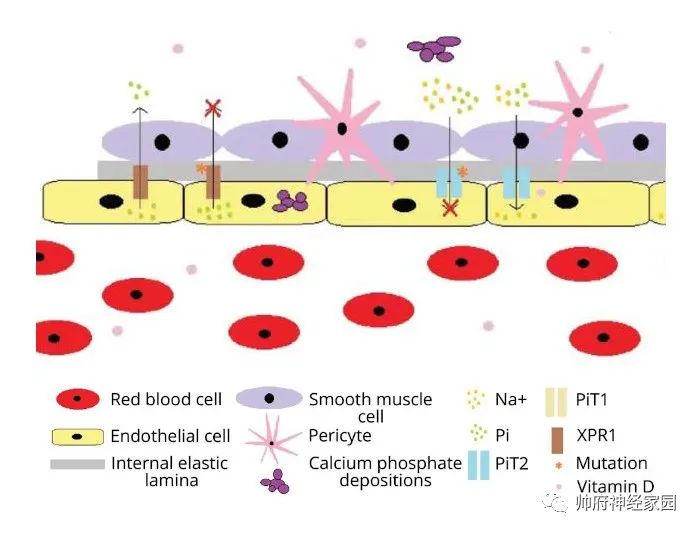
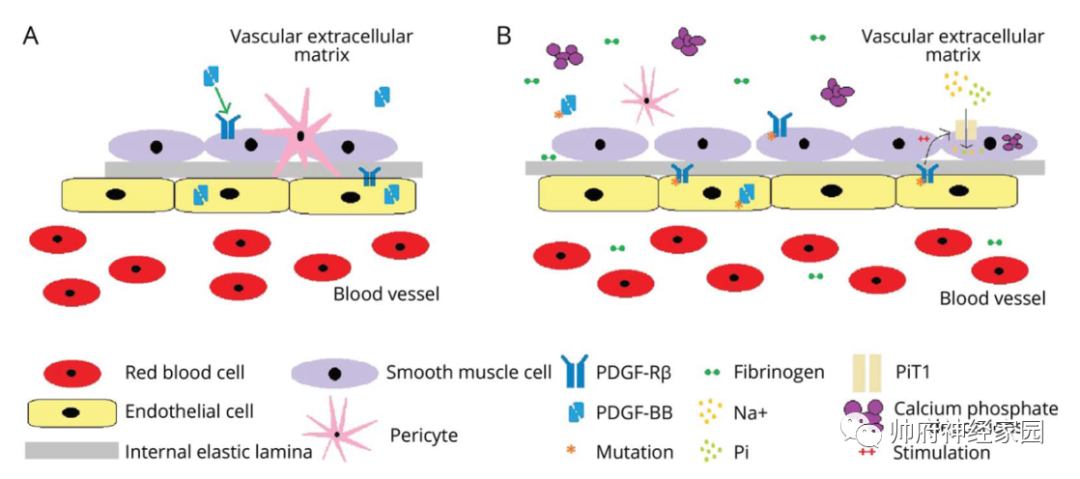
图1 Fahr病的发病机制假说
上图:引起无机磷转运异常:左半部分描绘了2个XPR1转运蛋白,其中左为正常的XPR1转运体,介导无机磷从细胞内分泌到细胞外;右为突变的XPR1转运蛋白(橙色星号),干扰无机磷的外流,钙沉积在内皮细胞。右半部分展示了两个PiT2转运体,其中右为正常情况下无机磷和钠离子内流,维生素D可以结合内皮细胞核内SLC20A2基因启动子,增加PiT2表达;左为SLC20A2突变影响PiT2转运蛋白数量和功能(橙色星号),无机磷内流受阻,血管细胞外基质钙沉积。
下图:血脑屏障和周细胞稳态的破坏:A.配体PDGFB与其受体PDGFRB结合(绿色箭头),确保血脑屏障的完整性和周细胞稳态。B.PDGFB和PDGFRB都可能发生突变(橙色星号),导致配体不能与受体结合,进而引起血脑屏障和周细胞募集功能障碍。
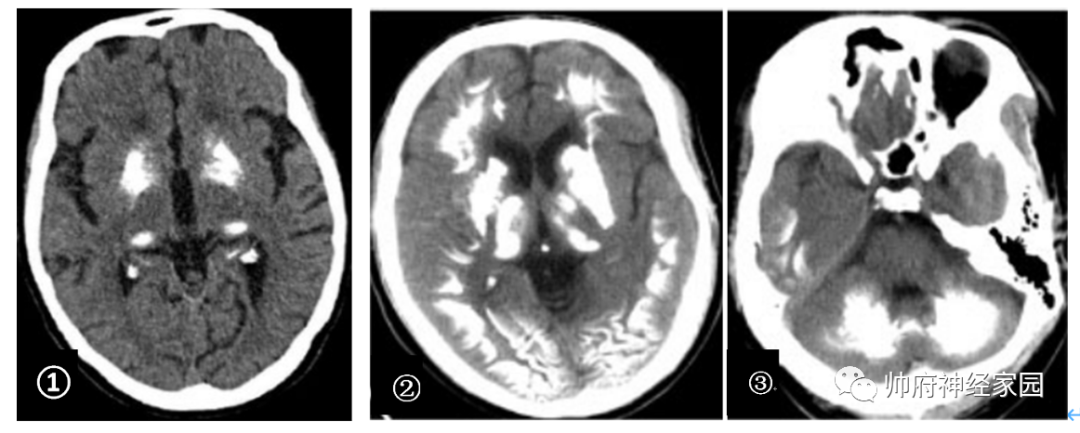
图2 Fahr病的典型影像学
①示PDGFRB突变所致的Fahr病,头CT可见对称性基底节区钙化灶;②和③示JAM2突变所致的Fahr病,头CT可见除基底节区以外,双侧小脑及广泛皮层下白质钙化。
作者:北京协和医院 潘子昂
来源:帅府神经家园
查看更多