200
评论
查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





3月1日,国家药品监督管理局附条件批准安徽智飞龙科马生物制药有限公司的重组新型冠状病毒蛋白疫苗(CHO细胞)上市注册申请。该疫苗是首个获批的国产重组新冠病毒蛋白疫苗,适用于预防新型冠状病毒感染所致的疾病(COVID-19)。
国家药监局根据《疫苗管理法》《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准该疫苗上市注册申请。国家药监局要求该疫苗上市许可持有人继续开展相关研究工作,完成附条件的要求,及时提交后续研究结果。
2月19日,国务院联防联控机制举行新闻发布会。国家卫生健康委疾控局副局长吴良有表示,近日,经国务院联防联控机制批准,国家卫生健康委已开始部署序贯加强免疫接种。重组新型冠状病毒疫苗(CHO细胞)获批作为新冠灭活疫苗的序贯(异源)加强针。
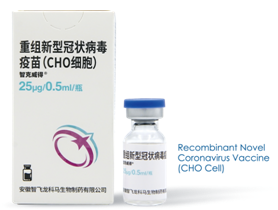
重组新型冠状病毒蛋白疫苗(CHO细胞)由中科院微生物研究所和智飞生物全资子公司安徽智飞龙科马生物制药有限公司联合研制,通过基因工程的方式在工程细胞内表达纯化病原体抗原蛋白制备而成。
2022年3月1日,获国家批准附条件上市。
参考来源:
1.国家药监局附条件批准安徽智飞龙科马生物制药有限公司重组新型冠状病毒蛋白疫苗(CHO细胞)注册申请
2.新冠病毒疫苗序贯加强免疫接种如何实施?哪些疫苗可用于序贯加强接种,有哪些注意事项?我国新冠疫苗有效性如何?……权威解答来了!
3.智飞智讯.智飞龙科马重组新型冠状病毒蛋白疫苗(CHO细胞)Ⅲ期临床试验数据发布
查看更多