查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





近年研究显示,乳腺癌在临床治疗和发展转移的分子机制方面,有了很深入的进展,不同分子分型的乳腺癌得到跨学科的综合治疗。随着基因时代的来临,研究者们尝试利用基因检测手段进行肿瘤治疗的疗效预测。然而,关于肿瘤放疗疗效预测和预后观察相关的基因工具开发远远落后于全身治疗。
10月16日,美国《临床肿瘤学杂志》(J Clin Oncol)在线发表了一项研究,研究提示通过基因组与临床信息结合的分级系统——ARTIC,或可预测乳腺癌患者术后最佳放疗策略。研究者认为,ARTIC可以预测放疗获益人群以及接受全乳放疗获益不大人群的局部复发风险。

为详细了解该分级系统的作用及意义,本报特邀复旦大学附属肿瘤医院放疗中心俞晓立教授对该研究进行了深度解读。
研究简介
早期乳腺癌患者多在保乳手术后接受辅助放疗以预防局部复发风险,但目前尚无相应基因检测工具来帮助选择最佳放疗策略。本研究中,研究者根据原发肿瘤临床分期,分析了SweBCG 91-RT 临床研究中淋巴结阴性患者的转录子组,在该项研究中,患者保乳术后随机分配接受全乳放疗或不放疗。同时,研究者利用3个公共可用队列人群开发了一个辅助化疗强化分级工具ARTIC,包含27个基因和患者年龄,并在SweBCG 91-RT 临床研究的748例患者中,独立验证ARTIC对局部复发风险的预测功能,以期能帮助医生预测患者在放疗中的获益。
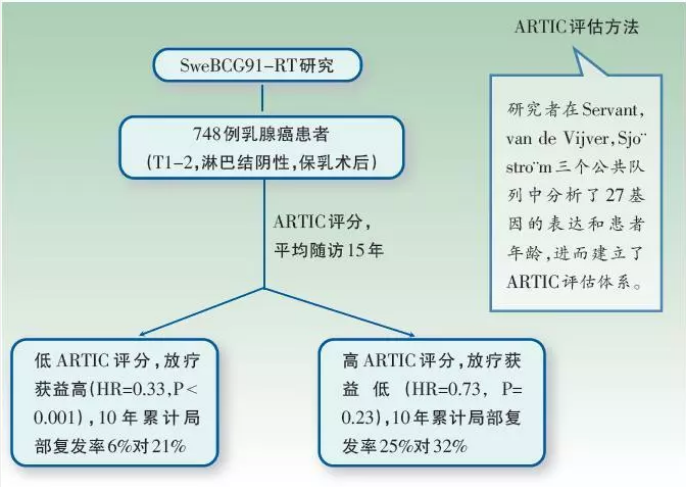
研究结果显示,ARTIC可有效预测放疗患者的局部复发风险(P<0.001),并可预测放疗获益(P=0.005)。ARTIC评分低的患者放疗获益高(HR=0.33,P<0.001),10年累计局部复发率为6%对21%;ARTIC评分高的患者放疗获益较少(HR=0.73,P=0.23),10年累计局部复发率为25%对32%。
国内专家点评
等风来——基因预测为放疗打开一扇窗
随着对乳腺癌临床、病理生理及分子发生转移机制的深入了解,越来越多的临床及基础乳腺肿瘤专家认同乳腺癌不是一种恶性肿瘤,而是一系列的恶性肿瘤,特别是2000年Perou教授提出了乳腺癌的分子分型的概念后(1),不同分子分型的乳腺癌被分门别类地进行跨越多个治疗学科的综合治疗。在这近20年间,不管是肿瘤外科、肿瘤内科及肿瘤放射治疗科在乳腺癌的诊治上都有长足进步,尤其是乳腺癌的全身治疗,从最早仅仅关注肿瘤的临床病理特征,如肿瘤大小、病理分级、淋巴结状态、肿瘤切缘及患者年龄等逐步发展为依据病理实验室提供的患者肿瘤免疫组化结果,如ER、PR、Her-2及Ki-67等状态对患者的复发转移进行高低分层后进行相应治疗。
临床肿瘤学家长期以来孜孜以求的终极目标是患者疗效不断提高及治疗并发症持续下降,随着基因时代的来临,我们可以尝试利用基因检测来进行肿瘤治疗的预后和预测观察,例如在乳腺癌的治疗中,针对部分复发转移低危至中危患者的系统全身治疗,由于有了21-基因、70基因、PAM-50、Endopredict、Breast Index等基因生物信息检测工具,可以将部分低危复发的患者甄别出来免除不必要的治疗,TAILORx和MINDACT研究在这方面已经取得了突破进展(2,3)。
关于肿瘤放疗预测和预后的基因工具的开发远远落后于全身治疗,原因首先与治疗手段和治疗终点目标不同相关。全身系统治疗关注的主要是无瘤生存(DFS)和总生存(OS)的获益,而作为局部治疗手段的放射治疗关注的是局部-区域复发(LRR),基于全身系统治疗开发的21-基因等基因谱并不能完全匹配预测局部区域治疗获益,因此肿瘤放疗学家也一直在探索和放疗相关的预测和预后的基因表达谱。丹麦乳腺癌DBCGB&C研究组曾利用DBCG研究冻存的组织开发了DBCG-RT基因谱(DBCG-RT gene profile),通过训练和验证证实由7个基因组成的基因谱可以甄别出低危复发的患者,同时放疗在这些患者中无明确局部获益(4)。美国密歇根Ann Arbor肿瘤中心的Speers等曾开发了和乳腺癌局部-区域复发相关的51基因谱,命名为“放疗敏感基因”(Radiation Sensitivity Signature,RSS),用于训练和验证后证实可以预测乳腺癌局部复发(5)。
2019年10月16日的Journal of Clinical Oncology在线发表了RSS的升级版,一个用于预测乳腺癌放疗疗效的新分级系统,由27个基因和一个临床病理因素-年龄组成,Sjostrome M等将其命名为Adjuvant Radiotherapy Intensification Classifier (ARTIC),这项研究的重大意义在于这是第一项将新的由基因和临床因素结合而成的预测系统用于乳腺癌III期临床研究去验证放疗在患者中获益的研究。ARTIC的训练级来源于三个包含基因信息及接受局部放疗后随访信息的公共数据库,验证级来自于SweBCG91-RT研究,一项对比T1-2,淋巴结阴性保乳术后放疗与否的三期随机对照研究,放疗剂量为48-54Gy/24-27Fx,瘤床不加量。随访时间为15年。研究显示,ARTIC评分低的患者放疗后获益最大,而评分高的患者局部复发率明显增高,88%的局部复发区域为原瘤床,腋窝为主要的区域复发部位。
这项研究也存在不足和缺陷。根据保乳术后的多项研究和共识,原瘤床是复发高危区域,目前的共识都强调在绝大多数患者中需要瘤床加量,但所有参与SweBCG91-RT研究的患者均无瘤床加量治疗,因此在ARTIC评分高的患者中,放疗后10年复发率仍达到25%,这样的治疗结果无法反映当前的治疗疗效和现实。同时,由于治疗年代的关系,仅<10%的患者接受了全身治疗,内分泌治疗和全身化疗不充分。因此,ARTIC预测系统需要在现代的全身治疗和放疗理念内接受进一步的验证和考验。
瑕不掩瑜,基因预测疗效的时代已经到来,我们欣喜地看到全球范围内多项基因预测放疗疗效的研究正在开展,如MA39、TAILOR-RT、Examining PErsonalised Radiation Therapy for Low-risk Early Breast Cancer (EXPERT),ARTIC研究给我们注入了基因预测放疗疗效的强心剂,无疑这是未来乳腺癌放疗临床和转化性研究的主要方向。
参考文献
1. Perou CM, Sørlie T, Eisen MB,et al. Molecular portraits of human breast tumours. Nature. 2000;406(6797):747-752.
2. Sparano JA, Gray RJ, Makower DF, et al. Adjuvant Chemotherapy Guided by a 21-Gene Expression Assay in Breast Cancer. N Engl J Med. 2018;379(2):111-121.
3. Cardoso F, van't Veer LJ, Bogaerts J, et al. 70-Gene Signature as an Aid to Treatment Decisions in Early-Stage Breast Cancer. N Engl J Med. 2016;375(8):717-729.
4. Tramm T, Mohammed H, Myhre S,et al. Development and validation of gene profile predicting benefit of postmastectomy radiotherapy in patients with high-risk breast cancer: a study of gene expression in the DBCG82bc cohort. Clin Cancer Res. 2014;20(20):5272-80.
5. Speers C, Zhao S, Liu M, et al. Development and Validation of a Novel Radiosensitivity Signature in Human Breast Cancer. Clin Cancer Res. 2015;21(16):3667-3677.

本文首发于《中国医学论坛报》10月24日B1版
作者 | 俞晓立 (复旦大学附属肿瘤医院 放疗中心)
编辑 | 郝冉(中国医学论坛报)
查看更多