查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:北京协和医院消化科 吴东 李朱峰 李景南 钱家鸣;天津医科大学总医院普外科 韩洪秋;北京协和医院病理科 王文泽;北京协和医院放射科 薛华丹
首次消化道出血:脓血便
主诉 患者男性,40岁。主诉“脓血便1年,加重1个月余”。
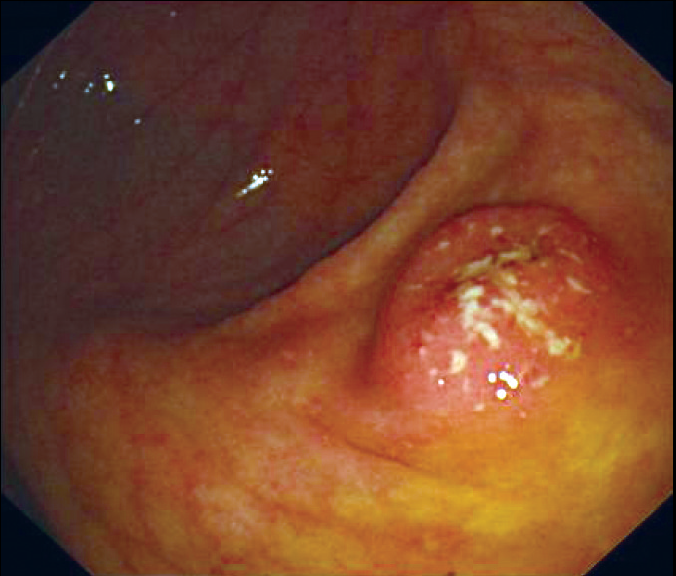
图1 阑尾开口周围盲肠黏膜充血、糜烂
现病史 患者2010 年10月出现下腹隐痛,大便3~4 次/日,为黄软便,有时带脓血。无其他不适。粪便常规:少量红细胞(RBC),白细胞(WBC)满视野,粪隐血(+)。粪细菌培养、抗酸染色及寄生虫均(-)。血红蛋白(Hb)132 g/L,血沉(ESR)20mm/1h。外院结肠镜:阑尾开口周围黏膜充血、糜烂(图1),余结肠黏膜光滑;直肠黏膜血管纹理消失、充血、糜烂(图2)。病理活检:阑尾周围急、慢性炎,偶见隐窝脓肿;直肠黏膜急、慢性炎,可见隐窝脓肿,少数上皮细胞轻度异型增生。诊断为溃疡性结肠炎(UC)。予柳氮磺吡啶(SASP)4 g/d口服及1 g/d灌肠治疗,排便次数减至1~2 次/日,便血明显减少。2011年8月自行停药,劳累后脓血便增至6~7 次/日。2011年9月发热,体温最高38℃,脓血便增至20次/日,腹痛明显。9月22日收入北京协和医院消化科。
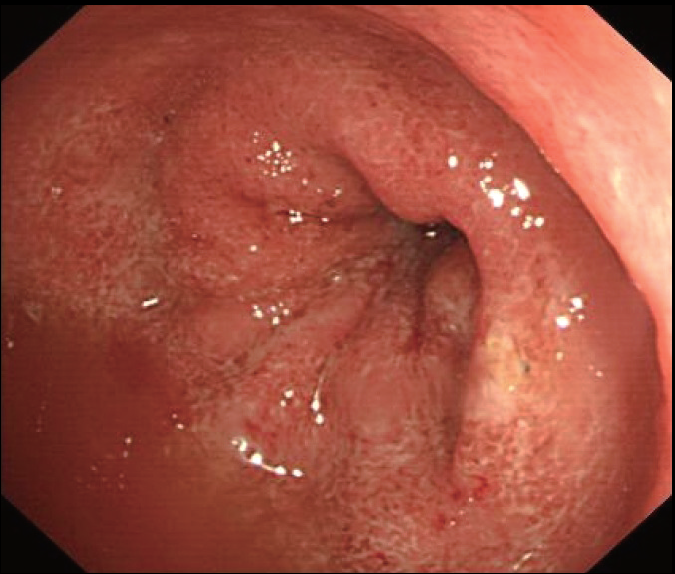
图2 直肠黏膜充血、糜烂,血管纹理消失
入院检查 Hb 76 g/L,ESR 68 mm/1h,白蛋白(ALB)27 g/L,高敏C反应蛋白(hsCRP)95 mg/L。CT:小肠未见明显异常,结肠弥漫性肠壁增厚、强化(图3)。行结肠镜:进镜至乙状结肠,见乙状结肠、直肠弥漫充血、水肿,溃疡,黏膜有自发渗血;有较多炎性息肉,部分呈铺路石样(图4和图5)。活检病理:重度急、慢性炎。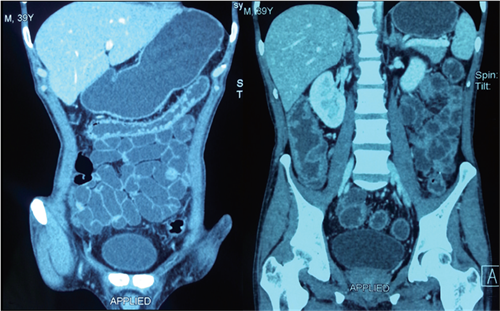 图3 小肠未见明显异常,全结肠弥漫性肠壁增厚伴黏膜层异常强化,肠周血管影增多
图3 小肠未见明显异常,全结肠弥漫性肠壁增厚伴黏膜层异常强化,肠周血管影增多
治疗措施 静脉应用琥珀酸氢化可的松300 mg/d及支持治疗3 d,病情无改善。患者拒绝手术治疗,粪便难辨梭菌毒素及培养(-),巨细胞病毒(CMV)PP65抗原和DNA阳性。给予更昔洛韦后便次降至5次/日,腹痛和便血减轻。
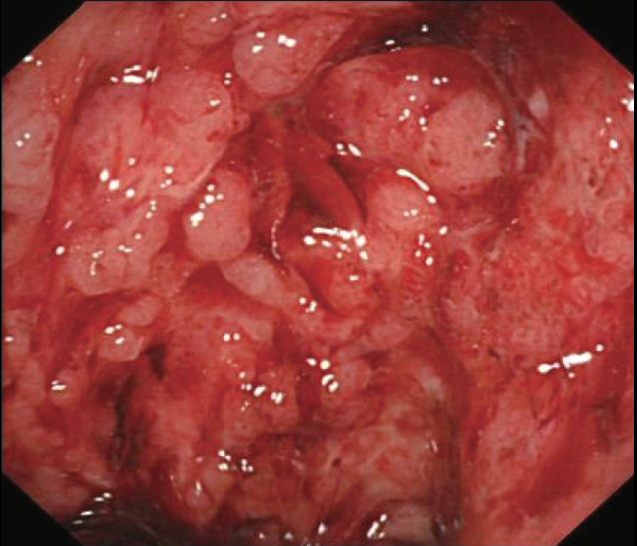
图4 直肠黏膜充血、糜烂,有自发出血
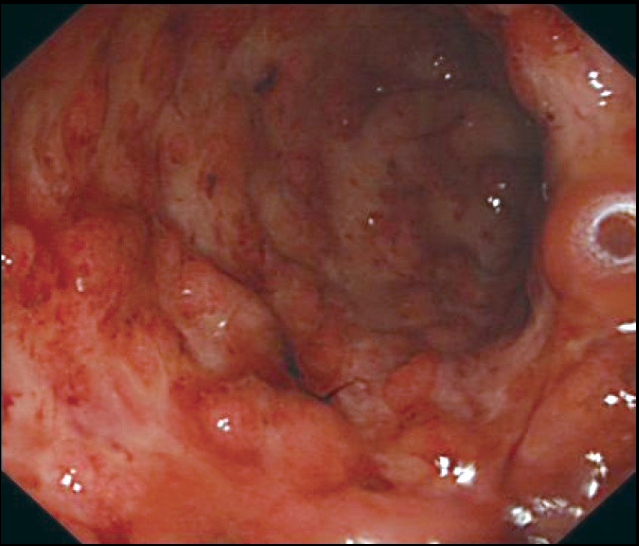
图5 乙状结肠黏膜隆起,呈铺路石外观
第一次临床讨论:UC的规范化诊治
该患者UC诊断可以成立吗?
本例患者中年男性,慢性病程,急性加重。最初症状为脓血便,无其他表现,已除外常见的感染性肠病,第一次结肠镜见黏膜改变较典型,UC诊断(直肠型、轻症)可以成立,此处有两点值得讨论。
1. 阑尾开口周围炎症有无临床意义?
UC 通常为连续性病变,但一部分非广泛型UC患者除直肠或左半结肠病变外,内镜下还有阑尾周围红斑(peri-appendiceal redpatch,PARP)这样的临床表现。
文献表明,PARP现象约占非广泛型UC的8%,其组织学炎症程度与直肠平行。患者多为男性,其中半数患者的病情将会进展(Dig Dis Sci 2010, 55:3495)。
据此看来,本例PARP现象或许提示病情有可能加重,须密切观察。
2. 怎样看待直肠上皮的轻度异型增生?
在炎症较重的区域腺上皮增生活跃,出现轻度异型增生应属正常,加之直肠型UC癌变风险较低且病史较短,因此这一现象的临床意义不大,但应注意监测和随访。
糖皮质激素治疗后病情无改善的原因是什么?
按照改良Truelove 和Witts 评分标准,本例患者最初为轻度UC,加之病变局限,治疗首选5-氨基水杨酸(5-ASA)或SASP 口服,并辅以局部处理。按此治疗后病情一度好转,但因自行停药和劳累又迅速加重,入院时已发展至重症UC。足量应用静脉糖皮质激素后病情无改善。
其原因包括:① 激素无效;② 存在感染因素(尤其是难辨梭菌和CMV),此时应加强支持,尽量去除感染等加重因素,必要时尽快转换治疗(环孢素、生物制剂拯救治疗或急诊手术)。
本例患者CMV-PP65 及DNA均阳性,提示现症感染,而CMV感染可造成UC对激素抵抗。据报道,重度激素抵抗型UC的CMV感染率为20%~40%,而结肠组织中的阳性率约为38%,提示部分重症UC激素治疗无效可能与CMV感染有关(World J Gastroenterol 2013, 19:17)。本例患者在抗病毒治疗后病情有所好转,也印证了CMV 可加重UC 病情。经足量激素及抗病毒治疗后病情虽有改善,但未达缓解标准,仍有手术指征,但患者对手术顾虑较大,要求继续保守治疗。
是否要考虑IC或CD的诊断?
由于患者病情较重,不宜行全结肠内镜检查,仅观察了直肠和乙状结肠,但根据临床及CT表现,病变范围已进展至全结直肠。该患者结肠病变虽然连续,但溃疡较深大,部分黏膜呈铺路石外观,类似克罗恩病(CD),是否要考虑中间型结肠炎(IC)或CD?IC的概念于1978 年被首次提出,此后涵义有所扩展,指经临床、内镜和活检病理评估仍无法归类的IBD。IC约占全部IBD 的10%~15%,其中部分向CD 演化(Inflamm Bowel Dis 2008,14: 850)。患者曾被怀疑IC,但其直肠病变重且无小肠受累证据,与IC 直肠病变通常较轻的特征不符,故诊断IC或CD证据不足,考虑黏膜不典型改变由CMV感染所致可能性更大。
◇病理科医师点评◇
王文泽医师:UC需要与其他结肠炎鉴别(最主要是CD),重症UC的病理诊断尤其要结合临床,例如有无并发症或感染等因素。教科书对UC和CD的病理特点有清晰的界定,但实际情况要复杂得多,经典鉴别标准中任何一条均不具备足够的特异性。约15%的IBD病例可同时具有UC和CD的特点,难以确切归类。此类患者若通过临床、影像及内镜等详细评估后仍无法区分,可称为“炎症性肠病,未分类型”(IBD unclassified,IBD-U);而对于经手术切除病变肠段仍无法确诊者,可使用“中间型结肠炎(IC)”一词。
◇放射科医师点评◇
薛华丹医师:CT技术在IBD的诊断、病情活动度及疗效评价方面应用日益广泛,已成为IBD不可或缺的诊断工具。本例患者入院CT检查的重要发现为,在内镜未完成全结肠检查的情况下,证实病变范围为全结直肠,且小肠无严重病变。
第二次消化道出血:大量鲜血便、术后直肠残端出血
患者突发鲜血便,遂行急诊手术 入院后第3周,患者突发大量鲜血便,血红蛋白(Hb)降至36 g/L,出现失血性休克。
CT 动脉造影(CTA)示,造影剂外溢至盲肠及升结肠(图6),遂行急诊手术。
术中肠镜探查空肠及近端回肠黏膜正常,距回盲瓣30 cm范围内末端回肠黏膜充血、糜烂,升结肠可见新鲜血液,全结肠黏膜符合溃疡性结肠炎(UC)改变。行“末端回肠、全结肠、部分直肠切除+回肠单腔造口术”。
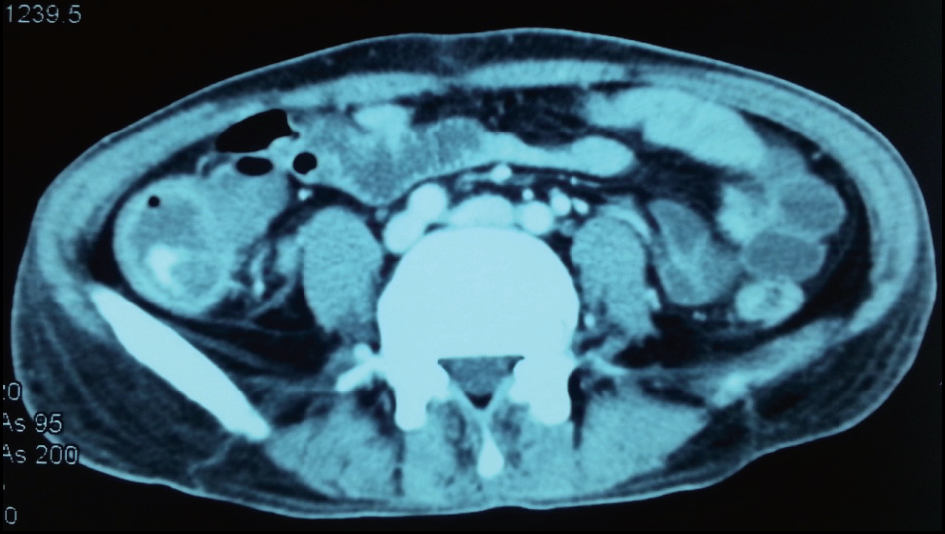
图6 CTA 示门脉期回盲部造影剂溢入肠腔内,提示该处活动性出血
手术病理 结肠黏膜表浅溃疡及炎性假息肉,黏膜下层水肿,肌层和浆膜无明显病变,符合典型UC表现(图7)。
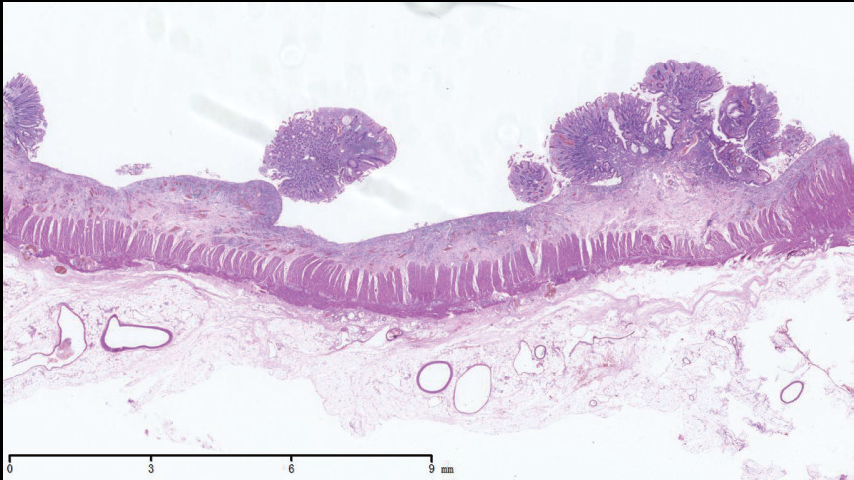
图7 结肠手术切除标本见黏膜浅溃疡及炎性假息肉,黏膜下层水肿,肌层和浆膜层无明显病变,符合典型UC
术后治疗 术后直肠残端反复出血,予纱布填塞及激素灌肠后血止。渐停用激素和5-氨基水杨酸(5-ASA),加强肠内营养,一般情况好转。
患者无发热、腹痛,回肠造口流出物为黄色,多次查隐血为阴性,Hb128 g/L,高敏C 反应蛋白(hsCRP)正常。
第二次临床讨论:重症UC的急诊手术与IPAA手术
如何选择急性下消化道出血的检查方法?
由于患者对手术持消极态度,失去了尽早控制病情的时机。突发下消化道大出血,考虑溃疡导致黏膜下血管暴露出血可能性大。急性下消化道出血部位判断主要依赖核素检查、结肠镜和血管造影3种方法,选择何种检查需要根据病情取舍。
本例患者出血速度快,病情危重,核素检查阳性率较高,但较为耗时,且无法精确判断出血部位,显然不合适。
结肠镜虽然确诊率高,但要求血流动力学稳定,且需要肠道准备,不宜在急性大出血时实施,并且本例患者为重度UC,内镜检查有加重病情的风险,因此也不可取。
血管造影可检测出速度0.5 ml/min的出血,预计可以发现出血部位,但本例患者为肠道溃疡病变,通过栓塞止血会造成肠壁缺血而加重溃疡,再出血率高,故仅有诊断作用。通过快速注射造影剂,多排螺旋CT 血管造影(MDCTA)发现肠道出血病灶的敏感度已可以与传统血管造影媲美,创伤性却明显减少,适合作为术前检查。UC病变多局限于结直肠,但10%~17%的广泛型UC存在回肠末段病变,即所谓的“倒灌性回肠炎”(backwash ileitis),本例即是如此。
◇放射科医师点评◇
薛华丹医师:该患者通过CTA证实了急性消化道大出血并指示出血部位,为急诊手术创造了更好的条件。北京协和医院的研究表明,MDCTA对急性下消化道大出血的检出率为70.8%(80/113),诊断敏感性86.0%,特异性100%(J ClinGastroenterol 2012,46: 31;Clinical Radiology 2013,68: 139),提示该技术在急性消化道出血诊断方面有广阔的应用前景。
如何选择患者手术方式?
本例患者因重症UC大出血接受急诊手术,术式选择非常重要。单纯末端回肠造口不能控制结肠出血,全结肠切除势在必行。
术中肠镜探查发现,末段回肠也有活动性炎症,不能完全排除该处出血,故一并切除。若再切除全部直肠,虽止血彻底,但需要永久造瘘,将严重影响患者生活质量。经权衡利弊并与患方沟通后,医生决定保留部分直肠(腹膜反折以下),择期再行回肠贮袋肛管吻合术(ileal pouch-anal anastomosis,IPAA二期手术)。
IPAA 手术主要用于治疗UC 或家族性腺瘤性息肉病。该手术切除全结肠并剥离直肠黏膜,用回肠构造成贮袋与肛管吻合,可保留肛门排便功能,提高生活质量。IPAA目前已成为西方国家治疗UC 的主流术式。
急性贮袋炎是IPAA术后最常见的并发症,5年发生率25%~50%,抗菌治疗有效。其他并发症包括慢性贮袋炎(多种抗菌药物疗效不佳)、贮袋易激综合征(内镜下无炎症表现但临床有肠道症状)、直肠残端袖套炎,甚至可发生贮袋克罗恩病(CD)。
本例患者保留直肠的风险在于残端出血,但通过局部治疗得以控制。
◇普外科医师点评◇
韩洪秋医师:该患者先接受了急诊全结肠及末段回肠切除术,即IPAA一期手术。为了与IPAA二期手术更好地衔接,有几点值得注意:① IPAA二期手术须用回肠制作贮袋,因此一期手术时应在回肠末端离断结肠,尽量保留较长回肠,二期手术时方能将回肠贮袋与肛管进行无张力吻合;② 一期手术后3~4个月即可进行IPAA二期手术,期间应加强营养,调整药物方案,为后续手术做好准备;③患者需做提肛动作等锻炼,避免肛门括约肌废用性萎缩,以保证术后良好的肛门功能。
第三次消化道出血:术后出血
2012年9月18日,患者在天津医科大学总医院普外科接受回肠贮袋肛管吻合术,即IPAA 二
期手术(具体手术名称包括“开腹探查,复杂肠粘连松解,回肠造口切除,腹会阴联合残留直肠切除,回肠贮袋肛管吻合,暂时回肠双腔造口术),手术顺利。
由于回肠长度较短,加之腹盆腔粘连,残留直肠炎症较重,手术难度大。术后第3天胃管出现血性胃液,第8天出现呕血,回肠造口流出血性肠液。急诊胃镜见胃窦大弯侧1.0 cm溃疡,有活动性出血,十二指肠球部及降部多发溃疡。
考虑应激性溃疡可能,予抑酸等治疗后出血停止。此后患者反复发生消化道出血,伴寒战、高热,体温最高39.8℃,广谱抗菌药物治疗无效。
小肠镜:空肠上段卵石样隆起,黏膜充血、糜烂,片状浅溃疡(图8)。考虑“术后消化道出血原因不明,克罗恩病(CD)待除外”,加用琥珀酸氢化可的松100 mg,q12h并转回北京协和医院继续治疗。入院后发现发热时间与静脉输液相关,外周血培养为近平滑假丝酵母菌,遂拔除中心静脉导管。导管尖端病原体培养结果与血培养相同,证实为导管相关血流感染,经抗真菌治疗后体温恢复正常。
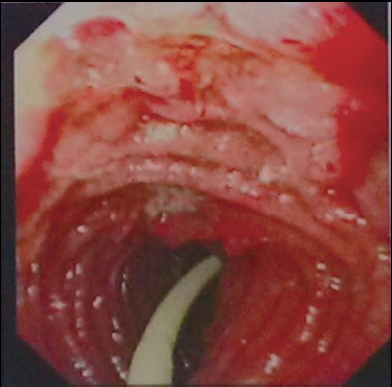
图8 空肠上段卵石样隆起,周边黏膜充血糜烂,片状浅溃疡
IPAA二期手术切除残留直肠病理:可见深溃疡和全层炎,局部裂隙样溃疡形成,建议排除CD。
第三次临床讨论:是UC,还是CD?
炎症性肠病(IBD)患者病情变化时,要区分此变化究竟系IBD 本身所致,还是其他因素引起。就本例患者而言,IPAA术后出血、消化道多发溃疡、发热,直肠残端有深溃疡和全层炎,确有理由怀疑CD。那么本例究竟是溃疡性结肠炎(UC)还是CD?判明这一点对今后病情影响极大,须仔细鉴别。
通过深入分析,我们发现上述情况仍不足以动摇UC 的诊断,理由包括:① 本例患者起病时内镜表现及第一次手术切除的结肠病理均符合UC,典型UC病例后来转变为CD者虽然可能,但比较罕见;② 发热已证实为真菌感染所致,并非CD引起;③ 本例直肠病变较重,第一次手术后残端尚有反复出血,而重症UC 亦可有全层炎和深溃疡,此种病理改变并非CD 所独有,应结合临床综合判断;④ 第一次手术时曾通过术中肠镜全面探查小肠,未发现符合CD 的溃疡病变。
IPAA术后溃疡主要在胃、十二指肠和上段空肠,其部位和形态也不符合典型CD的特点。是否为术后应激反应所致?应待病情稳定后复查内镜,全面评估小肠,再决定CD诊断能否成立。由于患者存在活动性真菌感染,激素应逐渐减量。
患者转归
拔出静脉导管后继续抗真菌治疗,同时加强支持,激素逐渐减停。患者一般情况改善,恢复进食后未再呕血,回肠造口排出物隐血多次检查均为阴性。
复查胃镜:胃黏膜未见异常;十二指肠球部黏膜充血,球后、降部均可见溃疡瘢痕。
小肠CT:术后改变,未见其他异常。胶囊内镜:全小肠黏膜完好,未见溃疡。停用所有药物,随访8个月无症状,继续肠内营养,拟择期还纳瘘口,启用贮袋。
最终诊断
溃疡性结肠炎(广泛型,重症)
巨细胞病毒(CMV)感染
失血性休克
末段回肠、全结肠及部分直肠切除+回肠单腔造口术后
直肠残端出血
回肠贮袋肛管吻合术(IPAA术)后
应激性溃疡可能
导管相关性血流感染(近平滑假丝酵母菌)
◇普外科、病理科医师点评◇
韩洪秋医师:这是一例疑难危重的IBD病例,最终治疗成功来之不易。IPAA二期手术,即回肠贮袋与肛管吻合有两种方法:双吻合器法和手缝吻合法。前者虽可减少吻合口漏风险,但在确切剥离直肠黏膜以及保留肛门精细功能方面不及手缝吻合。
IPAA目前已成为国际上UC外科治疗的标准术式,但在我国应用还不普遍,原因可能有三个方面:① 医务界和患者对该术式尚未充分了解;② 重症UC患者一般状况差,手术风险较高;③ IPAA(尤其是手缝吻合)技术较复杂,学习曲线较长。希望今后继续开展多中心和跨学科合作,共同推进我国IBD的外科治疗。
病理科王文泽医师:本例直肠切除标本虽有部分CD的病理特点,但整体来看目前还是诊为UC较为稳妥。中间型结肠炎(IC)的存在、个别患者小肠CD与大肠UC共存、UC病例IPAA术后出现贮袋CD以及同一家族中不同个体分别发生UC和CD等情况,提示UC和CD的区分有时具有一定的主观性。然而,多数病例还是根据临床及病理资料确诊,并给予特异性治疗。
值得强调的是,临床医生应慎重使用IC一词,若内镜活检病理不足以确诊,建议使用“非特异性慢性结肠炎(nonspecific CIBD)”等描述性用语,待证据充分后再做论断。
第四次临床讨论:总结
在激素减停的情况下消化道溃疡却逐渐愈合,病情好转,这样的演变趋势不支持CD,考虑消化道出血还是以术后应激性溃疡可能性大,因此最终仍诊断为UC(广泛型、重症)。
结肠切除术后3~4 个月为IPAA二期手术时机,但患者对手术始终顾虑,直至第11 个月方行二期手术,不仅腹盆腔粘连严重,手术难度增加,而且肛门括约肌出现废用性萎缩,直肠黏膜长期脱离接触肠道菌群,炎症加重,均不利于术后恢复。术后出现较多并发症可能与此有关。
本例患者最初仅为局限的轻症UC,后来的变化却一波三折,屡次发生消化道出血,出血原因又不尽相同,病情一度十分危重。但由于多学科的共同努力,最终控制了病情,患者得以存活并保留进一步治疗的机会。本例患者诊治经验对于IBD的多科协作,尤其是重症UC的规范治疗有一定的借鉴意义。
◇专家小结◇
消化科钱家鸣医师:本例曲折的诊治经过对我们有以下启示。
1. IBD的病情演变是一个动态过程。古希腊哲学家赫拉克利特曾说过:“人不能两次踏入同一条河流”,我们也应当用辨证的、动态的眼光来看待IBD的诊断。UC和CD都缺少诊断金标准,二者之间又确实存在一条“中间地带”,因此对病理诊断也不能孤立看待,需结合各方面资料综合分析并注意随访,对病情的判断才能合乎实际。
2. 要注意提高IBD患者的依从性。本例最初若能规范治疗并调整生活方式,病情也许可长期稳定;发展至重症UC后若能及早手术,或许能避免后来的诸多并发症。
3. IBD虽是一种自身免疫病,但在诊治中(尤其是病情变化时)应注意感染因素的识别与控制,特别是CMV感染与医源性感染。
4. IBD成功诊治必须依靠多科协作,在手术指征与时机方面外科的支持最为关键。
本文来自《中国医学论坛报》多科诊治平台·IBD专题,转载请注明出处。
查看更多