查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





慢性肾病(CKD)现已成为全球一大公共卫生问题,发病率和相关死亡率逐年上升。数据显示,CKD 患者肾功能下降与糖尿病、心血管疾病、脂肪肝等代谢疾病相关,而肥胖人群的快速增长也是 CKD高发的主要原因之一。肾近端小管细胞 (RPTC) 是肥胖相关肾损伤的主要受累部位,但RPTC损伤的机制尚不明确。基于此,2024年1月,来自以色列耶路撒冷希伯来大学的Joseph Tam等人在Journal of the American Society of Nephrology上发表题为“Renal Mitochondrial ATP Transporter Ablation Ameliorates Obesity-Induced CKD”的文章。研究揭示了腺嘌呤核苷酸转运蛋白 2 (ANT2) 在肥胖引起 CKD 发病过程中的核心作用。这一成果为CKD病发潜在机制提供了新的见解,并有可能为疾病治疗开发有效的靶向措施。
肾脏是一个高能量需求的器官,其线粒体含量和耗氧量仅次于心脏。ANT通过跨线粒体内膜交换胞质和线粒体腺嘌呤核苷酸,为 ATP 合成提供 ADP 并将 ATP 递送到胞质,对于调节 ATP 水平至关重要。为探究ANT2在肾脏中的作用,作者首先构建了小管ANT2特异性敲除小鼠(RPTC-ANT2-/-),并用高脂饮食(HFD)喂养24周。与同窝对照小鼠(WT)相比,RPTC-ANT2-/-小鼠肾功能正常,肾小球形态变化较小,同时肾脏炎症标志物及纤维化水平较低。总而言之,这些发现表明 RPTC-ANT2 在介导肥胖引起的肾功能障碍、炎症和肾小管间质纤维化中发挥着关键作用。(图1)
图1 ANT2介导肥胖引起的肾损伤
为进一步了解 ANT2 的缺失如何在 HFD 条件下产生肾脏保护作用,作者进行了多项组学分析。转录组学和蛋白质组学分析显示,ANT2缺失后小鼠肾脏线粒体功能异常通路明显下调,同时脂肪酸氧化(FAO)途径也受到抑制。肾脏RPTC 中的脂质积累,是肥胖引发CKD 的一个主要特征。接下来作者析了小鼠肾脏和原代RPTC 中的脂质变化。作者对空泡化的近端小管进行定量分析,发现HFD喂养的WT小鼠小管中有大量脂滴积累,而RPTC-ANT2-/-小鼠小管中脂滴聚集不明显。此外,RPTC-ANT2-/-小鼠肾脏总甘油三酯积累减少,尿液与血清游离脂肪酸比率的增加,表明尿脂质排泄增强,从而减少 RPTC 中的脂肪积累。(图2)
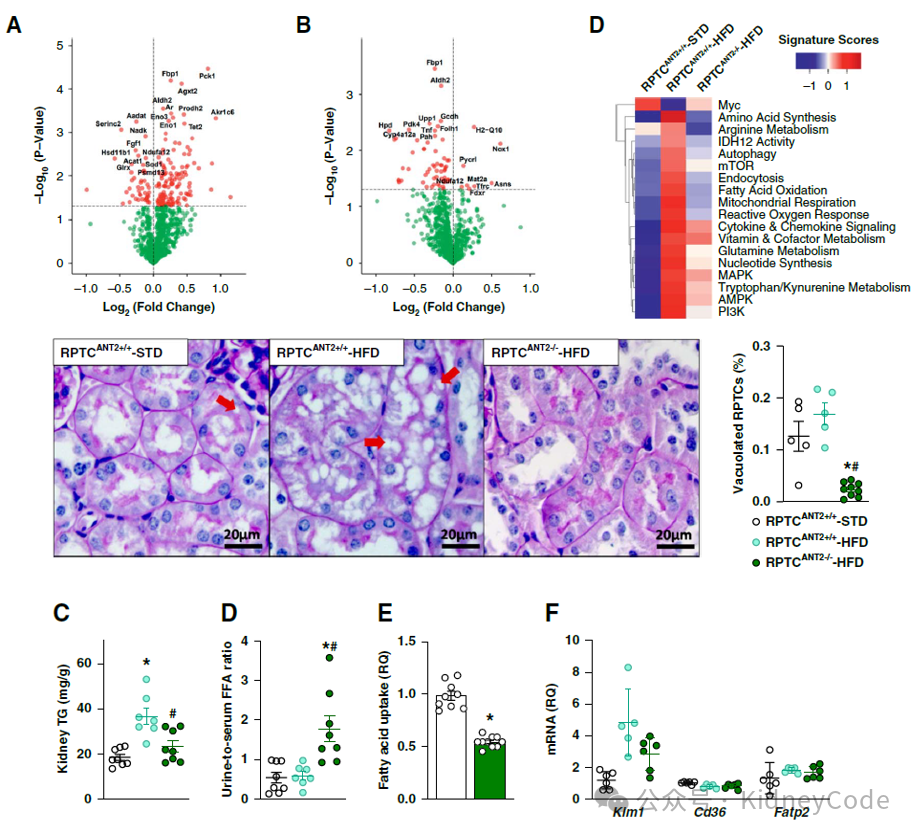
图2 ANT2介导肾小管细胞中的脂质转运
上述数据显示,在 RPTC 中不存在 ANT2 的情况下,脂肪酸β氧化会下调,而细胞 ATP 水平似乎未受影响。因此,作者接下来探究了RPTC-ANT2-/-小鼠肾脏中另一种 ATP 生成途径—糖酵解。数据显示,HFD喂养的RPTC-ANT2-/-小鼠与WT小鼠相比,血液循环和尿中乳酸水平增加,表明肾脏对葡萄糖的利用增强。同时,分离正常和HFD饮食RPTC-ANT2-/-小鼠原代RPTC后培养,ANT2缺失后细胞培养基中葡萄糖与乳酸比率下降,表明细胞糖酵解途径增强。这些结果提示,敲除RPTC 中的 ANT2 后会将细胞能量来源转向糖酵解。(图3)
图3 RPTC中缺失ANT2后会增加细胞糖酵解
文章结论与展望
综上,该项研究表明RPTC-ANT2 在肥胖引起 CKD 的发展中发挥着主要作用。小管细胞中敲除ANT2后,会改变细胞能量供应来源,由FAO转向糖酵解。此外,文中还提到一个有趣的现象,与WT小鼠相比,RPTC-ANT2-/-小鼠血脂异常、肝脂肪变性和肝损伤也得到了明显改善,这提示ANT2可能在肾-肝轴中同样发挥重要作用,但这一结果还需更多实验验证。总之,这项工作提示靶向 RPTC-ANT2 或其上、下游通路可能是治疗肥胖引起CKD 的一种新的治疗方法。
来源:KidneyCode
查看更多