查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2023年11月8日,中山大学肿瘤防治中心徐瑞华教授携团队最新成果亮相美国临床肿瘤学会(ASCO)全体大会系列会议(ASCO Plenary Series),发布全球首个抗Claudin 18.2抗体偶联药物(ADC)CMG901治疗晚期Claudin 18.2阳性胃癌及胃食管结合部腺癌的I期临床研究最新结果,本项研究同时登录ASCO新闻官网。

本项研究登陆ASCO新闻官网
据悉,ASCO Plenary Series会通过ASCO专家委员会挑选极具代表性的重磅研究数据进行公布和讨论(每次不超过2篇),旨在及时更新具有创新性、高质量以及重要临床实践意义的临床研究数据,促进全球肿瘤治疗方案更新,惠及患者。这项突破性的研究获得全球医药行业的高度关注。

CMG901是一款潜在同类首创、靶向Claudin 18.2的抗体偶联药物,通过链接体与单甲基澳瑞他汀E(MMAE)载荷偶联,目前正在晚期实体瘤(胃癌及胰腺癌)患者中开展I期临床研究。截至2023年7月24日,2.2mg/kg、2.6mg/kg、3.0mg/kg三个剂量组共纳入113例胃癌/胃食管结合部腺癌患者(分别为44例、50例、19例)。所有受试者均接受了至少一线的标准治疗(既往中位治疗线数为2线),74%的受试者既往接受过抗PD-1/PD-L1治疗。
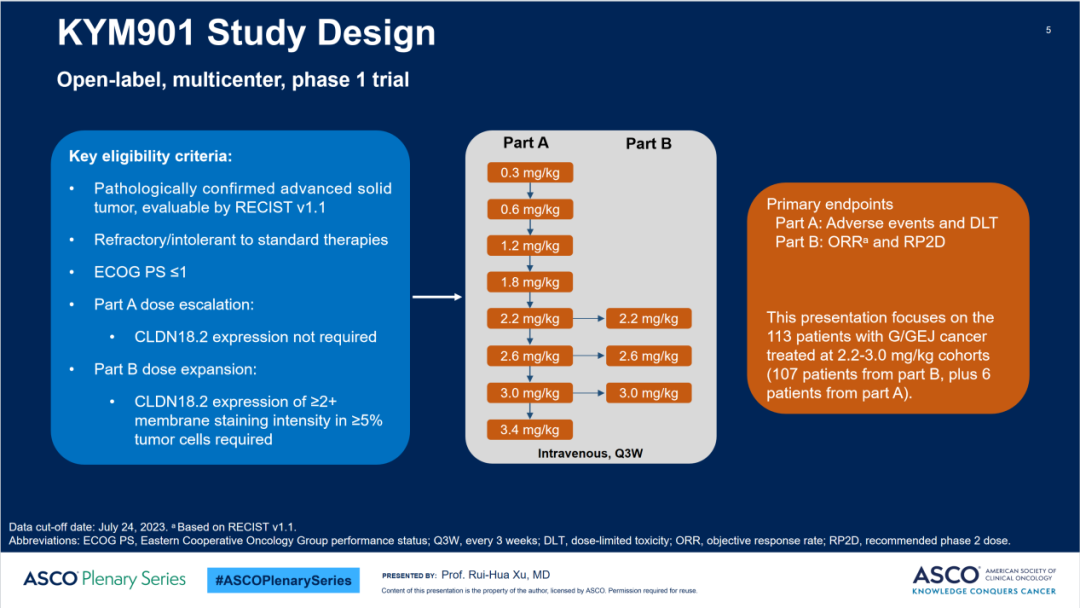
KYM901研究设计示意图
89例可评估的Claudin 18.2阳性胃癌或胃食管结合部腺癌患者在三个剂量组的确认的客观缓解率(ORR)为33%,确认的疾病控制率为70%。其中,2.2 mg/kg剂量组确认的ORR为42%,中位无进展生存(PFS)期为4.8个月,中位总生存(OS)期尚未达到。
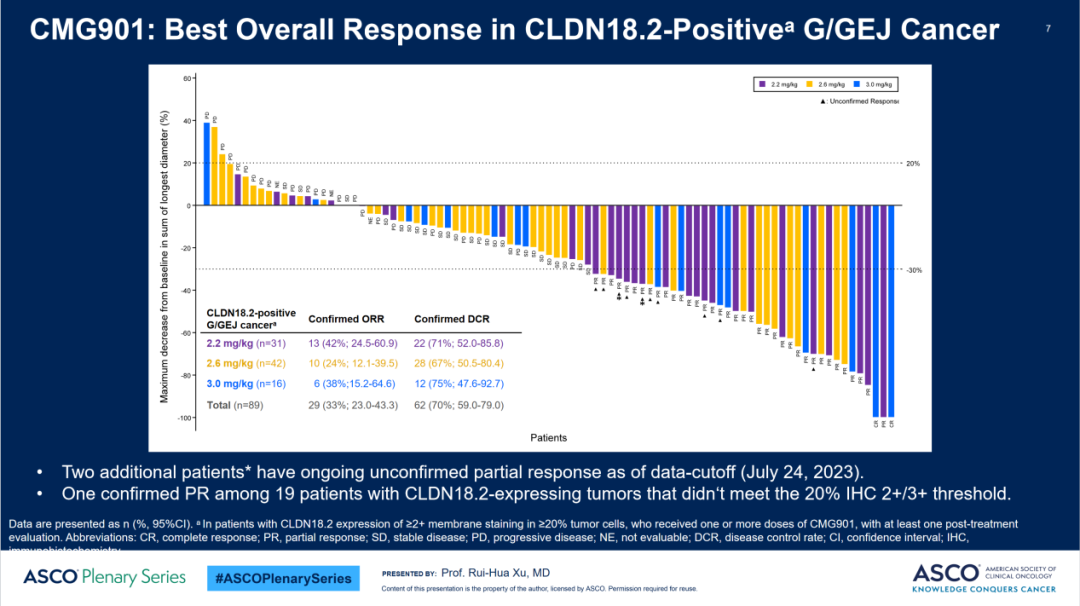
Claudin 18.2阳性胃癌或胃食管结合部腺癌患者的客观缓解率、疾病控制率
在安全性方面,与药物有关的≥3级治疗期间出现的不良事件发生率为54%,与药物有关的严重不良事件发生率为31%,8%的受试者因药物相关的不良事件停止用药。
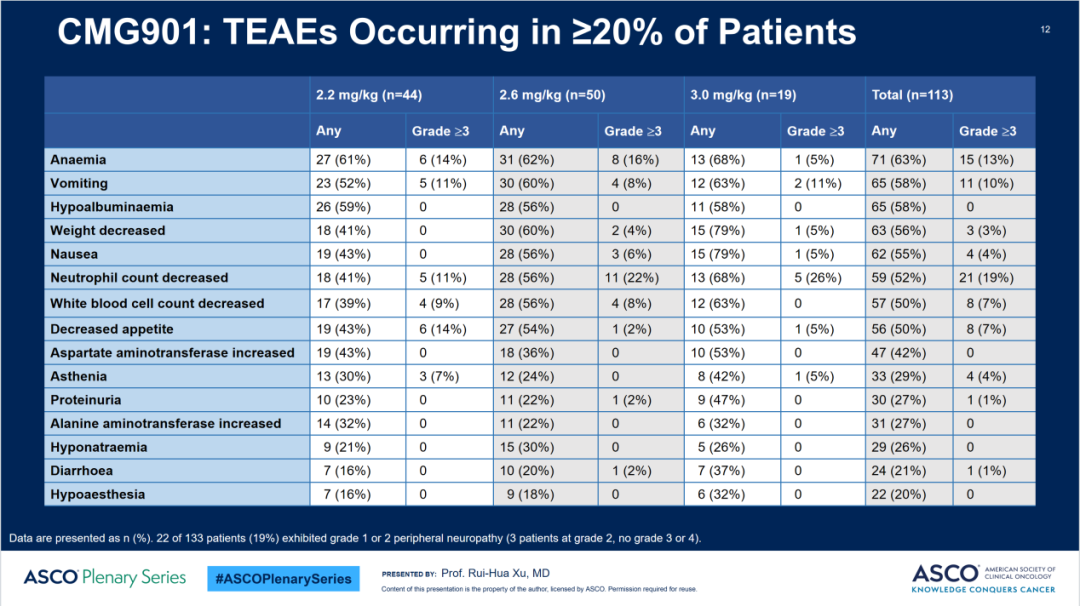
治疗期间出现的不良事件发生率
Claudin 18.2是继HER2之后胃癌领域的又一“明星”靶点,早前公布的SPOTLIGHT和GLOW研究,证实Claudin 18.2单克隆抗体Zolbetuximab联合化疗相较于单纯化疗可以显著延长胃癌患者的生存。ADC是近年来受关注的抗肿瘤治疗领域之一,本研究的CMG901是国内自主研发、全球首个报道的靶向Claudin 18.2的抗体偶联药物,已获国家药品监督管理局药品审评中心(CDE,NMPA)突破性治疗药物认定、美国食品与药物管理局(FDA)快速通道及孤儿药资格认定。徐瑞华教授团队牵头的这项多中心I期临床研究的最新结果展示了相当积极的疗效信号与良好的安全性数据。
徐瑞华教授表示:“CMG901在晚期Claudin 18.2阳性胃癌及胃食管结合部腺癌患者中显示出良好的临床疗效。所有亚组均观察到临床益处,并且安全性是可控的,未来非常有可能为这部分胃癌患者人群提供更佳的治疗方案。”
接下来,CMG901将进一步开展全球多中心的II/Ⅲ期临床研究,希望国产原研创新药能开启Claudin 18.2阳性胃癌靶向治疗的新时代!
撰文丨中山大学肿瘤防治中心 阮丹云
通讯员丨中山大学肿瘤防治中心 郑敏珊 蒲恒颖 陈鋆 文朝阳
查看更多