查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





当地时间9月27日~10月1日,2019欧洲肿瘤内科学会(ESMO)年会在西班牙巴塞罗那顺利召开。今年大会的主题为“将科学研究转化为对癌症患者更好的治疗(translating science into better cancer patient care)”,强调肿瘤领域研究的核心价值在于其转化为治疗手段的潜力。本报特邀中山大学肿瘤防治中心陈功教授,解读本届ESMO年会结直肠癌领域新进展。

2019年9月30日,ESMO年会进行了结直肠癌领域的第二场口头报告,一共报道了4项研究,分别如下:
口头报道专场2(Proffered Paper 2)
- 时间:2019-9-30,08:30-10:00
- 地点:Barcelona Auditorium (Hall 2)
- 内容
1) LBA32-BEACON CRC研究-Encorafenib联合西妥昔单抗+/-Binimetnib治疗BRAF突变型mCRC:对比伊立替康或FOLFIRI联合西妥昔单抗不同选择的一项3臂随机对照III期临床研究扩展结果(Encorafenib plus cetuximab with or without binimetinib for BRAF-mutant metastatic colorectal cancer: Expanded results from a randomized,3-arm,phase III study vs the choice of either irinotecan or FOLFIRI plus cetuximab (BEACON CRC))
2) LBA33-IMPALA研究:Lefitolimod对比标准治疗用于一线标准治疗有应答的mCRC患者(Lefitolimod vs stand of care for patients with metastatic colorectal cancer responding to first-line standard treatment: Results from the randomized phase III IMPALA trial)
3) 524O-NGS用于mCRC:新突变基因及其对疗效的影响(来自联盟80405研究的结果)(Next-generation sequencing in metastatic colorectal cancer: Novel mutated genes and their effect on response to therapy (Alliance))
4) LBA34-MIRACLE研究: 绿茶提取物对比安慰剂用于结直肠腺瘤性息肉预防的随机对照研究(Green tea extract versus placebo for the prevention of colorectal adenomas: A randomized, controlled trial )
下面重点来介绍本次大会最重要的口头报告BEACON研究,因为它开启了mCRC精准医学实践的新时代-BRAF时代。
研究背景及信息
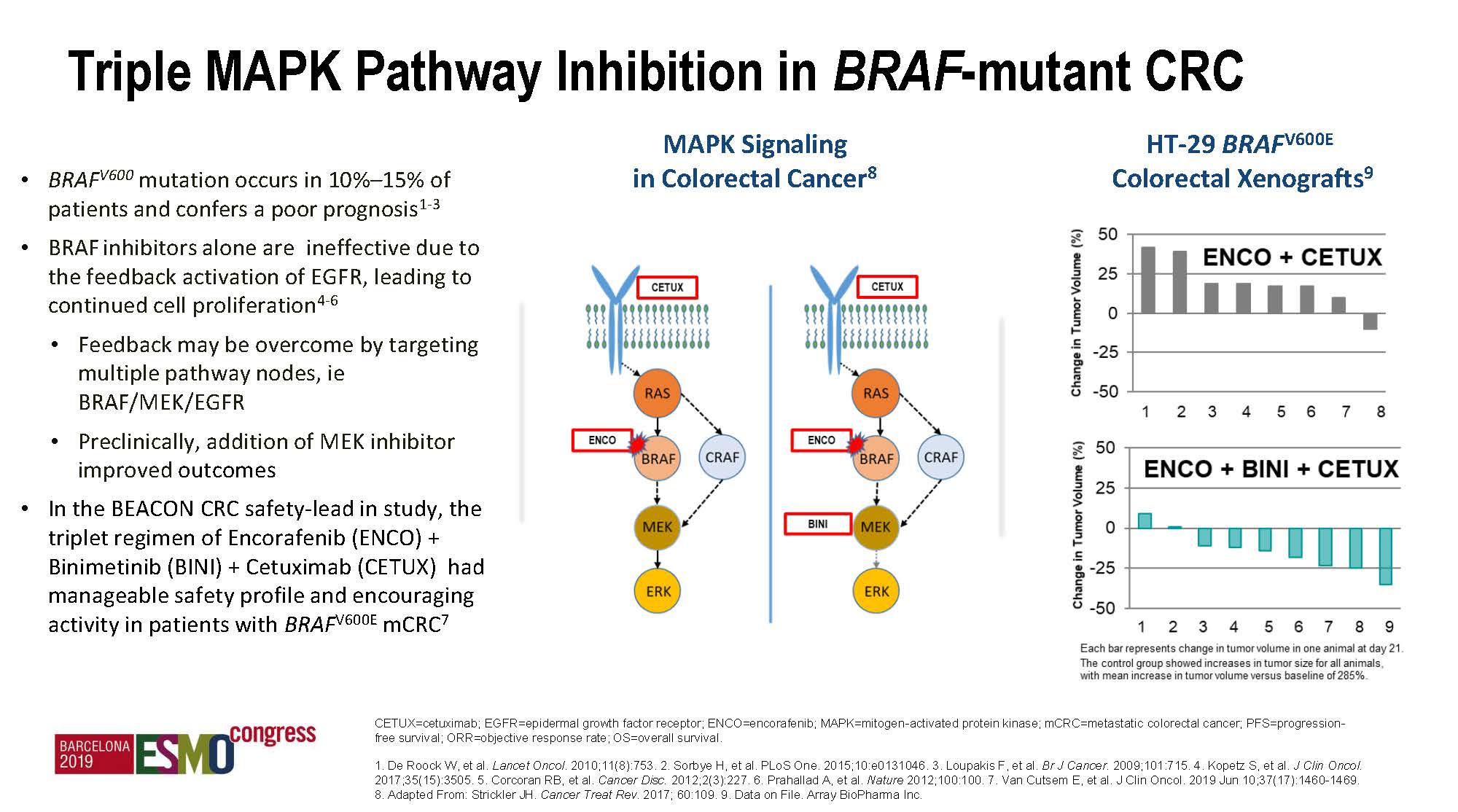
MAPK信号通路(RAS-RAF-MEK-ERK)是EGFR信号传导通路上最重要的一条通路,跨膜受体EGFR的信号传导进入细胞膜后,主要通过MAPK通路进行传导,RAS位于上游,而BRAF、MEK依次位于下游,是通路调控中的关键蛋白激酶,这些激酶均可以通过不同的分子信号激活,再依次通过磷酸化将上游信号传递至下游应答分子,最终将细胞外的刺激信号传导至细胞及核内,从而引起细胞发生增殖、分化、转化及凋亡等生物学反应。阻断BRAF后,由于存在负反馈调节,信号会通过旁路,例如CRAF,绕过BRAF后继续向下游传导,从而使BRAF阻断失去效应,因此,需要同时阻断下游的MEK位点;同时,由于RAS未突变,上游的EGFR信号还会继续下传,因此,也需要在源头上给予EGFR阻断。这就为BRAF突变型mCRC患者的三靶向治疗(抗EGFR、K抗BRAF、抗MEK)提供了理论依据。前期的基础研究也验证了这一点:双靶点(抗EGFR和抗BRAF)或三靶点(增加抗MEK)阻断均可明显提高抑瘤活性,临床研究SWOG1406也证实双靶点治疗是成功的。
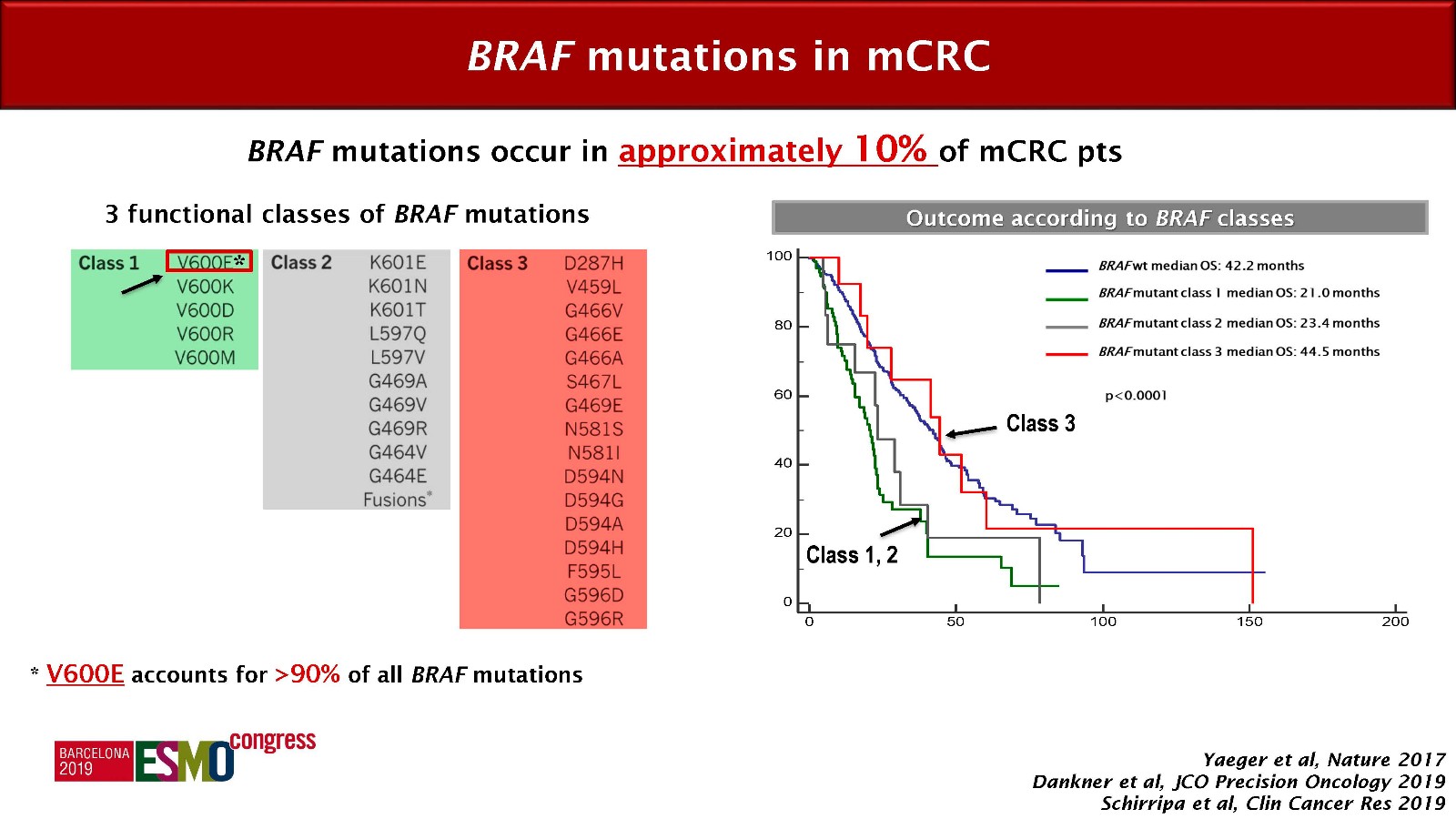
BRAF突变大约发生在10%的mCRC患者中,突变包括众多亚型,其中90%以上均是V600E突变。按功能划分,BRAF突变可以分为三类,其中第1、2类的突变患者预后最差,中位OS在20个月左右,V600E突变即属于第1类突变(均为V600突变);而第三类突变的患者,预后则和BRAF野生型相似,中位生存40个月左右。
针对V600E突变的BRAF抑制剂Encorafenib(商品名Braftovi)和MEK抑制剂binimetinib(商品名Mektovi)联合方案已经被FDA批准用于BRAF突变型黑色素瘤的治疗。
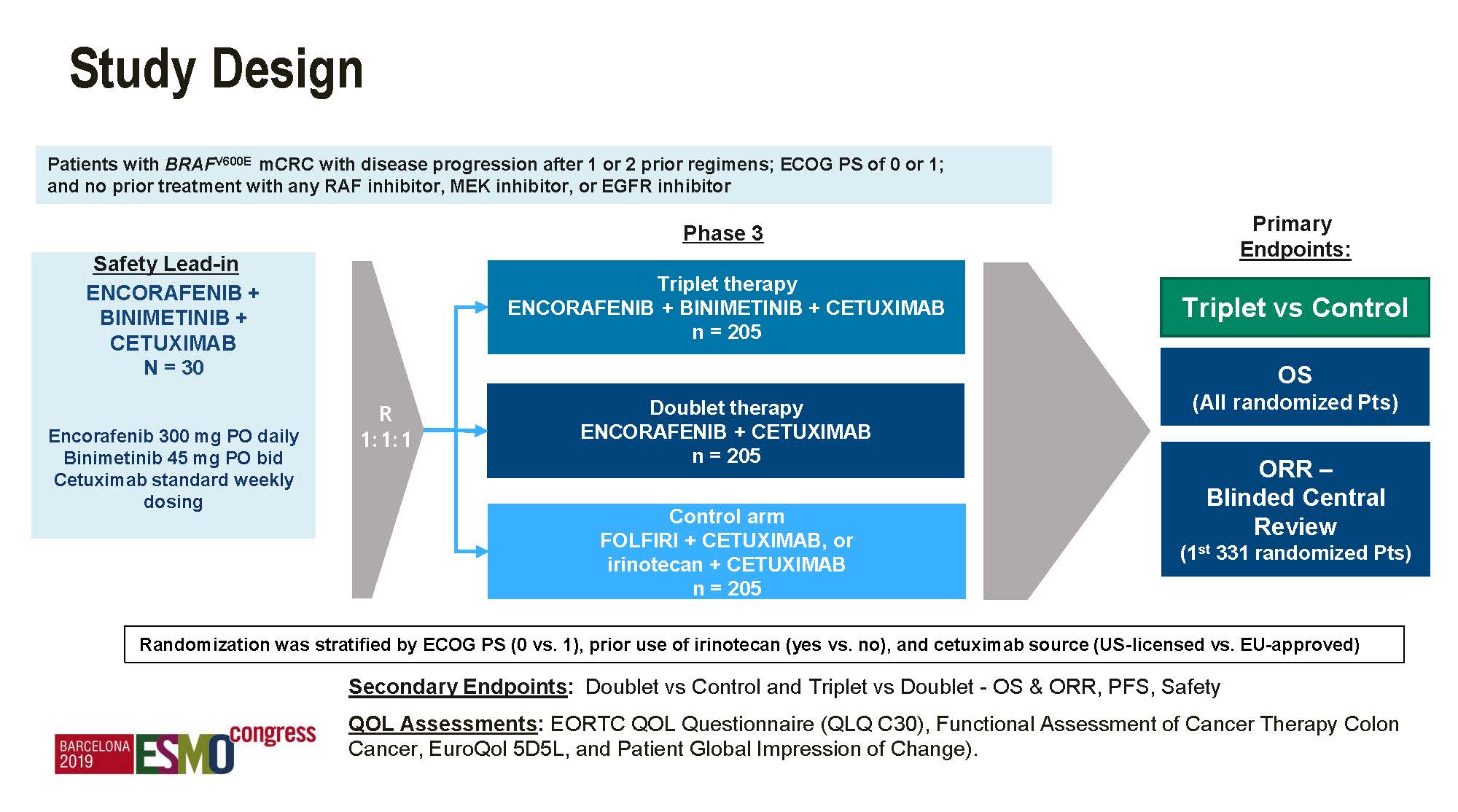
大型III期随机对照研究BEACON正是基于该理论基础来设计的,是第一个也是唯一一个旨在探索BRAF V600E突变型mCRC患者中使用BRAF / MEK抑制剂联合靶向治疗的III期试验,开放标签,三臂,1线或2线治疗失败后的665例患者,既往未曾使用过研究类药物,随机接受研究组三靶向治疗(BRAF抑制剂encorafenib / MEK抑制剂binimetinib / 西妥昔单抗),双靶向治疗(encorafenib / 西妥昔单抗),或由研究者选择的对照组标准治疗-伊立替康或FOLFIRI联合西妥昔单抗。

主要研究终点是三靶向治疗组对比对照组的ITT人群OS和入组的头331例患者的ORR,优效性设计。
受试群体基线特征
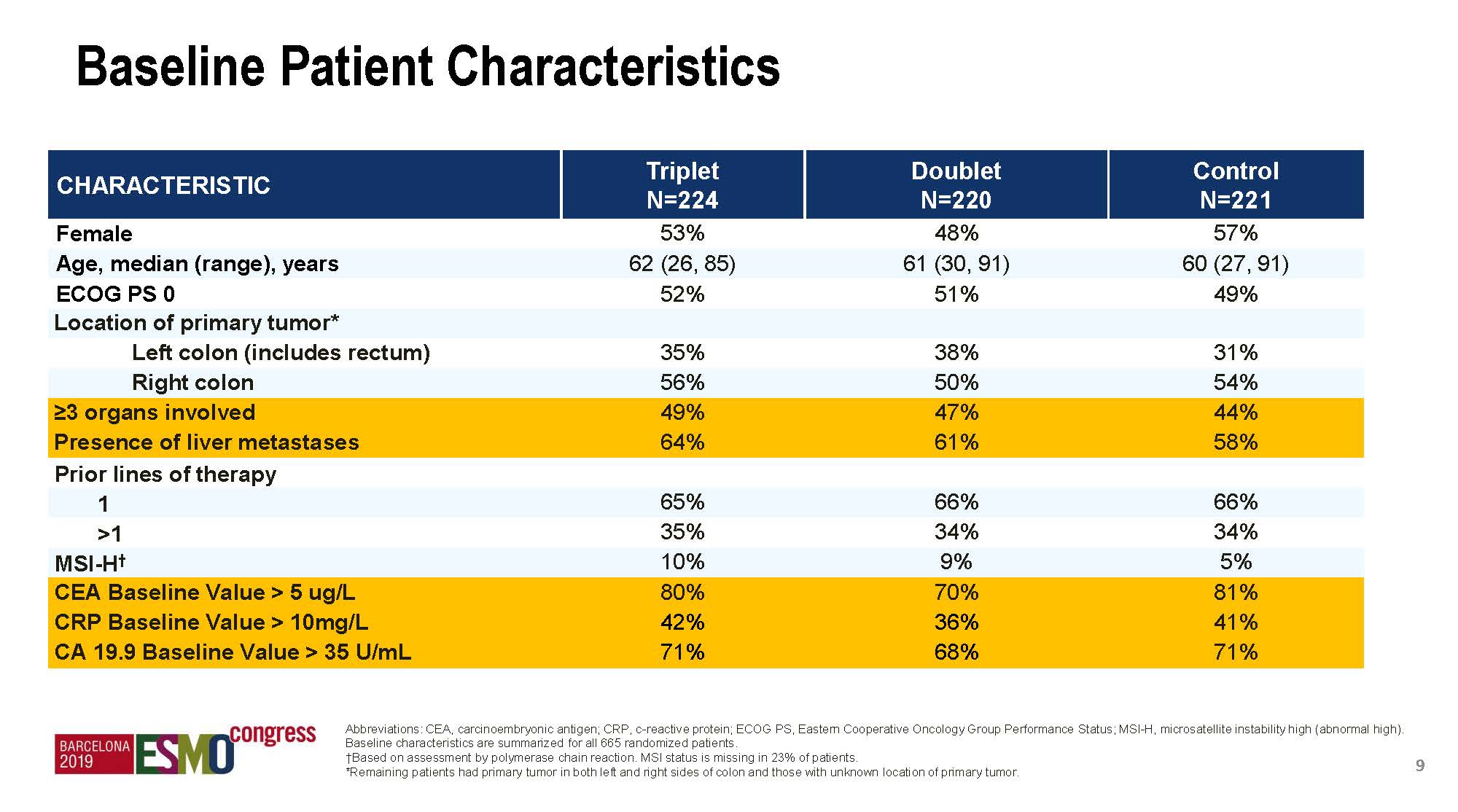
首先,研究入组患者组间差异很小,随机化很均衡。其次,更重要的是,BEACON入组的患者均是经历了既往标准治疗失败、而且具有很多预后不良因素的患者,包括超过3个器官受累、肝转移、基线CEA/CA199或CRP(C反应蛋白)升高等,说明BRAF V600E突变型mCRC是预后非常差的一个群体。
主要疗效结果
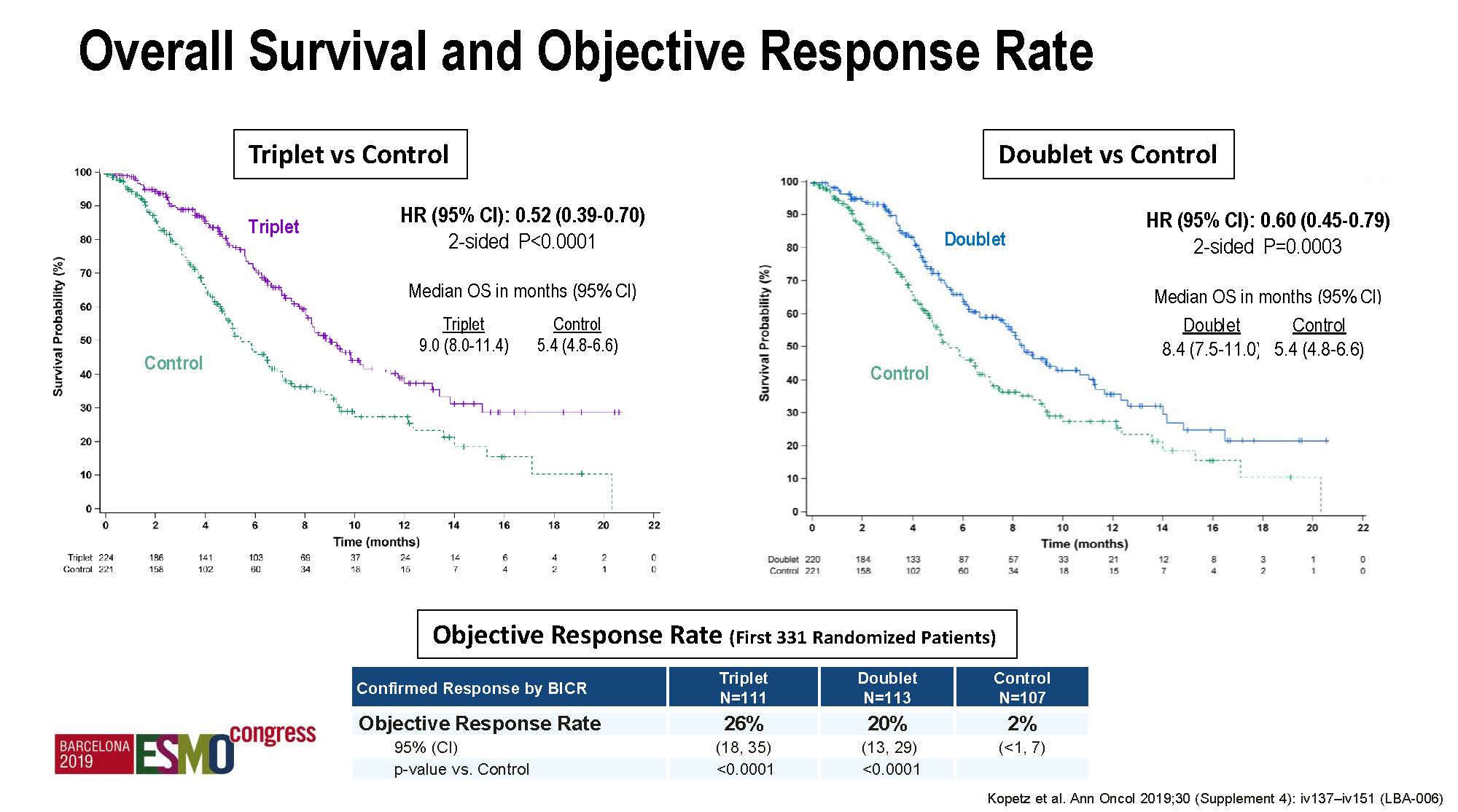
主要终点三靶向组对比对照组的ITT人群OS分别为9.0对比5.4个月,HR 0.52(95%CI 0.39-0.70),p<0.0001; 入组头331例患者的ORR则分别为26%对比2%, p<0.0001;均为阳性结果。此结果事实上在2019年7月的ESMO GI会议上已经报道。上述OS和ORR结果在双靶向组对比对照组中也具有显著性差异,为阳性结果,本次ESMO大会为首次披露。
值得注意的是,ITT人群的中位随访才7.8个月,而入组的头331例患者,中位随访也才12.5个月,这些信息提示上述OS结果可能还不太成熟。
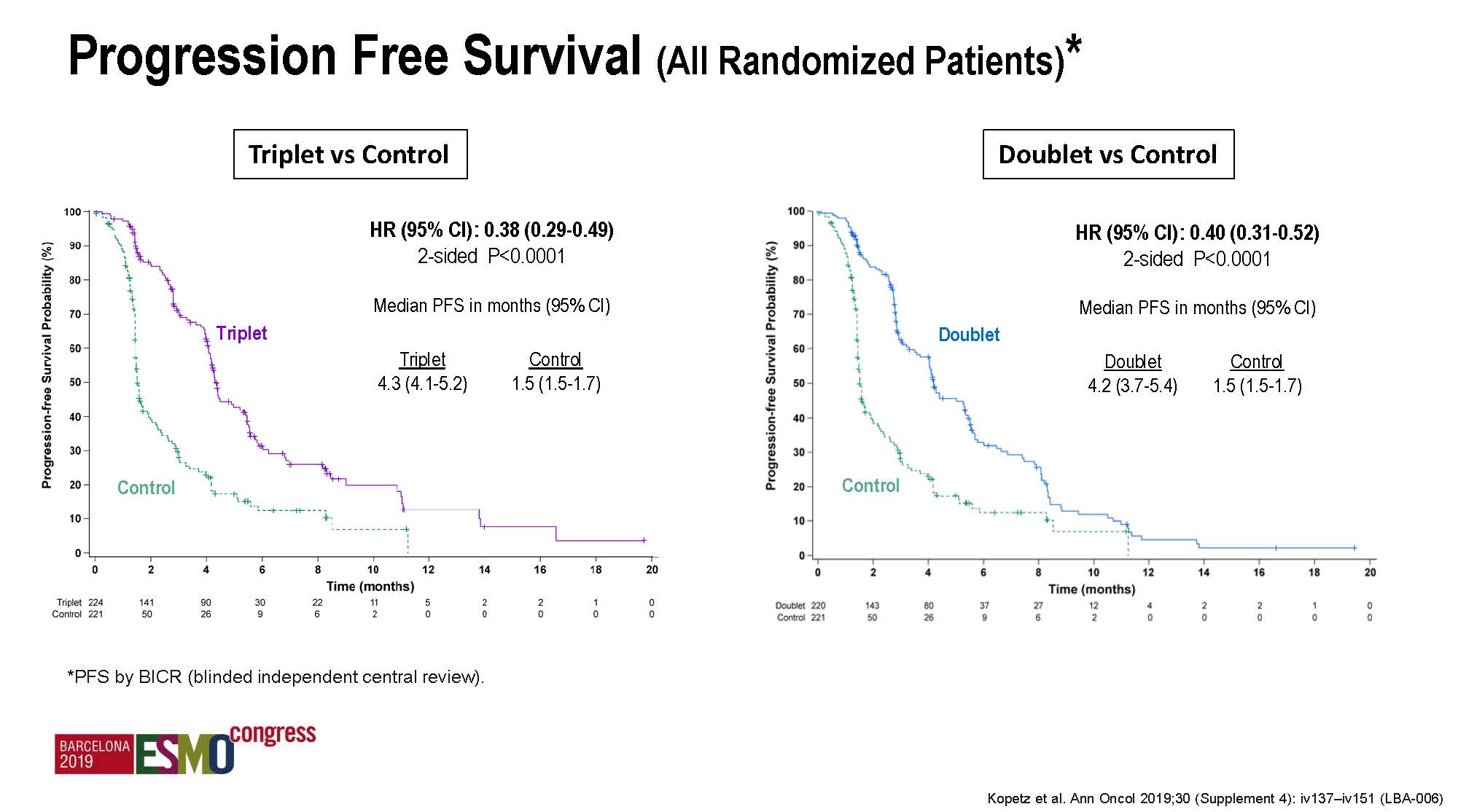
次要疗效结果
本次大会公布了多项疗效结果,主要是对比三靶向和双靶向治疗的差异,需要说明的是这本来不是研究的主要设计目的,完全是事后分析,而且,目前ITT人群的随访时间尚不足以来分析OS数据。
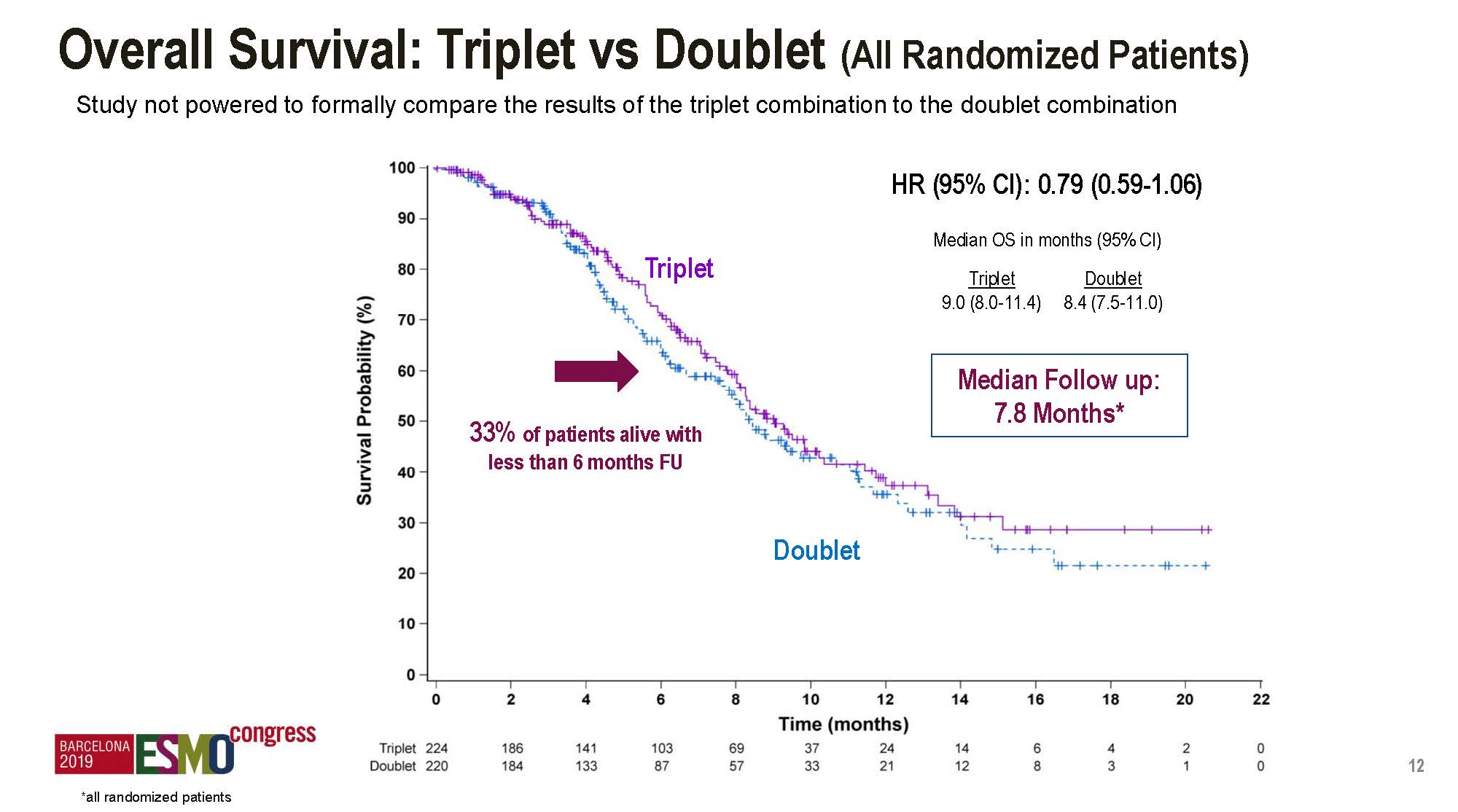
ITT人群中位OS为9.0对比8.4个月。
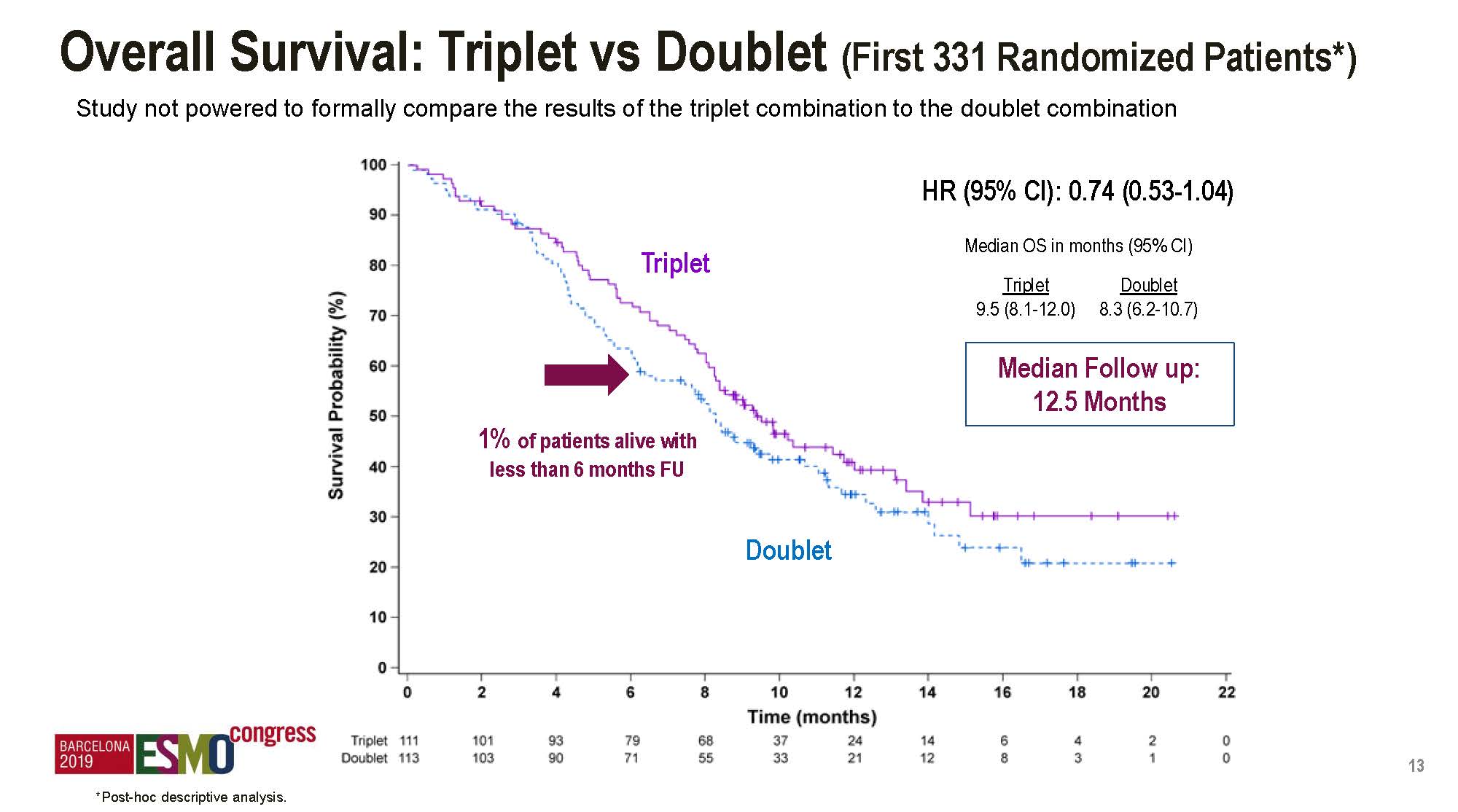
入组头331例患者中,两组的OS分别是9.5对比8.3个月。
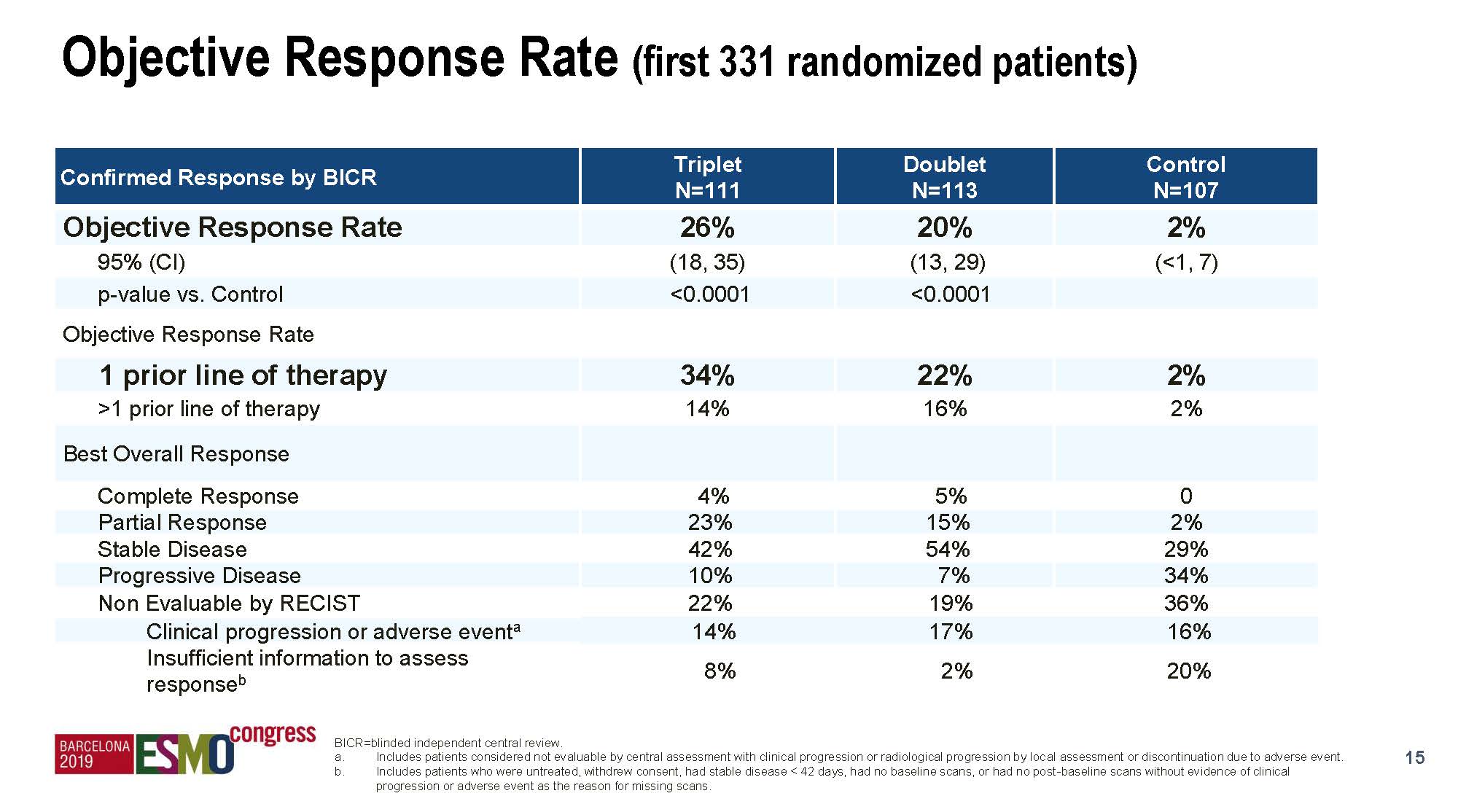
两组的ORR分别是26%和20%,均显著高于对照组的2%。
安全性结果
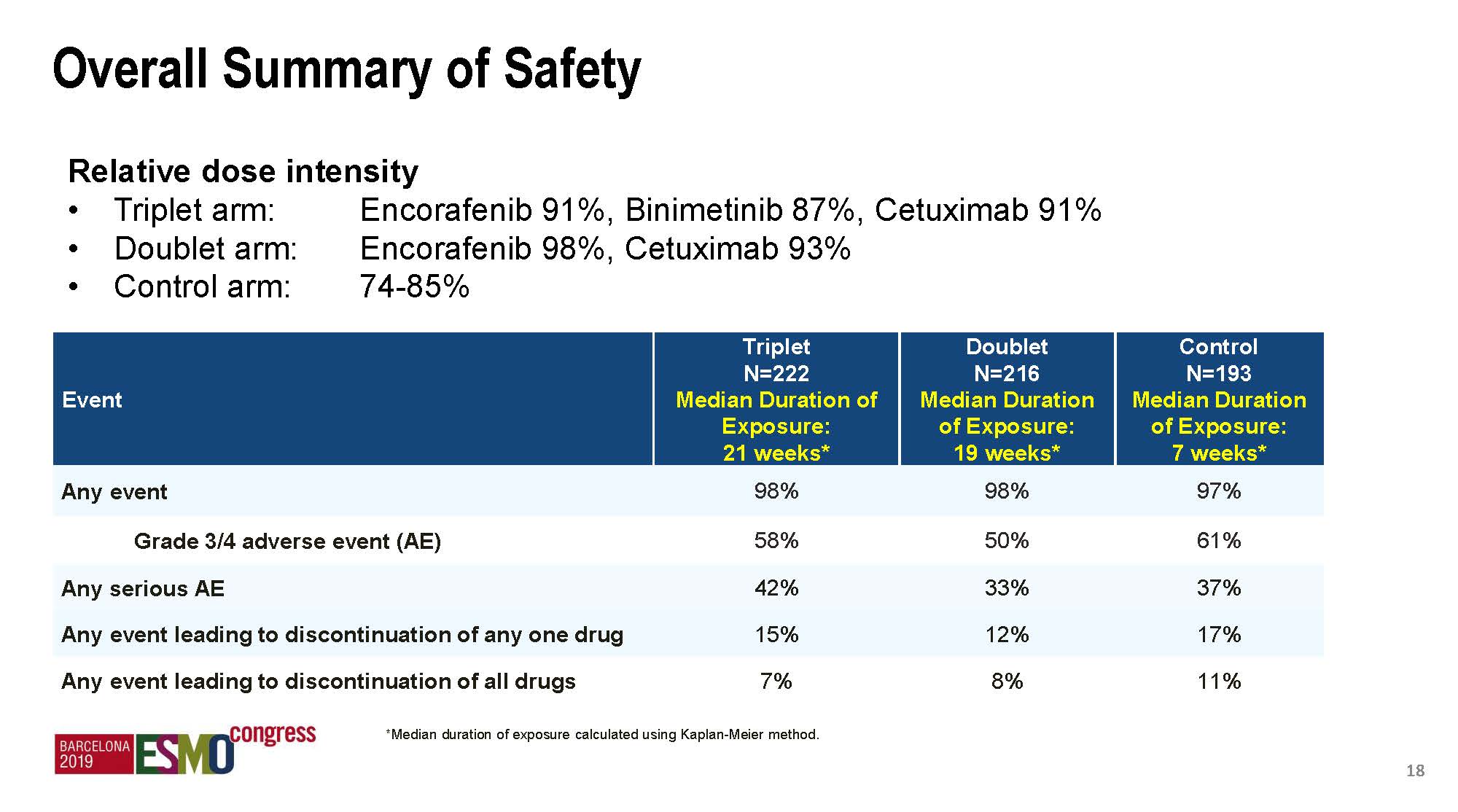
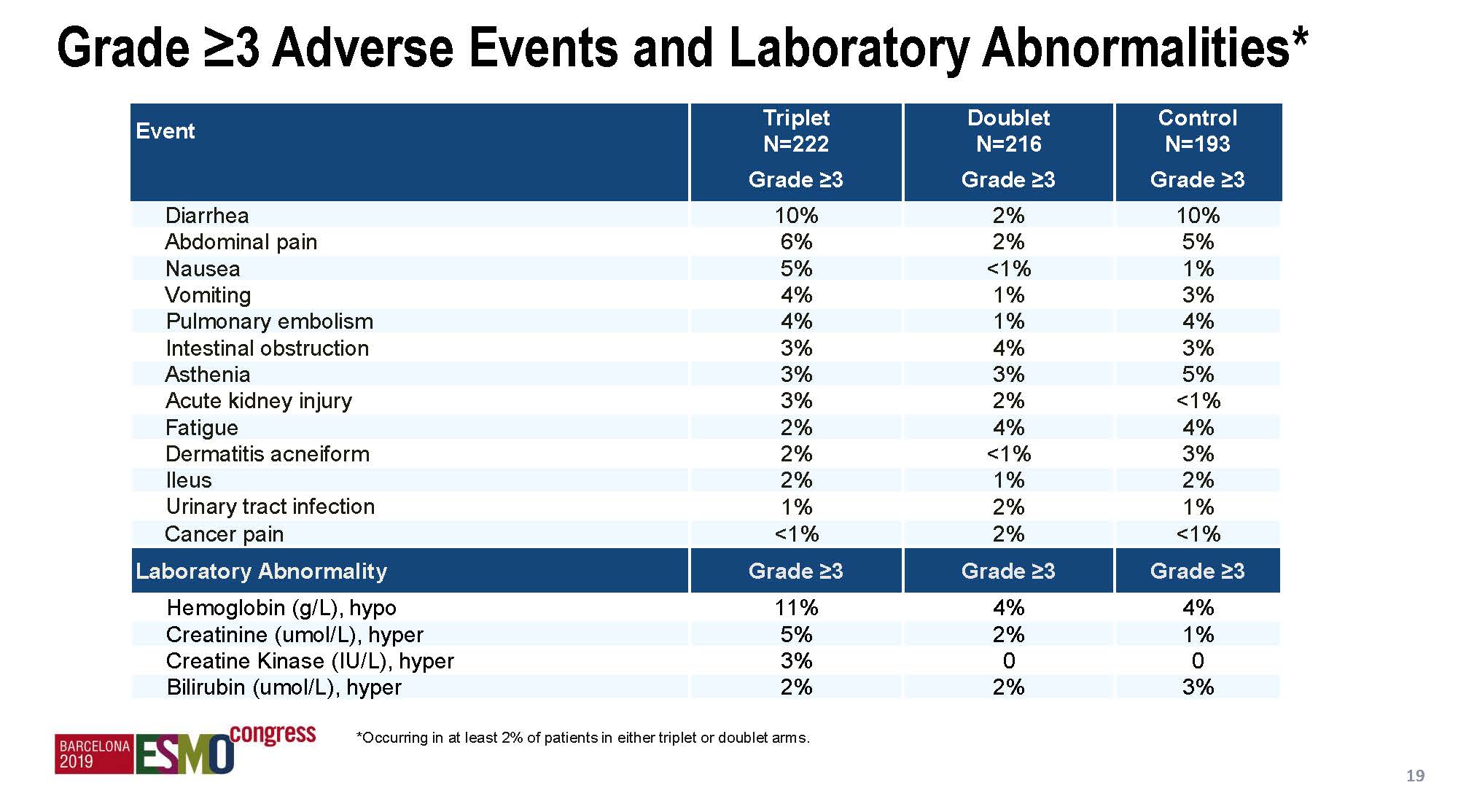
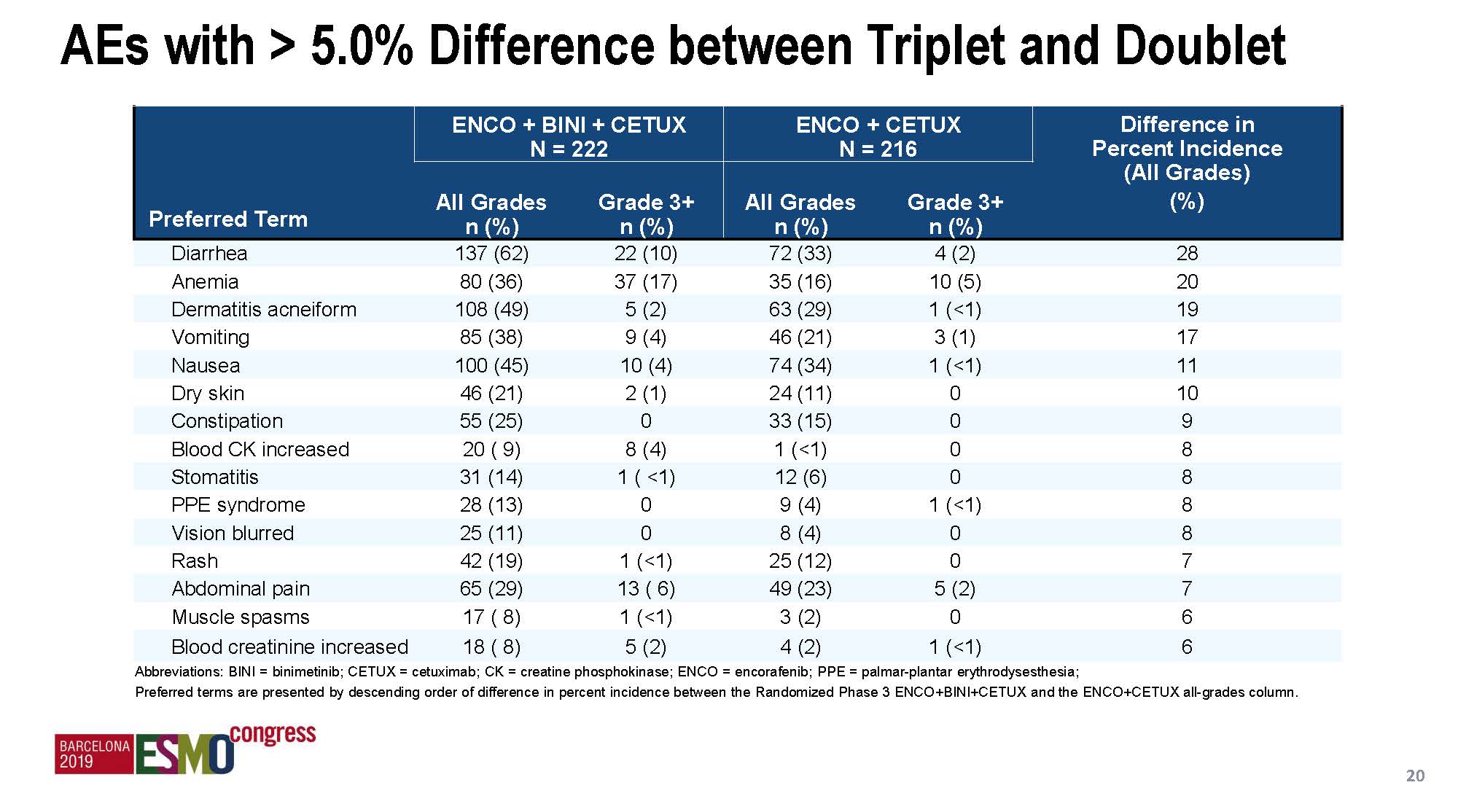
总体来说,治疗毒性都是可控的,三靶向治疗组毒性轻度增加,但双靶向组和对照组的安全性数据具有可比性。增加MEK抑制剂后主要增加的3度以上毒性是腹泻,但和伊立替康组是一样的。三靶向和双靶向组间差异比较大的毒性(差异>10%)还包括贫血、痤疮样皮肤炎、呕吐、恶心和皮肤干燥。
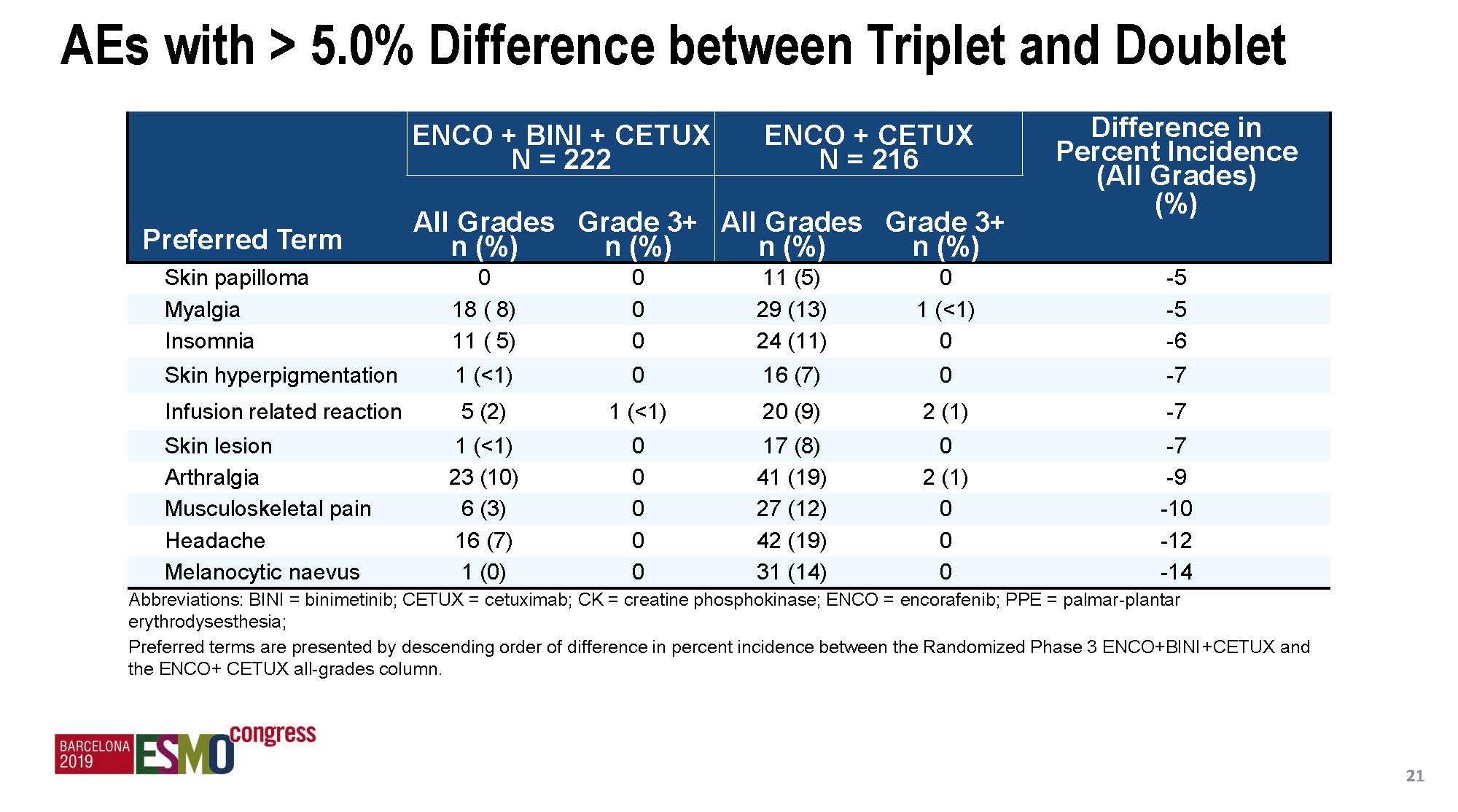
有趣的是,增加MEK抑制剂以后,某些毒性却出现了下降的趋势,包括皮肤色素沉着、输注反应、皮肤病损、关节疼痛、骨骼肌疼痛、头痛和色素性黑痣等,提示这可能与MEK抑制剂的主要作用机制有关,也不除外药物互相作用的可能。
结论

BEACON研究发现不论三靶向(抗EGFR+抗BRAF+抗MEK)还是双靶向(抗EGFR+抗BRAF)治疗,对比标准治疗伊立替康或FOLFIRI+抗EGFR治疗,均能显著改善BRAF突变型mCRC经治患者的总生存,并显著提高ORR,毒性有所增加,尤其是BRAF相关的一些副作用,但都是可以处理的,为该群体患者确立了一种全新的治疗模式。未来研究的重点会聚焦于三靶向和双靶向两种方案的细化分析,包括生存获益、治疗毒性乃至花费。
研究解读与临床启示
首先,可以明确的是,在我看来,这是今年ESMO年会肠癌领域最重要的一项研究,我认为它是继SWOG1406研究之后BRAF突变型mCRC领域另一个更加重要的研究,将精准医学在晚期肠癌临床实践大大向前推进了一步,让我们进入了BRAF时代。
想必这也是在大会口头报告的当天(2019-9-30),临床医学全球最顶尖杂志NEJN同步在线全文发表BEACON研究的原因。难能可贵的是,BEACON的主要研究者、来自美国MD ANDERSON癌症中心的Scott Kopetz教授也是SWOG S1406研究的主要PI,他的团队一直致力于BRAF、EGFR通路的相关基础、转化及临床研究,终于结出了累累硕果,也是基础研究向临床转化的典范,最终让患者受益。

为何说BEACON研究开创了一个新时代呢?我认为最关键的是基于基础研究的发现与构思,它颠覆了传统的抗EGFR治疗单一靶点阻断治疗理念,提供了一种全新思路与全新理论。本质上来说,BEACON模式的治疗,还是属于抗EGFR的治疗,BEACON最大的价值在于认识到不但要在源头上抗EGFR,而且还要阻断下游的整个MAPK通路上任何一个突变位点,来保证整个EGFR通路的完整性,为抗EGFR发挥疗效扫清障碍。最终不但取得了成功,也为癌症治疗的其他联合治疗模式提供了范例。
EGFR通路是肠癌最重要的信号传导通路,除了MSI-H肠癌的免疫治疗,抗EGFR治疗应该算肠癌第一个、也是迄今为止唯一一个能称得上精准医学的治疗方法,但在SWOG S1406、BEACON研究出来以前,我想我们对mCRC患者中抗EGFR治疗理念是有一些理解偏差或误解的,那就是单一靶点阻断的治疗理念,比如,既往使用EGFR单抗来治疗BRAF突变型患者,其实收效甚微,这在NCCN指南的近10年更新中反映得最突出,对于BRAF突变的问题,NCCN指南经历了很长的一个变化过程,其实,早在2008年,业界已经发现BRAF突变的mCRC患者,对EGFR单抗的疗效欠佳,但与不使用的患者来比较,还是有少许获益,因此,NCCN指南只是认可了BRAF突变的预后价值,对于将其用于EGFR单抗疗效预测的观点上,一直没有确认,只是增加了一条警示,说“BRAF突变患者似乎不太可能从EGFR单抗治疗中获益”,直到2019年,从首次认可了BRAF突变的疗效预后价值,将EGFR单抗(西妥昔单抗和帕尼单抗)的使用限制首次增加了BRAF野生这个条件,也就是需要RAS/BRAF双野生。
之后当BRAF抑制剂维莫非尼在黑色素瘤取得了很大成功以后,还是那种“单一靶点阻断”的惯性思维使然,很快在BRAF突变型mCRC中使用同样治疗模式:单一的抗BRAF治疗,结果是非常令人失望的。直到SWOG S1406,联合使用EGFR单抗和BRAF抑制剂,取得了巨大成功,也为BECON研究打下了坚实的基础。
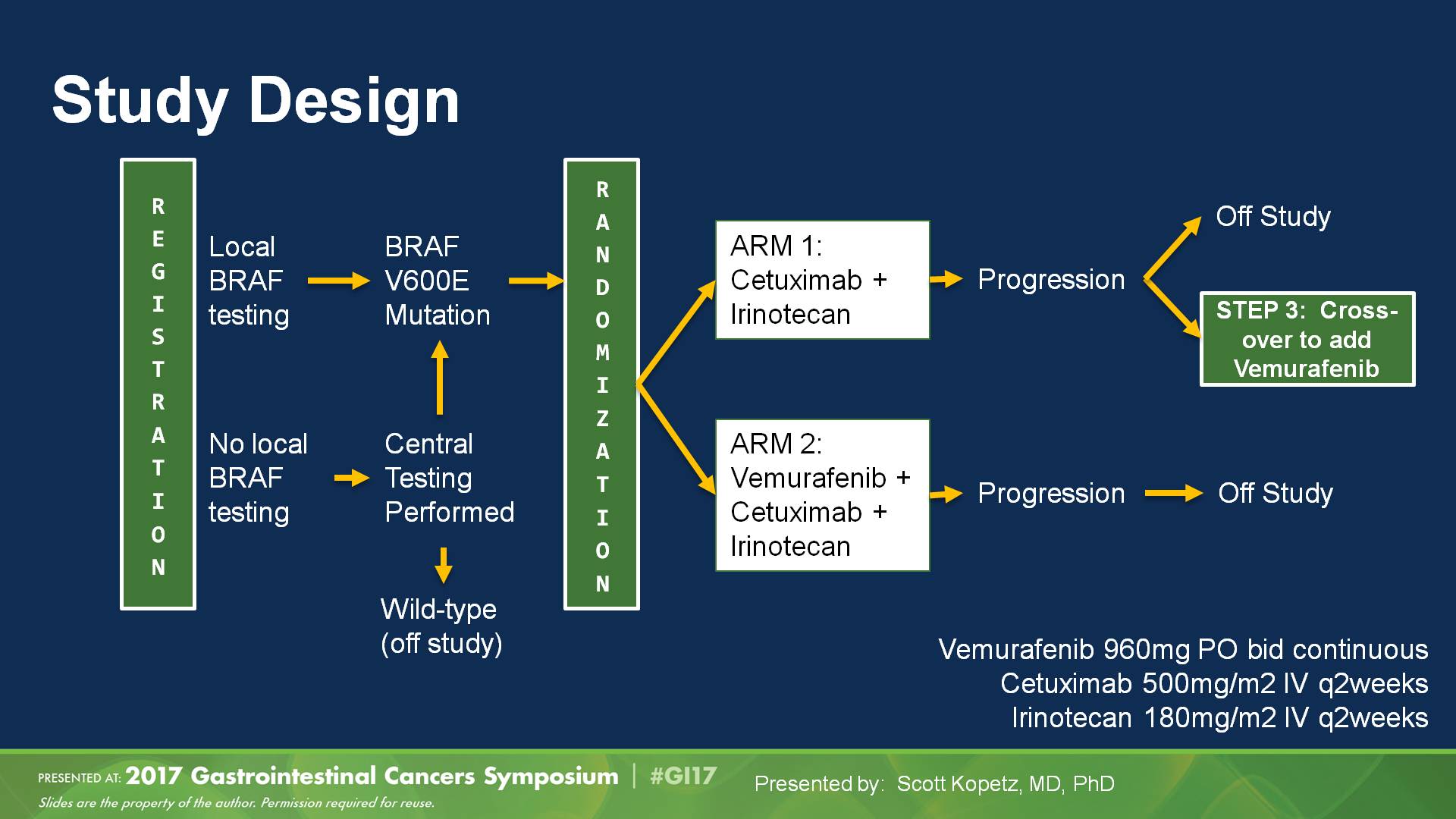
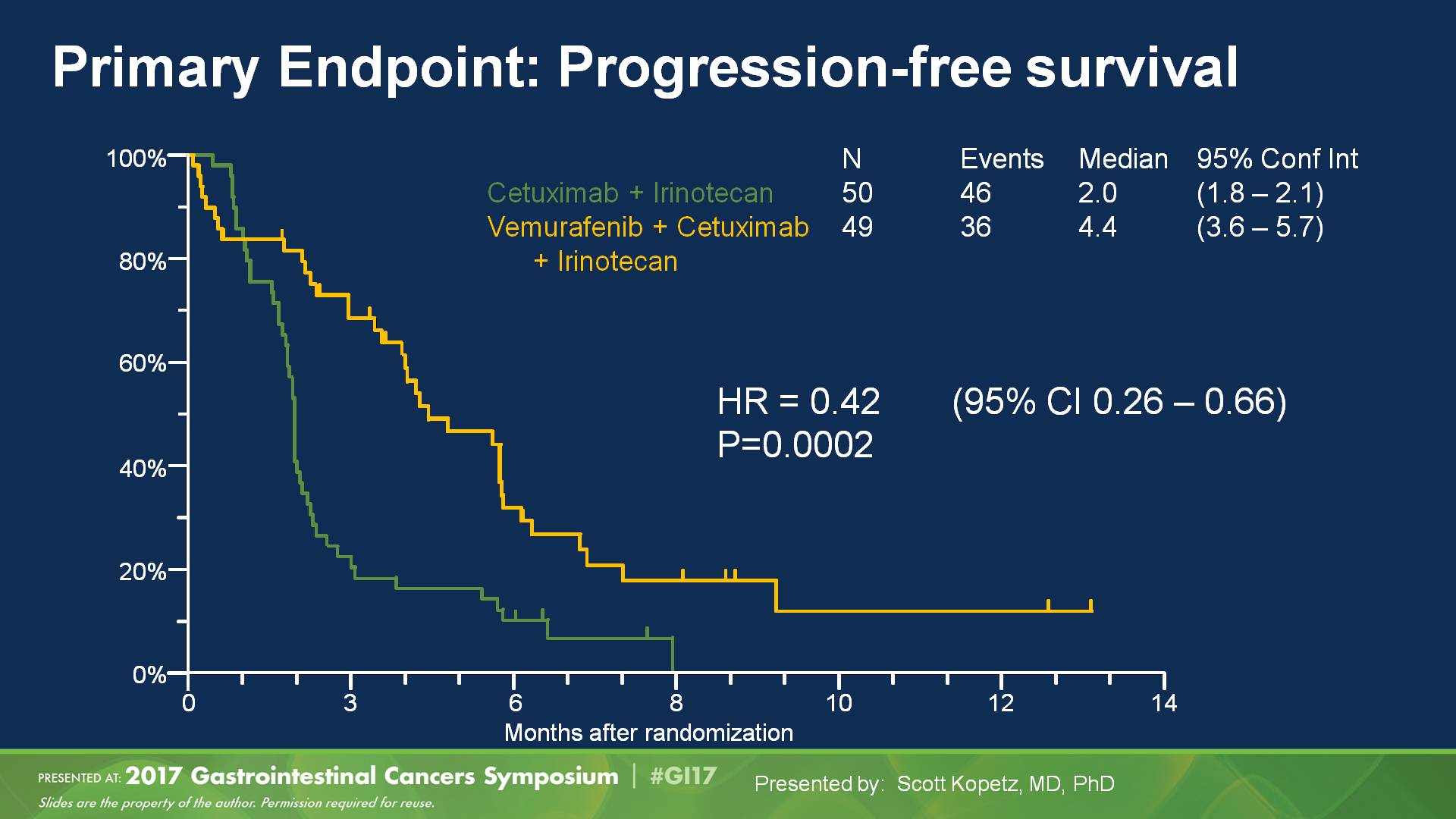
图:SWOG S1406研究设计及主要终点PFS结果
而BEACON研究将这种“靶点全阻断”理念进一步升华,并且初步看到了成效,从研究结果来看,与双靶向组合比较,增加了一个MEK抑制剂似乎带来的疗效获益不是很显著,ORR仅提供了6%,OS暂时未看到明显改善,抛开随访时间不够的问题,增加MEK抑制剂后体现出来的疗效增益趋势还是有的,当然还是没有双靶向组合对比标准对照组治疗那么很明显的,说明MEK抑制剂带来的获益没有EGFR单抗联合BRAF抑制剂带来的获益大。临床试验中这种获益在黑色素瘤领域也得到了印证。
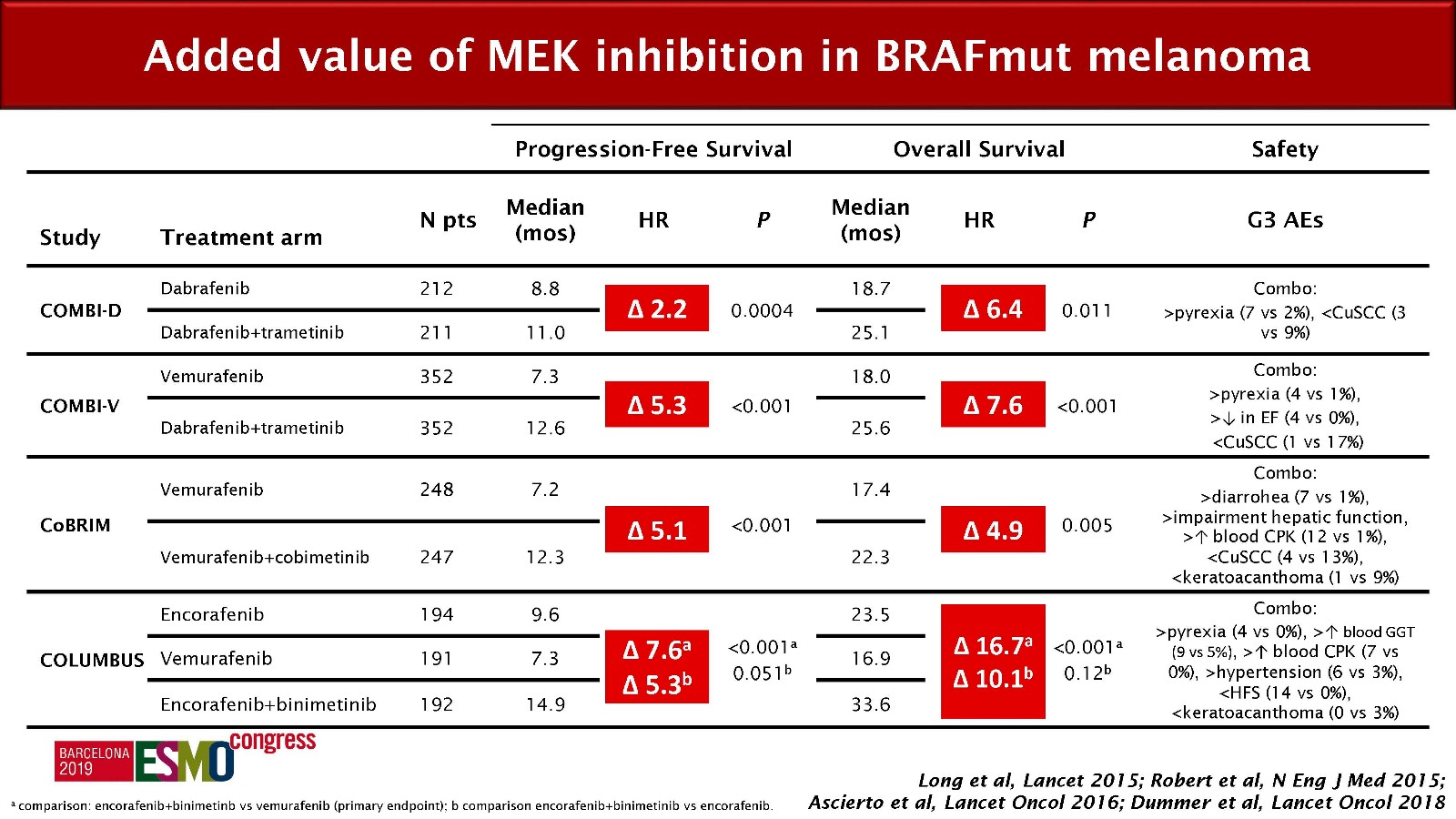
图:BRAF突变型黑色素瘤中MEK抑制剂联合BRAF抑制剂的价值
理论上这似乎可以从MAPK通路的结构得到解释,MEK位于RAF的下游,对整个通路的影响要弱于BRAF,就像BRAF位于RAS的下游,因此,影响也没有RAS突变那么明显一样。还有另外一个问题,突变的丰度会不会有影像?不同的BRAF突变丰度,负反馈旁路到MEK位点的信号会不会有差别?可以推测,这个负反馈信号越强烈,也许MEK抑制剂的价值就会越大,这些问题都需要更多的基础研究来验证和回答。但BEACON研究中三靶向组合较双靶向组合体现出来的疗效获益趋势,已经从某种程度上印证了“全靶点阻断”理论的正确性。
其次,为何说BEACON开创了晚期肠癌精准医学实践的一个新时代-BRAF时代呢?因为指南和实践都因此改变了。
NCCN指南2019版最大的更新即是将BEACON研究中的三靶向、双靶向和SWOG S1406研究的VIC方案(伊立替康+维罗非尼+西妥昔单抗,类似于双靶向组合)推荐用于BRAF V600E突变型肠癌的末线治疗;
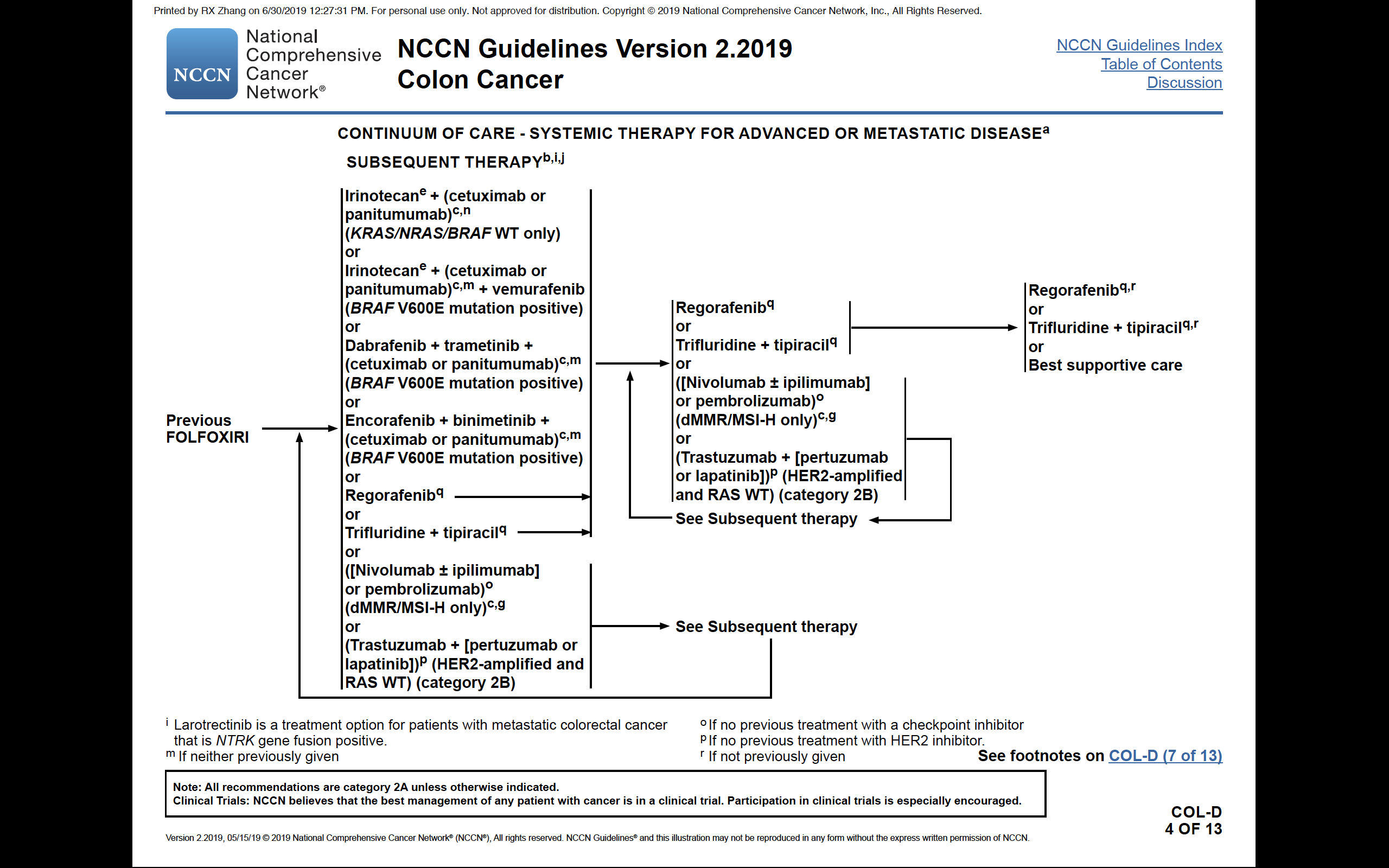
图:2019版NCCN指南关于BRAF突变型mCRC治疗的更新
与此同时,2019版CSCO肠癌指南也纳入了这样治疗理念,增加了VIC方案用于BRAFV600E突变型肠癌的三线姑息治疗。遗憾的是,BEACON研究中使用的BRAF抑制剂Encorafenib(商品名Braftovi)和MEK抑制剂binimetinib(商品名Mektovi)均未在中国大陆上市,相信不久的将来,这些新型药物也定能来到中国,CSCO指南也会更新,中国的患者将可以接受这一最新治疗方案。
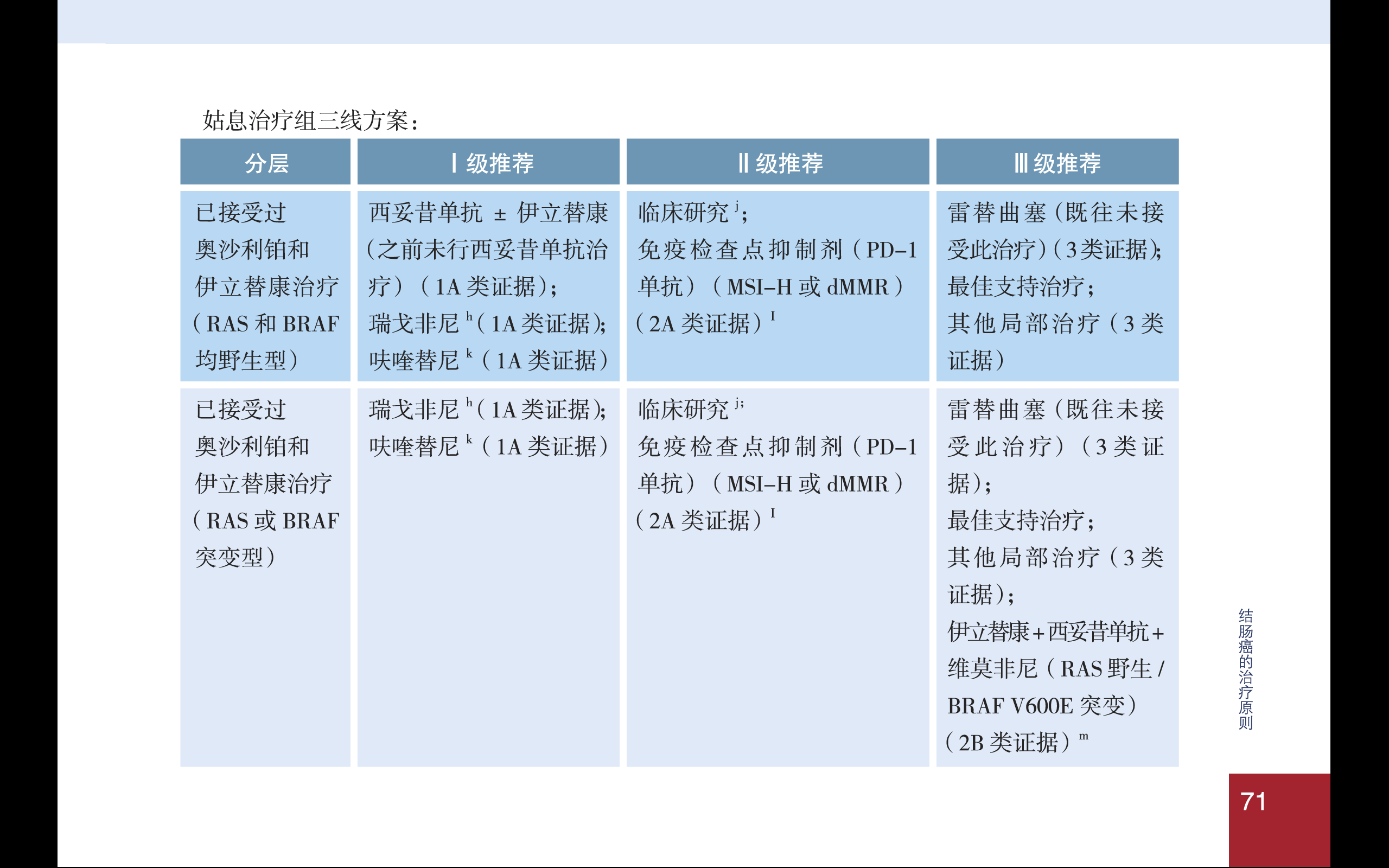
图:2019版CSCO指南关于BRAF突变型mCRC治疗的更新
那么,关于BRAF突变型mCRC治疗的现状和未来的方向是什么呢?
首先是三靶向还是双靶向的问题,临床实践中除了疗效,还要考虑安全性、耐受性及费用,综合来看,可以预见得到,未来相当长一段时间,双靶向组合也许会是临床使用的主流,除非在OS疗效数据得到更多证据,或者药物可及性大大提高、药物成本大幅降低以后,三靶向也会成为临床治疗主流。
其次,就是治疗的时机问题,何时可以用到一线?BRAF突变型mCRC目前最佳的一线治疗模式应该是含贝伐单抗的强烈治疗,根据患者身体情况选择联合单药、两药或三药化疗,身体允许者,三药FOLFOXIRI+贝伐单抗是目前的标准,EGFRi+BRAFi+/-MEKi这种精准多靶向治疗模式何时能用于一线治疗,目前尚不清楚,这会是最近几年探索的热点话题,但我相信总有一天会成为一线治疗的。
另外,特别需要注意的是BRAF突变mCRC中,MSI-H的比率要高于整体的mCRC群体,而且对免疫治疗应答好。2018年ESMO年会报道的CheckMate 142研究中,45例MSI-H的mCRC中,BRAF突变者就有17例,一线治疗单纯使用PD-1单抗Nivolumab和CTL-A4单抗Ipilimumab治疗,ORR竟高达71%,高于其他的MSI-H人群,这是前所未有的,即便在富含BRAF突变人群的TRIBE 2研究里,FOLFOXIRI+贝伐单抗的ORR也才有62%,这还是ITT人群,而非BRAF突变人群,后者也许更低。鉴于免疫治疗在该群人中的特殊疗效,如果合并MSI-H的BRAF突变mCRC,应该首先考虑PD-1单抗免疫治疗,未来不管是一线还是末线治疗,也许抗EGFR/BRAF/MEK的靶向治疗均要让位于PD-1单抗免疫治疗。
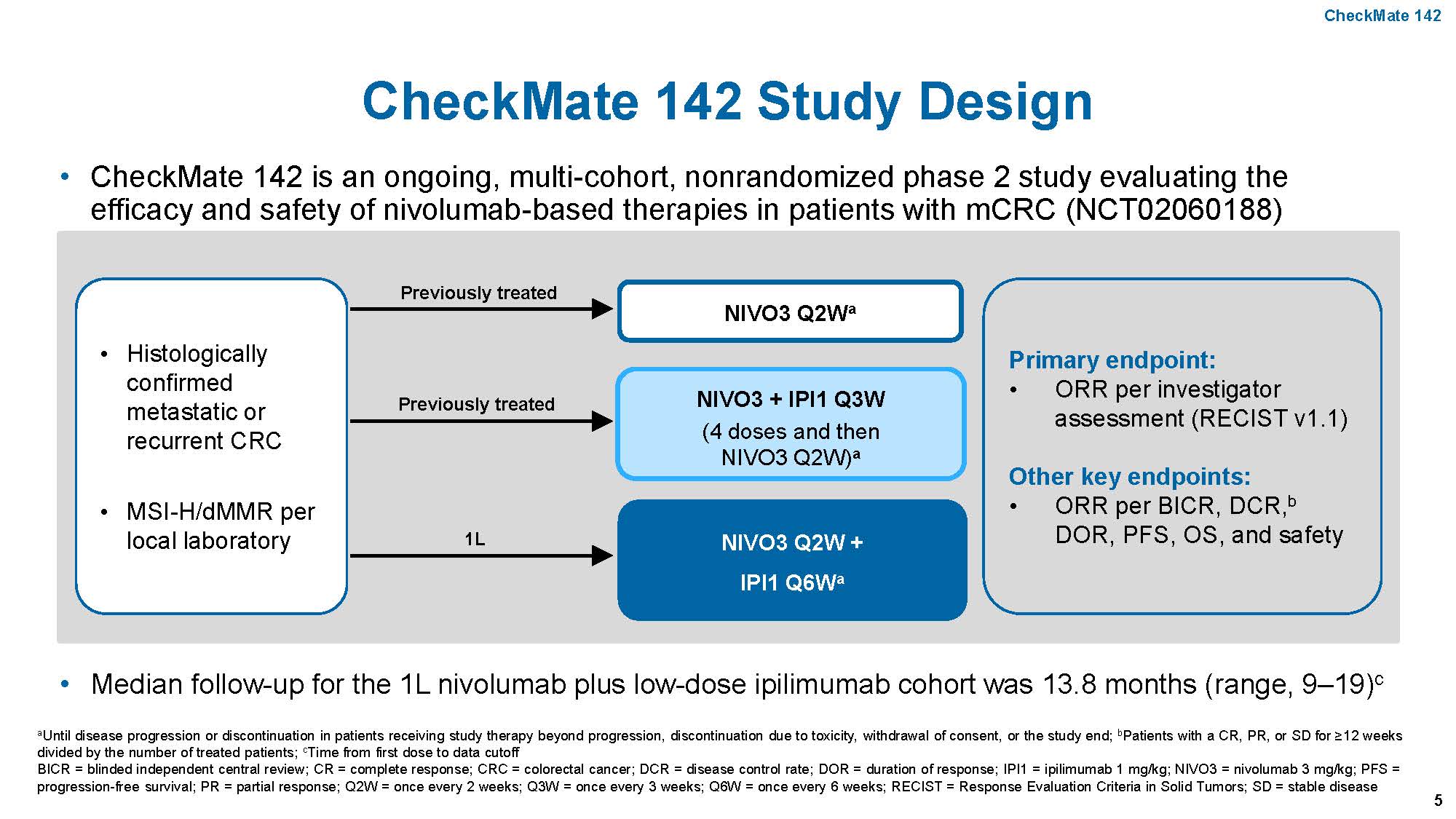
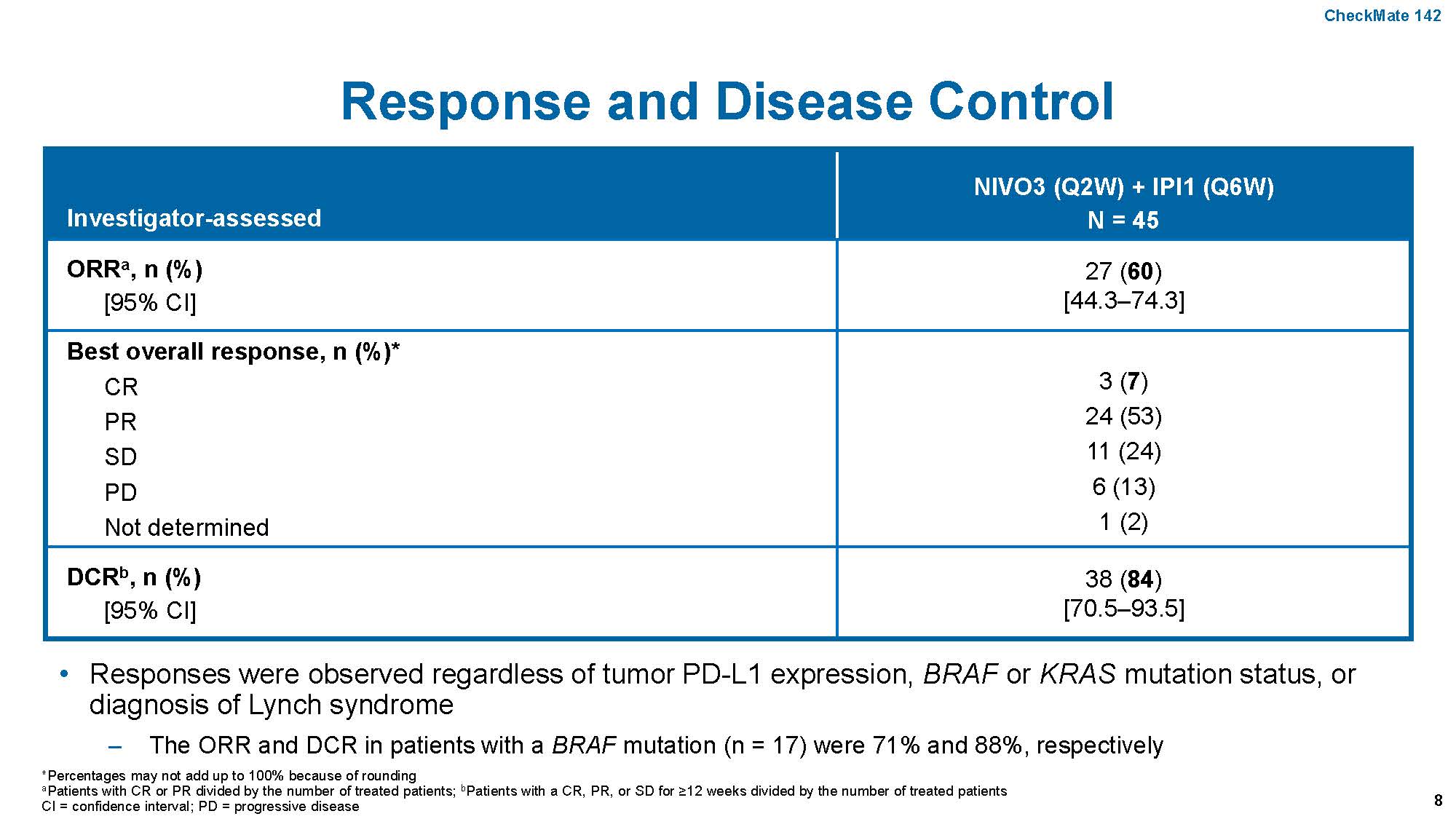
图:CheckMate 142设计及主要终点ORR结果
现阶段对于mCRC患者,只要有条件,均应在临床实践中践行精准医学,至少应该检测如下三个基因:RAS、BRAF、MSI-H,结合原发瘤部位,将患者分为三个群体:MSI-H群体,RAS/BRAF野生型的左半群体,其他mCRC群体;三个群体的一线治疗均应有优选方案,而到了末线治疗,则应该全面践行精准医学原则和“异病同治”理念,见下图。相信在不久的将来,HER2的检测也将列入到抗EGFR治疗的基础检测中。

总之,尽管走得有点慢,但结直肠癌精准治疗的时代已经开启,而BRAF突变型mCRC的治疗变迁正是这个精准医学时代的缩影,让这个本来预后最差的mCRC群体,迎来了新的希望。
供稿 | 陈功(中山大学肿瘤防治中心)
编辑 | 刘婷(中国医学论坛报)
查看更多