查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





原发性胆汁性胆管炎(PBC)是一种以肝内小胆管慢性、进行性破坏为特征的自身免疫性疾病[1]。肝脏免疫耐受的打破和免疫系统的异常激活造成肝内小胆管上皮细胞(biliary epithelial cells,BEC)进行性、连锁性损伤,形成免疫级联破坏反应。
正常情况下,当低浓度抗原进入肝内,肝内的抗原呈递细胞如Kupffer细胞、肝窦内皮细胞和树突状细胞通过下调主要组织相容性复合体(major histocompatibility complex,MHC)分子的表达以阻断抗原的加工和处理,并且下调共刺激分子CD80和CD86的表达、分泌TGFβ促进调节性T淋巴细胞(regulatory T cell, Treg)的分化来抑制效应T淋巴细胞的增殖,从而维持肝脏免疫耐受[2-3]。
PBC的发生受遗传和环境因素影响[1]。全基因组关联研究[3-4]发现,位于6号染色体短臂上的人类白细胞抗原(human leukocyte antigen, HLA)等位基因中HLA-DQA1、DQB1、DRB1、DPB1和IL-12A在内的40个非HLA基因是PBC的易感基因位点。PBC的免疫攻击是针对一种普遍存在的线粒体抗原,即丙酮酸脱氢酶复合物E2亚基(the E2 component of pyruvate dehydrogenase complex, PDC-E2)的脂酰结构域的硫辛酸结合残基。带有PBC易感基因的宿主接触外界抗原后在体内将这些抗原代谢或与自身分子结合,形成与PDC-E2结构相似的新抗原而导致机体免疫反应激活、肝脏免疫耐受被打破[5-6]。
肝内小胆管的内壁由BEC构成[6]。当大量外源性物质(如细菌脂多糖、食物抗原、化学品、药物等)从肠道吸收经门静脉循环通过肝内小胆管时,BEC通过其表面的Toll样受体主动结合脂多糖等外界抗原,并分泌细胞因子和趋化因子如IL-6、IL-8、TNFα、CX3CL1等吸引肝内外免疫细胞使自身凋亡[5, 7-9]。与其他细胞不同的是,当BEC启动自身凋亡时,其内的谷胱甘肽对PDC-E2巯基的共价修饰使PDC-E2抗原表位暴露,引发B淋巴细胞、巨噬细胞、NK细胞、NKT细胞和T淋巴细胞相继激活并靶向攻击邻近的BEC;损伤的BEC将PDC-E2转运到凋亡小体中,后者被邻近的正常BEC吞噬,引起一系列针对BEC的免疫级联反应[6-7, 10]。
BEC被攻击后暴露出PDC-E2,激活抗原特异性B淋巴细胞,后者增殖并分泌IL-6、IFNγ和TNFα促进Th1、Th17细胞增殖分化启动对其他BEC的损伤,同时抗原特异性B淋巴细胞分化为浆细胞产生大量AMA[11-12],凋亡小体中的PDC-E2被AMA识别并与之结合为AMA-载脂蛋白复合物,进一步激活巨噬细胞而引发周围的BEC损伤[13]。
巨噬细胞响应BEC分泌的趋化因子信号被募集到肝脏中,AMA-载脂蛋白复合物刺激巨噬细胞, 后者通过肿瘤坏死因子相关的凋亡诱导配体直接攻击BEC并产生IL-6、IL-1β、IL-8、IL-12和TNFα,促进周边BEC大量凋亡[13]。此外,巨噬细胞表达的炎症小体NOD样受体蛋白-3的激活,促进炎性因子如IL-18、IL-1β的释放,进而促进了BEC的凋亡[7]。
Fu等[14]利用PBC小鼠模型发现,高浓度脂多糖刺激Kupffer细胞产生TNFα和IL-12,这些细胞因子一方面作用于BEC,另一方面刺激NK产生INFγ介导BEC损伤[14-15]。NK/BEC比值的变化[16]决定NK对小胆管的损伤程度;将NK与BEC共培养,在NK/BEC低于0.5时,NK通过分泌IFNγ促进BEC上MHC-Ⅰ类和MHC-Ⅱ类分子的表达,NK上的抑制型受体即杀伤免疫球蛋白样受体(KIR)易与MHC-Ⅰ类分子结合,抑制NK对BEC的杀伤活性、保护BEC免受NK的裂解;在NK/BEC高于0.5时,BEC表面的MHC-Ⅰ类分子表达减少或缺失,导致KIR与MHC-Ⅰ类分子的结合减少,NK对BEC的保护作用减弱,同时NK表面的活化型受体NKG2D与巨噬细胞表面的MHC-Ⅰ类相关链A结合,使NK激活并直接攻击BEC[13-14, 16],导致小胆管的碎裂。在PBC患者的外周血和肝脏中,NK细胞数量持续增加并靶向攻击BEC[13],使BEC损伤并减少,NK/BEC比例失衡引发持续的小胆管损伤。此外,BEC通过向NKT呈递脂质抗原,下调表达MHC-I类分子CD1d,导致NKT分泌IFNγ并通过FasL途径介导BEC损伤[5, 17]。固有免疫细胞不仅直接参与凋亡BEC的靶向攻击,还参与损伤周边正常的BEC并维持持续的炎症反应,最终导致了小胆管大量损伤(图 1)。
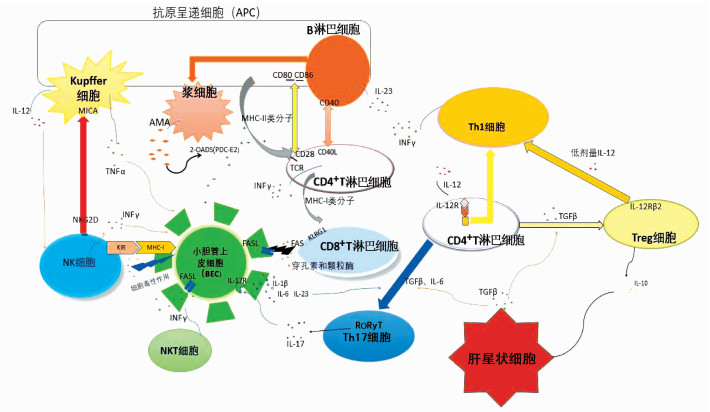
图 1 免疫系统对BEC的作用
2.3 CD8+T淋巴细胞的杀伤启动
Zhao等[18]的研究表明,在PBC早期,肝内小胆管周围存在大量PDC-E2特异性的CD4+和CD8+T淋巴细胞。CD8+T淋巴细胞通过细胞死亡受体Fas结合BEC上的FasL、释放穿孔素和颗粒酶这两种方式来造成BEC的直接损伤[13, 18]。最近,Li等[16]发现,表达杀伤细胞凝集素样受体G1(KLRG1)的CD8+T淋巴细胞可分泌大量的穿孔素和颗粒酶,KLRG1+细胞与血清碱性磷酸酶、谷丙转氨酶、天冬氨酸转氨酶呈正相关,这可能是BEC严重损伤的重要原因。
受伤的BEC释放出完整的PDC-E2后,抗原呈递细胞一方面通过MHC-Ⅱ类分子将PDC-E2呈递给CD4+T淋巴细胞,另一方面通过CD80和CD86共同刺激T淋巴细胞的CD28受体使CD4+T淋巴细胞分化为Th1、Th17细胞(图 1),进一步参与BEC损伤[13]。
PBC患者中,除了巨噬细胞等抗原呈递细胞以外,CD19+CD24hiCD38hiBreg细胞也产生大量IL-12[19];IL-12与CD4+T淋巴细胞表面IL-12受体结合,使转录激活蛋白4(signal transducer and activator of transcription 4, STAT4)的酪氨酸和丝氨酸磷酸化, 诱导STAT4移动至Th1细胞的细胞核并结合转录因子ERM从而激活Th1细胞[20-21];激活后的Th1细胞分泌IFNγ导致大量BEC损伤;IFNγ是导致小胆管损伤的关键因素,在PBC基因易感宿主中上调IFNγ的表达可使肝脏免疫耐受丧失,IFNγ还能激活巨噬细胞向“M1”型转变,使其产生大量IL-12、IL-23和TNFγ等促炎性细胞因子,正反馈促进Th1细胞反应[22]。在PBC早期,IL-12/Th1型细胞因子在小胆管周围占主导地位,且肝内Th1细胞和Th17细胞处于相对平衡状态,当疾病向晚期进展时,Th1/Th17平衡向Th17偏移[22]。
受到外界抗原持续刺激的BEC可产生大量IL-6、IL-1β和IL-23等细胞因子;CD4+T淋巴细胞在TGFβ和IL-6共同存在时促进视黄酸相关的孤儿受体γt的表达并分化为Th17细胞。Th17细胞分泌IL-17与BEC表面的IL-17受体结合促进BEC产生更多的IL-6、IL-1β和IL-23,从而使Th17细胞不断产生与成熟[23-24]。Sun等[25]发现,PBC患者外周血IL-17水平明显高于正常人,且与血清谷丙转氨酶、碱性磷酸酶、γ-谷氨酰转移酶水平呈正相关。IL-17诱导BEC产生趋化因子如CXCL2、CXCL6和CCL20来吸引Th1、Th17细胞向BEC周围聚集并损伤BEC。PBC早期患者的外周血中Th17细胞比例明显高于晚期患者,但PBC晚期患者的肝内Th17细胞比例高于早期患者[7, 24]。以上说明,晚期小胆管的损伤主要以Th17为主,且Th17及产生的IL-17促进疾病向晚期发展, 与PBC预后有关。因此,靶向IL-17的免疫治疗可能有助于改善PBC的病情及预后。
当不存在促炎性因子时,TGFβ可促进CD4+T淋巴细胞分化为CD4+CD25+Foxp3+Treg[24]。Chen等[26]发现,PBC患者的Treg数量及其产生的IL-10水平相比正常对照组明显下降。Liaskou等[27]的研究表示,与正常对照组相比,PBC患者的Treg对低水平的IL-12敏感,并表达较高水平的IL-12受体β2与IL-12结合,促使STAT4磷酸化进而促进Treg转化为Th1细胞,导致Treg减少。Treg产生减少并被诱导凋亡或转化为其他类型细胞,使其无法有效抑制效应T淋巴细胞增殖与分化,从而间接促进了小胆管的损伤。
体外扩增Treg的细胞疗法可用于治疗自身免疫性疾病。近年来,利用基因工程技术在Treg中表达嵌合抗原受体(chimeric antigen receptor, CAR)已经在各种动物疾病模型研究中有所收获。CAR-Treg可迁移到具有特定抗原的靶器官,通过分泌穿孔素和颗粒酶以及FasL途径来诱导效应T淋巴细胞凋亡,并且CAR-Treg上的CTLA-4与T淋巴细胞的CD28竞争结合抗原呈递细胞上的CD80/CD86抑制效应T淋巴细胞的活化[28]。目前CAR-Treg细胞疗法对PBC患者的疗效尚未清楚。
肝脏免疫耐受丧失是PBC发生发展的重要原因,免疫系统异常激活造成肝内小胆管上皮细胞损伤,其中涉及的免疫反应包括以巨噬细胞、NK、NKT细胞为主的固有免疫反应和以Th1细胞、Th17细胞、B淋巴细胞为主的适应性免疫反应。近40年来,熊去氧胆酸作为唯一被批准的抗胆汁淤积药一直主导着治疗,但仍有部分PBC患者对熊去氧胆酸治疗反应欠佳。PBC免疫靶向治疗的有效药物尚未出现。因此,明确PBC发生发展的免疫学机制将有助于为PBC的诊断、疾病的监测、新药的制备提供新的思路。
查看更多