查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2007年,Hiroyuki Mano博士首次在日本肺癌患者中发现间变性淋巴瘤激酶(ALK)基因与棘皮动物微管相关蛋白样-4(EML4)基因融合,为晚期NSCLC的治疗提供了新的选择和方向。
今天,我们就来说一说针对ALK阳性的靶向治疗药物。
概要
靶向治疗
克唑替尼(一代)
1. PROFILE 1007研究:二线,克唑替尼 对 化疗,无进展生存(PFS)期为7.7个月对3.0个月,客观缓解率(ORR)为65%对 20%;
2. PROFILE 1014研究:一线,克唑替尼对化疗,ORR为74%对 45%,校正总生存(OS)期为59.8个月 对19.2个月;
3. PROFILE 1029研究(中国人群):一线,研究设计、研究结果与PROFILE 1014相似。
阿来替尼(二代)
4. ALEX研究:一线,阿来替尼对克唑替尼,PFS期为25.7个月(研究者评估34.8个月) 对 10.4个月,颅内ORR为81% 对 50%。
赛瑞替尼(二代)
5. ASCEND-3研究:二线,合并脑转移组、无脑转移组ORR为57.1% 对 74.7%,OS期为36.2个月 对 55.3个月;
6. ASCEND-4研究:一线,赛瑞替尼 对 化疗,PFS期分别为16.6个月对8.1个月,颅内ORR为72.7% 对27.3%;
7. ASCEND-8研究:一线,减量(450 mg随餐)不减效[ASCEND-4研究(750 mg)副作用明显],3年OS率高达93.1%。
布加替尼(二代)
8. ALTA-1L研究:一线,布加替尼对克唑替尼,PFS期分别为24.0个月对11.0个月,颅内ORR为78% 对26%。
恩沙替尼(国产)(二代)
9. 一项II研究:二线,ORR为52%,PFS期为9.6个月,颅内ORR为70%;
10. eXalt 3 研究:一线,恩沙替尼对克唑替尼,PFS为25.8 个月对12.7个月,颅内ORR为54% 对 19%。
劳拉替尼(三代)
11. CROWN研究:一线,劳拉替尼 对 克唑替尼,12个月时PFS率为78%对39%[风险比(HR):0.28];颅内ORR为82% 对23%,完全缓解(CR)率高达71%
TPX-0131(四代)
12. 临床前研究:ALK复合突变是劳拉替尼的主要耐药机制,TPX-0131对复合耐药突变敏感,
耐药机制
13. 第二代能克服克唑替尼的大多数耐药突变,第三代对G1202R较为敏感,复合耐药突变几乎对所有耐药。
基本情况
临床病理特点
ALK基因重排在NSCLC的总体发生率约为4%,常见于年轻、不吸烟/轻度吸烟、其他致癌基因驱动突变缺乏的肺腺癌(尤其是印戒细胞癌)。
检测方法
目前ALK融合突变检测方法包括免疫组织化学(IHC)、荧光原位杂交(FISH)、RT-PCR、NGS。
亚型分析-了解

靶向治疗
克唑替尼(Cizotinib)
PROFILE 1007研究(二线):一项Ⅲ期、开放试验,在347例接受过一次铂类药物治疗的局部进展或转移性ALK-阳性肺癌患者中比较了克唑替尼和化疗的疗效。化疗组患者出现疾病进展时,可以交叉进入克唑替尼治疗组。
克唑替尼及化疗组的中位PFS期分别为7.7个月对3.0个月,ORR为65%对20%。中位OS期无明显差异。

PROFILE 1014研究(一线):一项开放性、Ⅲ期临床试验,比较克唑替尼与化疗对343例既往未接受过针对晚期肺癌的全身治疗ALK阳性的晚期非鳞状细胞的NSCLC患者的疗效。
这些患者随机分为两组,分别接受克唑替尼治疗(250 mg口服,每天2次),或者接受静脉化疗(培美曲塞500 mg/m2+顺铂75 mg/m2,或卡铂,曲线下面积目标为5~6 mg/(ml·min),每3周一个疗程,共6个疗程)。
对于化疗组的患者,在出现疾病进展后,允许他们转入到克唑替尼治疗组。本试验的主要终PFS期。




研究结果:克唑替尼组PFS期较化疗组显著延长(中位 10.9个月对7.0个月)。两组的ORR分别为74%和45%(P<0.001)。两组的中位OS期均未达到(克唑替尼组的死亡风险比为0.82)。克唑替尼组的1年生存率为84%,化疗组为79%。克唑替尼组最常见的不良事件包括视觉障碍、腹泻、恶心以及水肿。化疗组最常见的不良事件为恶心、乏力、呕吐和食欲下降。与化疗相比,克唑替尼可以显著减轻肺癌的相关症状并大幅提高生活质量。
2018年,《临床肿瘤学杂志》(JCO)公布了最终OS结果。克唑替尼组和化疗组的中位随访时间分别为45.7个月(95%CI,42.7~48.8个月)和45.5个月(95%CI,43.4~49.1个月)。两组患者的风险比HR为0.760,但无统计学意义(P=0.0978),克唑替尼组的中位OS未达到(NR),化疗组的中位OS期为47.5个月。

交叉用药OS

校正后OS
PROFILE 1029研究:一项随机、开放、双臂III期临床研究,旨在评价在东亚人群(主要是中国人群),克唑替尼一线治疗既往未经过系统性治疗的ALK阳性NSCLC患者的疗效和安全性。
PROFILE 1029试验的研究设计与PROFILE 1014相似,研究结果再次证实:与标准含铂类化疗药物相比,克唑替尼一线治疗能够显著延长ALK阳性晚期NSCLC东亚患者的PFS期。
阿来替尼(Alectinib)
ALEX研究(一线):是一项国际性、随机、开放标签的3期试验,在包括无症状CNS转移患者、既往未经治疗的晚期ALK阳性NSCLC患者中,比较了阿来替尼(600 mg,每日2次)与克唑替尼(250 mg,每日2次)。主要终点是PFS期。
研究结果:数据截止2017年2月,克唑替尼组和阿来替尼组的中位随访期分别为17.6个月和18.6个月(164起事件)。在布加替尼组和克唑替尼组中,12个月无进展生存率分别为68.4% 对 48.7%,ORR分别为82.9% 对75.5%;独立审核委员会判定的中位PFS期分别为25.7个月和10.4个月(风险比为0.47)。
在有可测量病变的患者中,经证实的颅内缓解率分别为81% 对50%。阿来替尼组3~5级不良事件的发生率较低(阿来替尼组41%对克唑替尼组50%)。
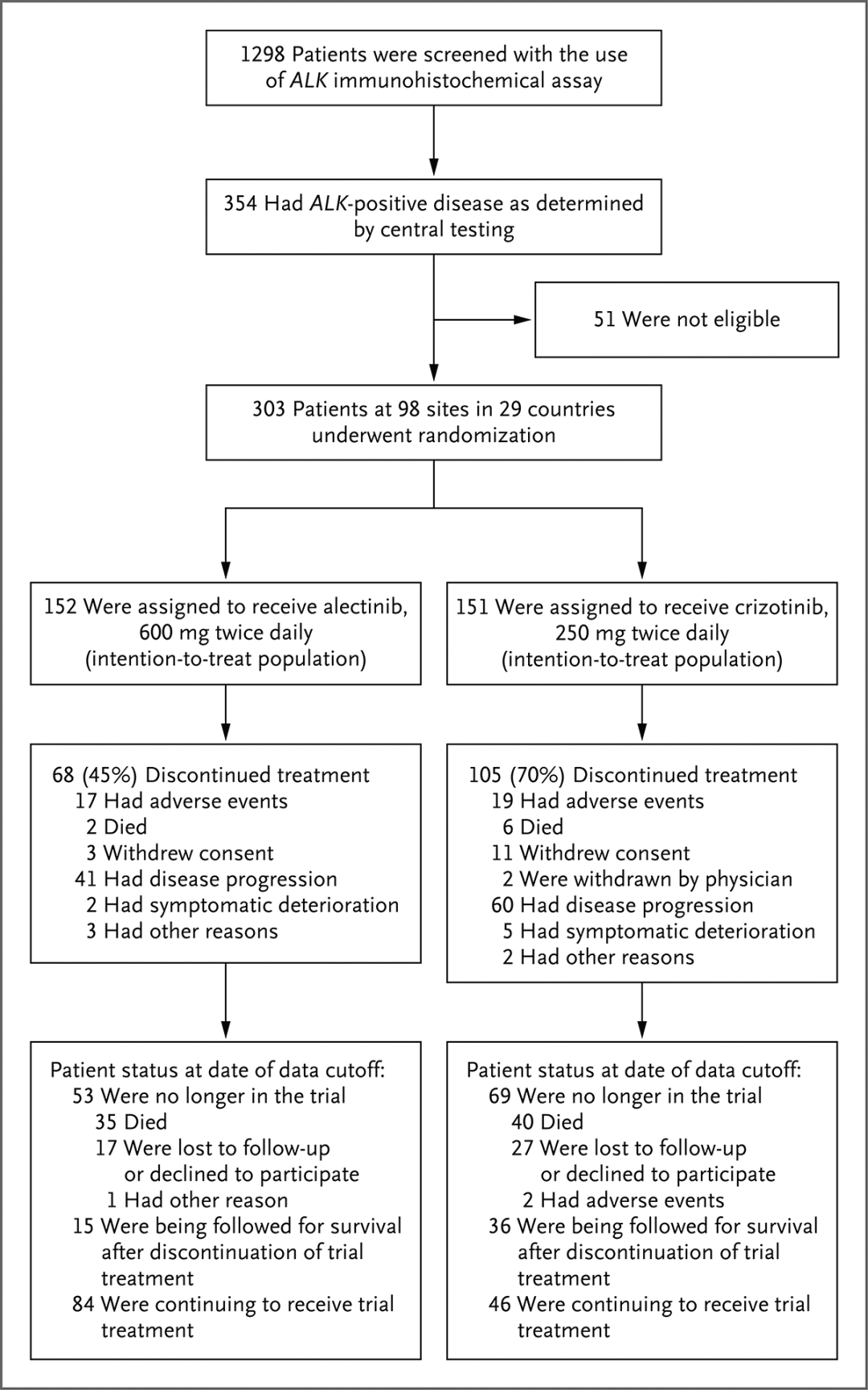




2019年ESMO会议报道,随访37.8个月,研究者评估的PFS分别为34.8个月。

色瑞替尼(Ceritinib)
ASCEND-3研究(二线):是一项Ⅱ期,单臂研究,评估了既往接受≤3种化疗方案且未接受ALK-TKI治疗的患者的疗效及安全性。根据是否合并脑转移,将124例患者分为两组,分别接受色瑞替尼治疗,合并脑转移组、无脑转移组ORR为57.1% 对 74.7%,PFS期为10.8对19.6个月,OS期为36.2对55.3个月。最常见的不良反应包括腹泻(85.5%)、恶心(78.2%)、呕吐(71.8%)、食欲降低(55.6%)及谷丙转氨酶升高(52.4%)。
ASCEND-4研究(一线):一项随机、开放标签的III期临床研究,评估一线色瑞替尼对比化疗治疗晚期ALK阳性NSCLC的疗效。研究入组的376例患者为未接受过治疗,免疫组化证实为ALK阳性的晚期非鳞NSCLC,中位年龄54岁。
按1:1比例将患者随机分配进色瑞替尼治疗组(n=189)和传统化疗组(n=187)。色瑞替尼治疗组给药:色瑞替尼750 mg/天;其中有59例存在脑转移;化疗组给药:培美曲塞500mg/m2+顺铂75mg/m2或卡铂AUC 5-6,四周期后培美曲塞维持治疗。
按照WHO PS、脑转移和继往新辅助/辅助化疗情况将患者分层。若化疗出现疾病进展可允许患者交叉进入色瑞替尼组(交叉治疗n=80)。
研究结果:色瑞替尼组的中位药物暴露时间为66.4周,而化疗组仅有26.9周。中位随访持续时间19.7个月(自随机化至截止日),研究实现了主要目的。在色瑞替尼组和化疗组中,PFS期分别为16.6 对8.1个月,ORR分别为72.5% 对26.7%;中位DOR分别为11.1个月对 23.9个月。对于基线脑转移可测量以及≥1次基线后评估的患者颅内ORR分别为72.7% 对 27.3%。另外,期中分析只完成了42.3%的需要事件,OS数据未成熟(HR=0.73, P=0.056)。最常见的不良事件(>50%)在色瑞替尼组为腹泻(85%)、恶心(69%)、呕吐(66%)以及ALT(60%)和AST升高(53%)。

ASCEND-8研究(一线,亚洲数据):


亚洲亚组OS

亚组亚组PFS
安全性方面,和750 mg空腹组相比,450 mg随餐组可显著降低胃肠道AE发生率。450mg随餐组、600mg随餐组和750mg空腹组任意级别胃肠道AE(恶心、腹泻和呕吐)的发生率分别是82.8%、78.9%和96.2%。三组中各有1例(3.4%)、1例(5.3%)和2例(7.7%)患者发生3/4级胃肠道AE。
ASCEND-8研究(一线,全球数据):2020年WCLC会议公布了意向治疗(ITT)人群中位随访37.65个月后的更新数据。至2020年3月6日研究结束时,全分析集共包括306例经治和初治的患者,其中疗效分析包括198例初治患者(450 mg随餐组,n=73;600 mg随餐组,n=51;750mg空腹组,n=74)。
三组经研究者评估的ORR和疾病控制率(DCR)均较高,其中450 mg随餐组的ORR达到75.3%,DCR为94.5%;750 mg空腹组的ORR为78.4%,DCR为93.2%。450 mg随餐组和750 mg空腹组的ORR和DCR相似,但是450 mg随餐组的缓解持续时间(DoR)更长,两组分别是未达到和25个月。

研究者评估的疗效

研究者评估的DOR
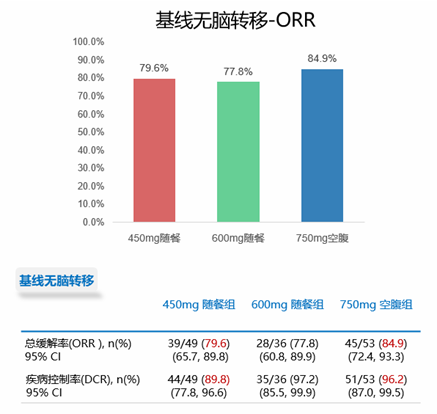

脑转移:在基线无脑转移的患者中,450 mg随餐组和750 mg空腹组的ORR和DCR相当(ORR:79.6% 对 84.9%;DCR:89.8% 对 96.2%)。而在基线就有脑转移患者在接受色瑞替尼450 mg随餐组和750 mg空腹组中基线脑转移患者的ORR分别是75.0%和52.4%,DCR分别是91.7%和76.2%。
对于基线有脑转移患者,450 mg随餐方案和750 mg空腹方案同样获得较好缓解,而且450 mg随餐组在数值上有更好的趋势。
布加替尼(Brigatinib)
ALTA-1L研究(一线):一项开放标签的多中心、随机、Ⅲ期试验,在既往未接受过ALK抑制剂治疗的ALK阳性NSCLC患者中,比较了布加替尼和克唑替尼的疗效和安全性。
将既往未接受过ALK抑制剂治疗的晚期ALK阳性NSCLC患者随机分组(275例),分别接受布加替尼每日1次、每次180 mg(包括7日的90 mg导入期)治疗,或者克唑替尼每日2次、每次250 mg治疗。主要终点为PFS期,次要终点包括ORR和颅内缓解。
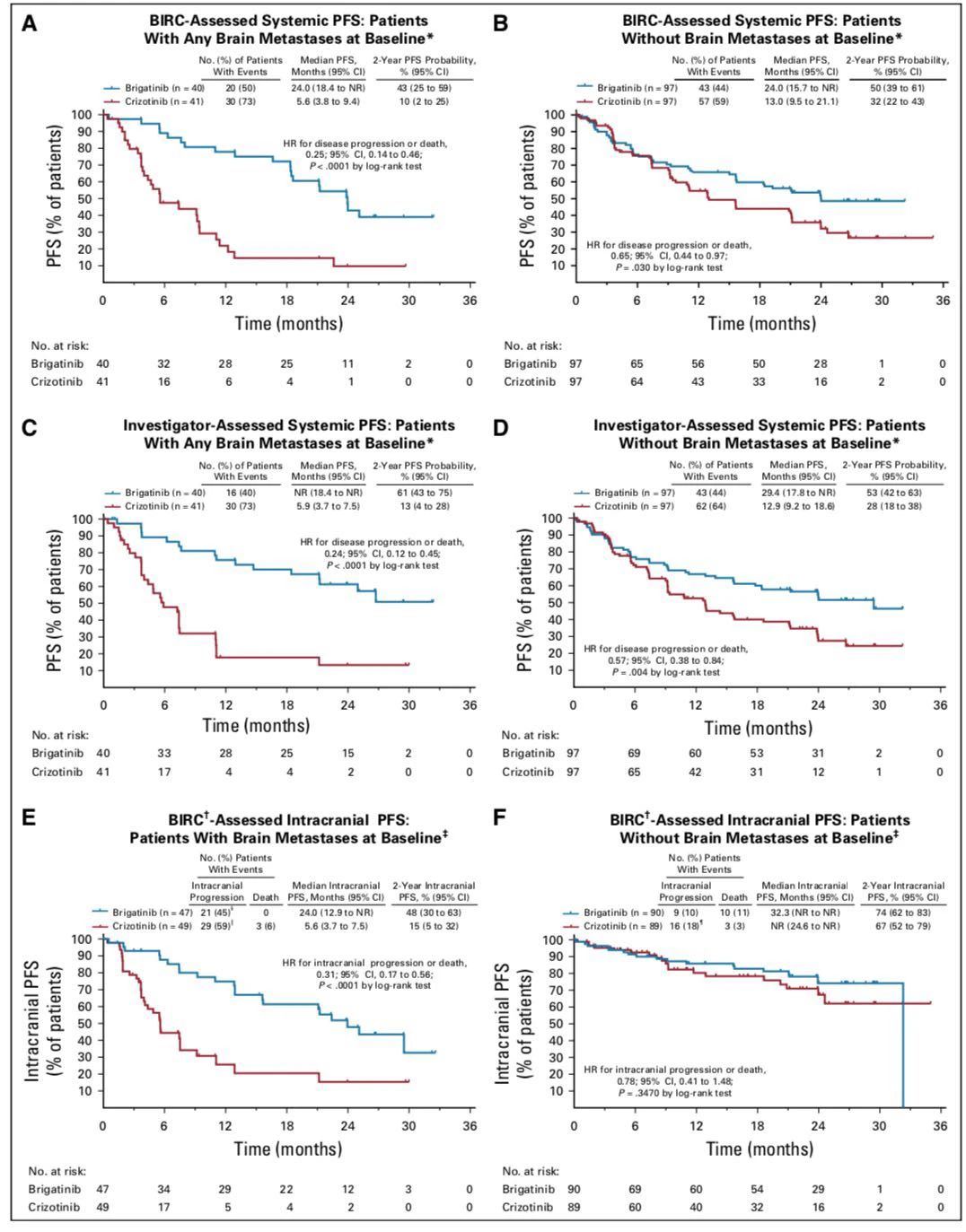
研究结果:第一次期中分析时(99起事件),布加替尼组和克唑替尼组的中位随访时间分别为11.0个月和9.3个月。在布加替尼组和克唑替尼组中,12个月无进展生存率分别为67% 对 43%,ORR分别为71% 对 60%;在有可测量病变的患者中,经证实的颅内缓解率分别为78%对29%。最常见不良事件为胃肠道症状、血肌酸激酶水平升高和血谷丙转氨酶水平升高。




2020年,JCO发表了 ALTA-1L研究的第二次中期分析数据。布加替尼组和克唑替尼组的中位随访时间分别为24.9个月和15.2个月。PFS期分别为24.0个月对 11.0个月(HR=0.49,BIRC评估),ORR分别为74%对62%;在有可测量病变的患者中,经证实的颅内缓解率分别为78%对26%。



恩沙替尼
一项Ⅱ研究(二线):2019年12月31日,Lancet Respir Med上发表了盐酸恩沙替尼中国Ⅱ期注册临床研究结果,该研究是由中山大学附属肿瘤医院张力教授牵头发起。入组了160例克唑替尼治疗耐药后的晚期或转移性ALK阳性NSCLC患者,给予恩沙替尼225 mg QD治疗方案(空腹或与食物同服),主要研究终点为独立评审委员会评估的ORR。
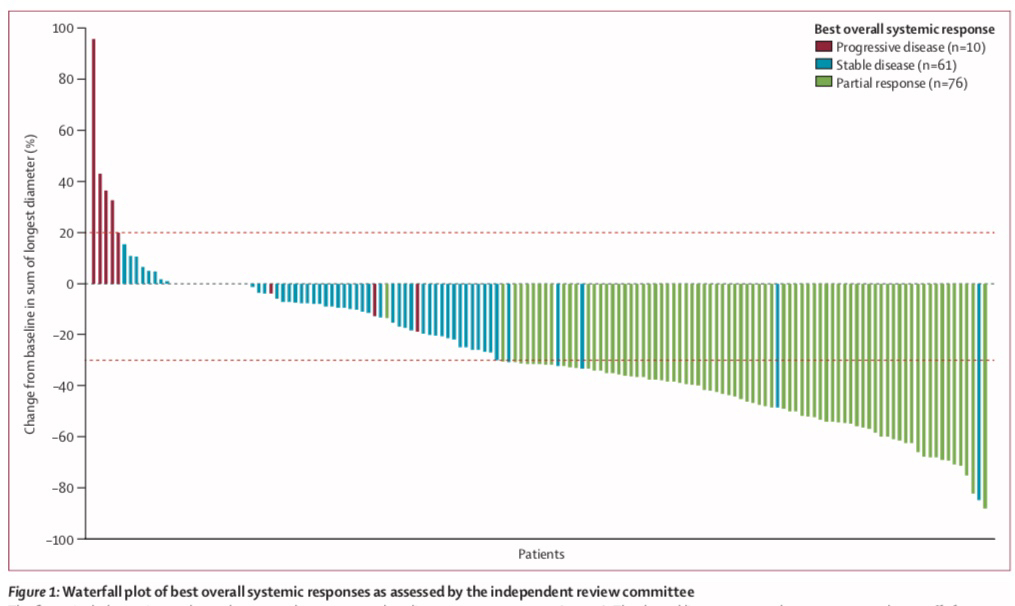
研究结果:恩沙替尼治疗克唑替尼耐药后总体人群IRC-ORR为52%,DCR为93%。研究者评估的中位PFS期为9.6个月(95%CI,7.4~11.6)。颅内疗效:40例脑转移基线可测量的患者中,颅内客观缓解率(iORR)为70%,颅内疾病控制率(iDCR)为98%(39/40;95% CI,87~100),恩沙替尼对颅内有显著的疗效。




安全性:与治疗相关的最常见的不良事件是皮疹(56%)、ALT升高(46%)、AST升高(41%)、肌酐升高(19%)、便秘(18%)、瘙痒(18%)和面部水肿(16%)。36例(23%)患者发生了与治疗相关的3级不良事件,未报告与4级治疗相关的不良事件。
eXalt 3 研究(一线):是一项全球开放多中心随机对照Ⅲ期一线临床研究,实验组为恩沙替尼225mg QD方案,直至疾病进展;对照组为克唑替尼250mg BID方案,直至疾病进展,两组之间不允许交叉。
2020年WCLC会议上发表的Ⅲ期eXalt3试验结果显示,与克唑替尼相比,恩沙替尼的中位PFS明显更长(25.8 个月对12.7个月;P =0.0003)。在改良的ITT人群中,恩沙替尼的中位PFS尚未达到,而克唑替尼则为12.7个月。在改良的ITT人群中,恩沙替尼和克唑替尼的ORR分别为75%和67%;在有脑转移的患者中,恩沙替尼的颅内ORR为54%,克唑替尼为19%。
劳拉替尼(Lorlatinib)
CROWN研究(一线):一项全球性、随机、3期试验纳入了既往未因转移性疾病接受过全身性治疗的296例晚期ALK阳性NSCLC患者,并比较了劳拉替尼和克唑替尼的疗效。
研究结果:
1. 在劳拉替尼组和克唑替尼组中,12个月时PFS率为78% 对 39%,疾病进展或死亡的HR为0.28;ORR为76% 对 58%;
2. 脑转移,在有可测量的脑转移的患者中颅内缓解率分别为82% 对23%,劳拉替尼组71%的患者达到了颅内完全缓解。
3. 劳拉替尼组最常见的不良事件包括高脂血症、水肿、体重增加、周围神经病和认知受影响。劳拉替尼组的3级或4级不良事件(主要是血脂水平改变)数量超过克唑替尼组(72%对56%)。两组分别有7%和9%的患者因不良事件停止治疗。
TPX-0131
2020年AACR会上,Turning Point Therapeuti公司的崔景荣博士公布了有关第四代ALK抑制剂TPX-0131的临床前数据。
第二代ALK抑制剂能够克服克唑替尼的大多数耐药突变(如L1196M, G1269A、F1174L),但溶剂前沿突变如G1202R将会引起一二代ALK抑制剂普遍耐药。
第三代ALK抑制剂劳拉替尼对G1202R较为敏感,但对复合耐药突变(如G1202R/L1196M)却并不敏感。
TPX-0131是一个紧凑的大环结构,便于与作用位点L1196、G1202等一系列管家基因突变的结合,发挥其作用效果,具有抑制野生型和突变型ALK耐药突变,包括溶剂前沿突变(G1202R)、守门突变和和复合突变(图1)。

图1 TPX-0131与ALK的结合模型
敏感性高、效果明显:根据报道的数据显示,TPX-0131对ALK野生型、ALK常见突变、以及各类复合突变都有相当高的敏感性,半抑制浓度(IC50)值均不高于6.6(表1)。
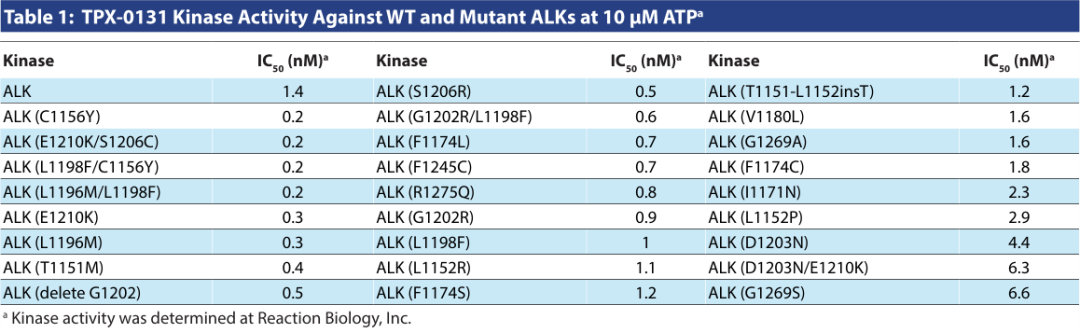
表1 TPX-0131激酶对野生型和突变体ALKs的活性
对于L1198F、G1202R、G1269A、以及野生型ALK,TPX-0131都具有比其他TKI更低的IC50值(表2),意味着四代ALK的TPX-0131在这些靶点的敏感性更高、效果更好,甚至可能会影响到一线、二线及三线药物布局。但是,值得注意的是,TPX-0131对I1171N、I1171S、I1171T、G1269S的结果并不理想,反而二、三代ALK-TKI对此更为敏感、效果更好(表2)。

表2 四代药抑制单个突变的比较
TPX-0131是一系列EML4-ALK复合突变最有效的抑制剂,而第1代、第2代和第3代ALK药物均表现为较低的活性和敏感性(表3)。
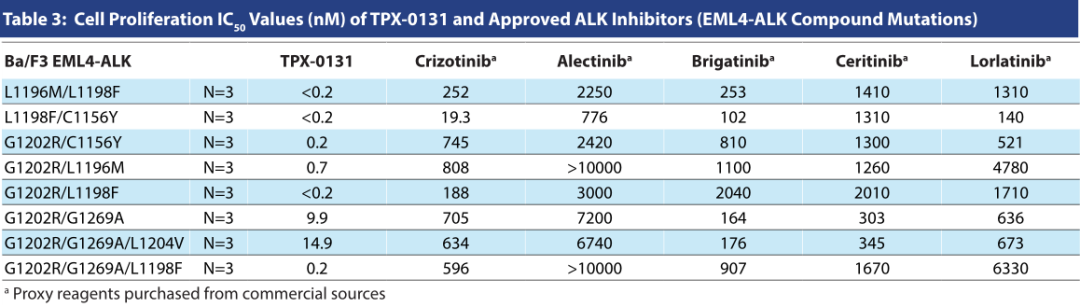
表3 四代药抑制复合突变能力的比较
ALK耐药机制
ALK依赖性耐药:ALK激酶结构域耐药突变,ALK基因拷贝数扩增。
非ALK依赖性耐药:细胞内旁路激活(如EGFR突变或磷酸化,KRAS突变和c-KIT扩增),组织学、表型等其他改变。
第一、二代ALK TKI耐药
第二代ALK抑制剂能够克服克唑替尼的大多数耐药突变(如L1196M, G1269A、F1174L),但溶剂前沿突变如G1202R将会引起一二代ALK抑制剂普遍耐药。第三代ALK抑制剂劳拉替尼对G1202R较为敏感。
一二代常见耐药突变

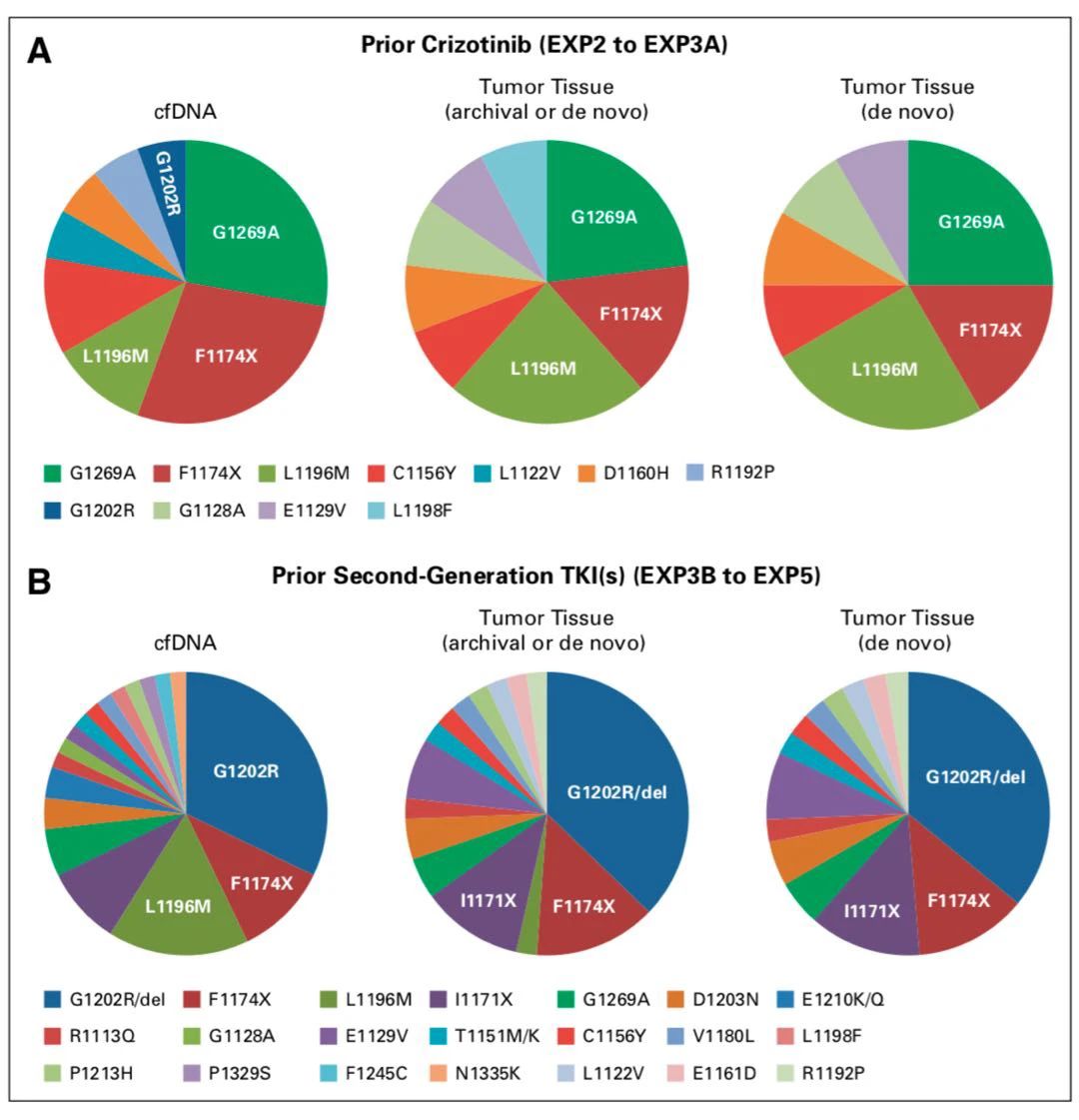
应对策略
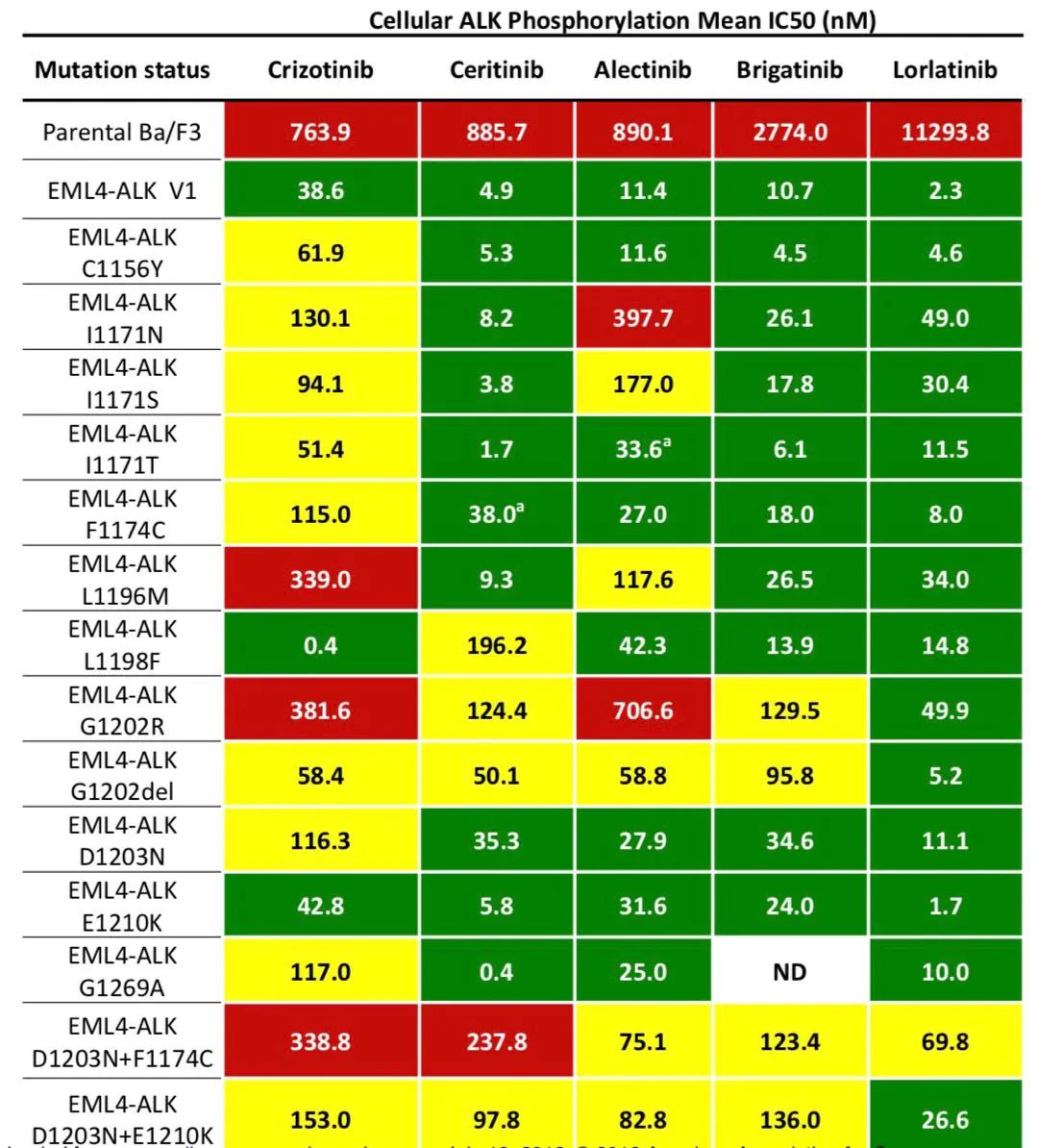
耐药敏感性
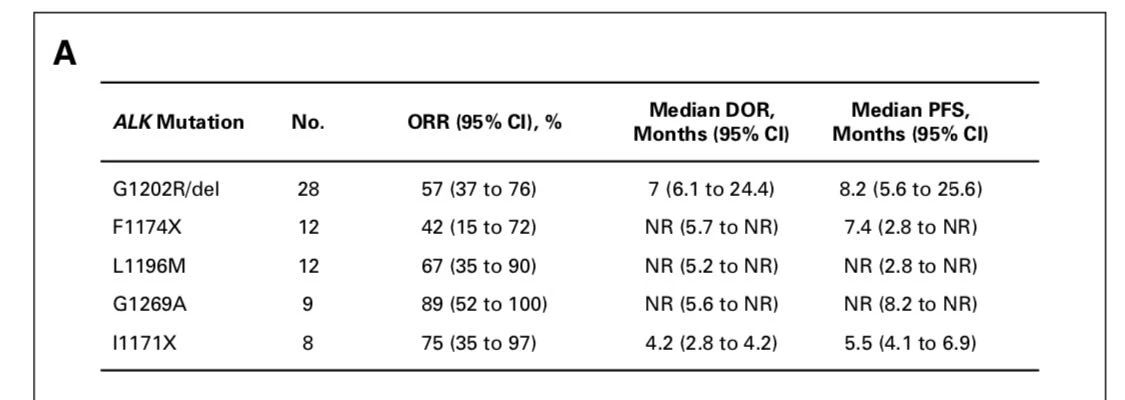
A:劳拉替尼对常见耐药突变疗效[16]
绿色:IC50 ≤ 50 nM,黄色:IC50 > 50 <200 nM,红色:IC50 ≥ 200 nM
第三代ALK TKI耐药
Satoshi Yoda等使用二代测序检测了20例劳拉替尼耐药的ALK阳性肺癌患者组织样本,其中7例患者检出ALK复合突变,提示ALK复合突变是劳拉替尼的主要耐药机制。急需要新一代ALK-TKI抑制剂应对复合突变,期待TPX-0131等药物尽早进入临床研究。
e药安全 平台发布
查看更多