查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






中国医学论坛报记者 张二娟 发自美国奥兰多
2018年美国糖尿病科学年会最高奖项-班廷奖获得者杰拉德·舒尔曼(Gerald I. Shulman)教授于6月24日在ADA大会现场进行了获奖演说。本报特邀天津医科大学代谢病医院郑少雄教授、河北唐山工人医院房辉教授第一时间全面解读班廷奖获奖演说:胰岛素抵抗的机制——肥胖、脂肪营养不良和2型糖尿病。
 郑少雄教授
郑少雄教授
每年一届的班廷奖主要授予那些在糖尿病机制探索、治疗或预防等方面做出长期、杰出贡献的学者。美国ADA医学科学会议主席珍妮-罗伊施主持了会议。罗伊施强调指出,舒尔曼的杰出贡献就是重新定义了我们以往对于导致糖尿病发生机制的理解,为糖尿病的治疗开拓了新的策略。
 左:ADA医学科学主席Jane Reusch教授;右:本届班廷奖获得者Gerald Shulman教授
左:ADA医学科学主席Jane Reusch教授;右:本届班廷奖获得者Gerald Shulman教授
舒尔曼博士是耶鲁大学医学院乔治-考吉尔医学和细胞分子生理学教授,耶鲁糖尿病研究中心共同主任,霍华德休斯医学研究所研究员,在国际上因胰岛素抵抗机制方面的研究成果而享有盛誉。他的研究成果为2型糖尿病的发生和进展的机制研究和新的治疗靶点的确立奠定了深厚的基础。ADA大会主席珍妮•罗忆诗强调指出,舒尔曼的最大贡献就是开拓并实施一种新的技术工具——核磁共振光谱(NMR-spectroscopy)技术,使人们能够直接研究人类的细胞内葡萄糖和脂质代谢,首次为细胞内的新陈代谢提供了一个动态的视角。舒尔曼讲演的题目是:胰岛素抵抗的机制:肥胖,脂肪代谢紊乱和2型糖尿病。
舒尔曼教授讲演伊始就回顾了2型糖尿病高血糖的病因和发病机制,最主要的病因是胰岛素抵抗和胰岛B细胞功能的衰减。正常人进食,刺激胰岛素分泌增加,促进肌肉葡萄糖摄取增加。胰岛素抵抗状态下,肝糖产生增加,肌肉葡萄糖摄取减少(图1)。
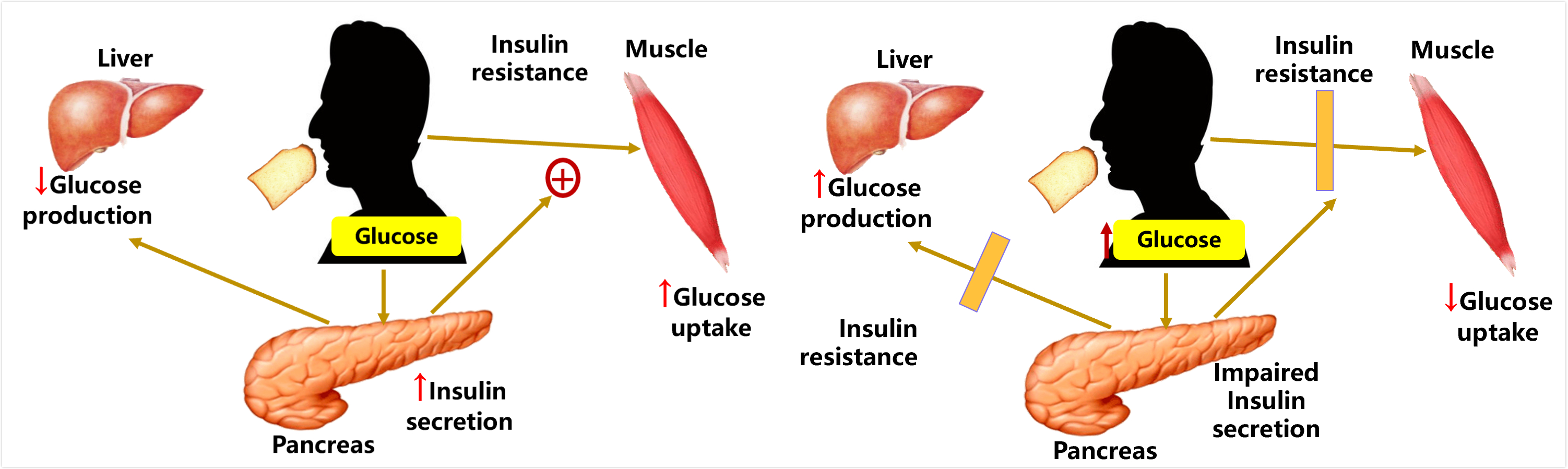
图1 正常人进食和胰岛素抵抗状态下进食肝脏和肌肉的肝脏葡萄糖产生和肌肉葡萄糖摄取的变化——2型糖尿病的发病机制(肝糖产生增加和肌肉葡萄糖摄取减少)
围绕胰岛素抵抗,特别是肝脏和肌肉的胰岛素抵抗,舒尔曼展示的他的历时35年的研究成果。
一、肌肉的胰岛素抵抗
糖尿病早期,尽管有胰岛素分泌的增加,但是由于胰岛素抵抗的发生,肝糖产生增加,而肌肉葡萄糖摄取却下降。葡萄糖在肌肉主要有三条出路,葡萄糖氧化,葡萄糖酵解或合成肌糖原。舒尔曼等使用13C磁共振光谱技术和高血糖高胰岛素钳夹试验发现,高血糖高胰岛素钳夹试验证实,肌肉糖原合成的增加而增加(图2左),2型糖尿病患者肌肉糖原合成显著低于正常人(图2右)。
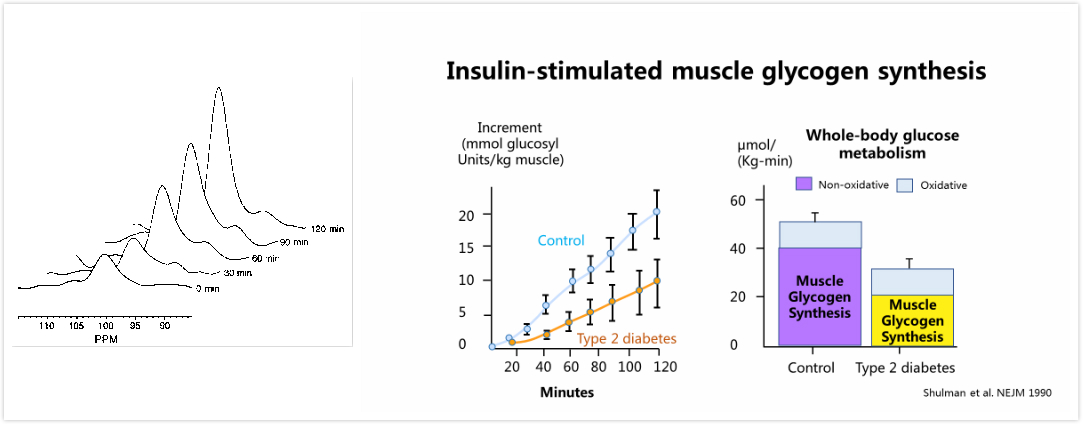 图2 高血糖高胰岛素钳夹试验正常人肌肉糖原(左图)以及正常人和糖尿病患者(右图)肌肉糖原水平的变化的比较
图2 高血糖高胰岛素钳夹试验正常人肌肉糖原(左图)以及正常人和糖尿病患者(右图)肌肉糖原水平的变化的比较
舒尔曼等进一步的研究证实,肌肉葡萄糖合成肌糖原受糖原合成酶和葡萄糖转运子4的限速控制,后者减少了葡萄糖转运进入肌肉细胞,使得肌肉葡萄糖摄取减少,糖原合成减少(图3)。
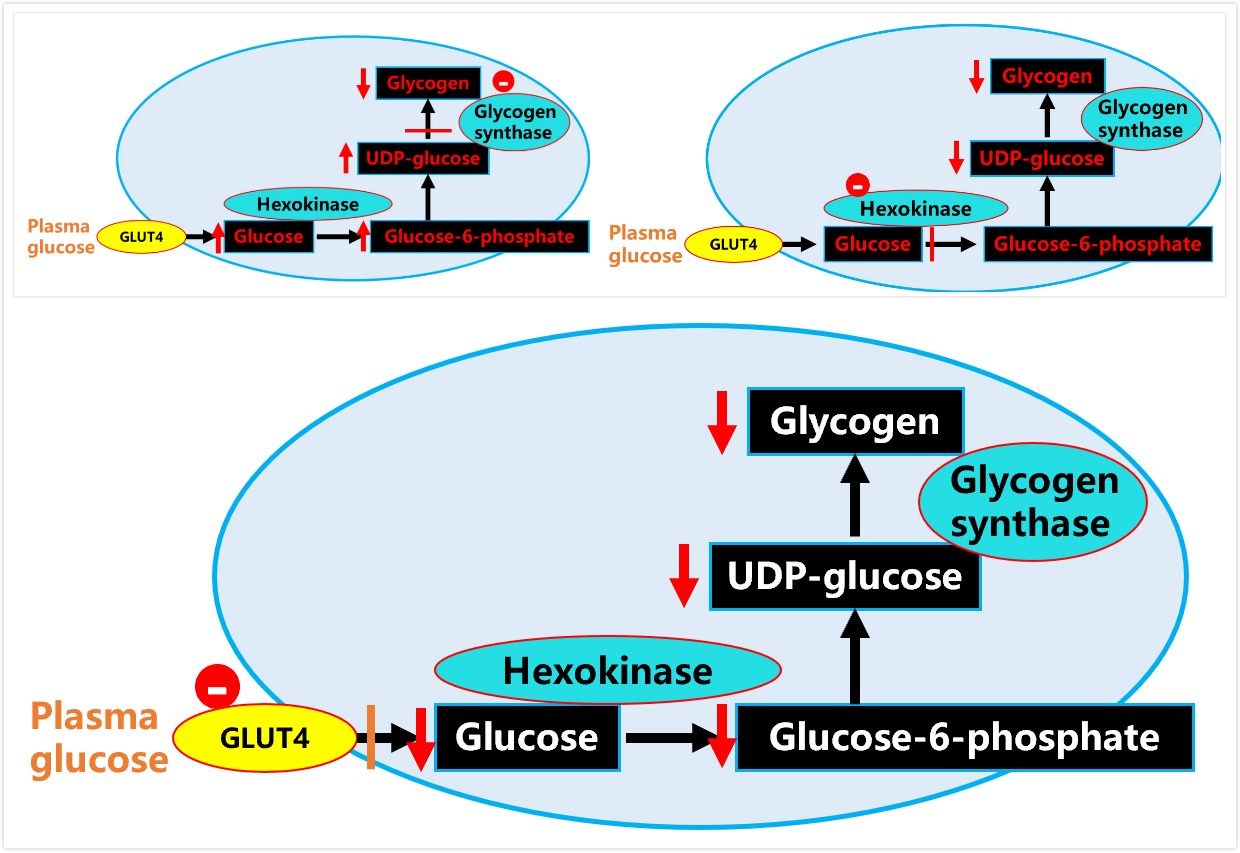 图3 肌肉葡萄糖-糖原合成的控速步骤-糖原合成酶(上图左)己糖激酶(上图右)和葡萄糖转运蛋白4(下)
图3 肌肉葡萄糖-糖原合成的控速步骤-糖原合成酶(上图左)己糖激酶(上图右)和葡萄糖转运蛋白4(下)
舒尔曼进一步证实,肌肉胰岛素抵抗与肌肉的脂如脂肪酸及其代谢产物有密切关系。脂肪酸抑制人骨骼肌胰岛素刺激的PI3激酶(PI3K)活性,进而抑制GLUT4活性,使葡萄糖进入肌细胞减少,肌糖原合成减少(图4)。
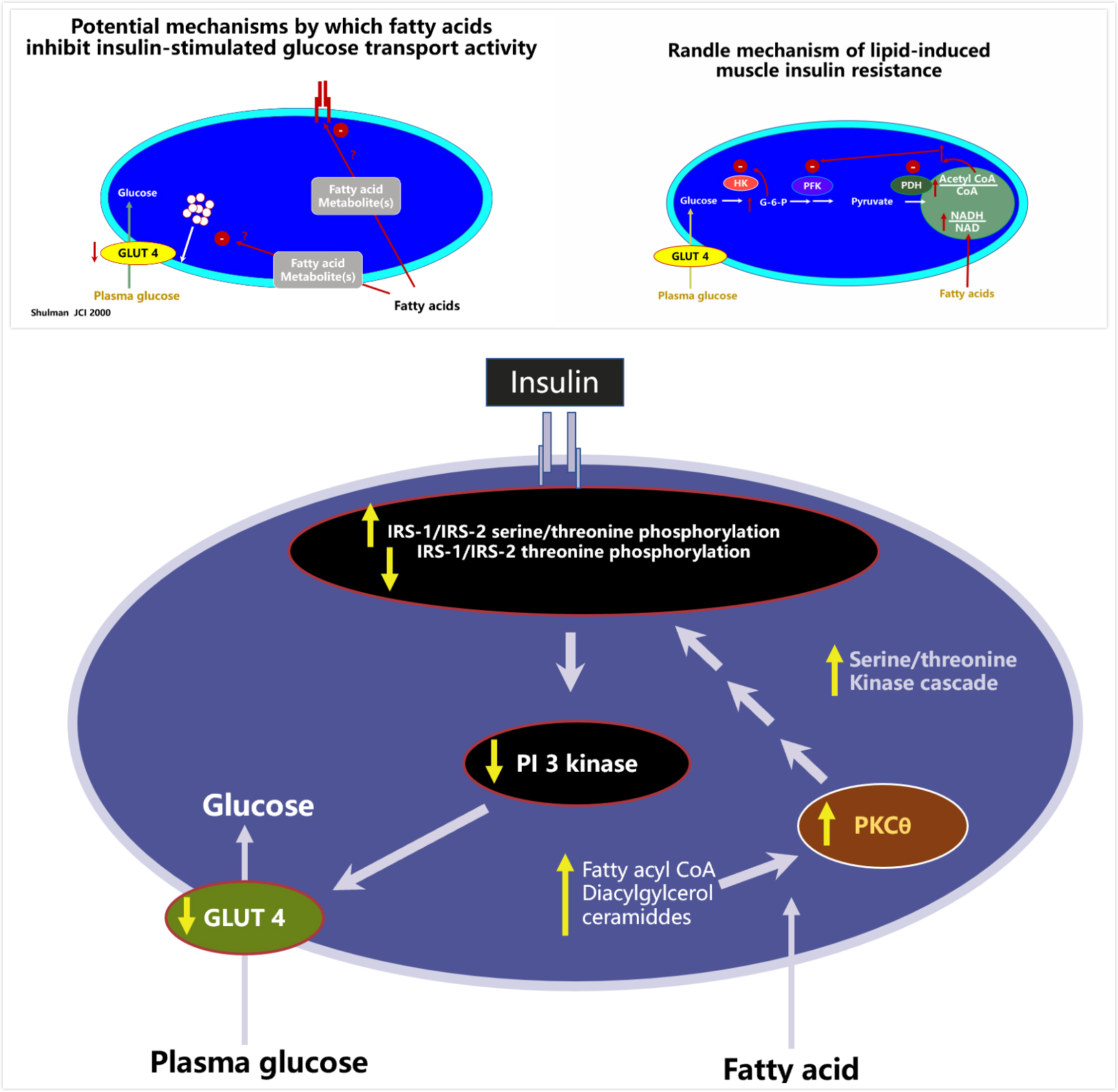 图4 脂类诱导的肌肉胰岛素抵抗的可能机制和反机制(Randle Mechanism)
图4 脂类诱导的肌肉胰岛素抵抗的可能机制和反机制(Randle Mechanism)
研究结果表明,胰岛素刺激的肌糖原合成在2型糖尿病患者中严重受损。胰岛素刺激的肌糖原合成缺陷是导致2型糖尿病肌肉胰岛素抵抗的主要因素。葡萄糖转运子GLUT4不能将葡萄糖转运进入肌肉细胞,肌肉葡萄糖摄取减少。
在2型糖尿病中,当胰岛素不能促进肌肉对葡萄糖的摄取和抑制肝脏中葡萄糖的产生时,葡萄糖-胰岛素相互作用变得不正常。这导致β细胞功能的降低以及随后的空腹和餐后高血糖。
二、肝脏的胰岛素抵抗
舒尔曼研究胰岛素如何调节肝脏葡萄糖代谢的作用模式,始于胰岛素通过激活胰岛素信号通路的直接作用,主要通过刺激糖原合成来调节肝脏葡萄糖代谢。周围脂肪组织和肝脏中的脂肪分解抑制导致肝脏乙酰辅酶A(Acetyl CoA)含量降低,导致肝脏丙酮酸羧化酶活性和葡萄糖生成减少。导致肝脏胰岛素抵抗和糖异生率增加的关键化学物质是肝脏二酰基甘油含量和乙酰辅酶a含量增加。
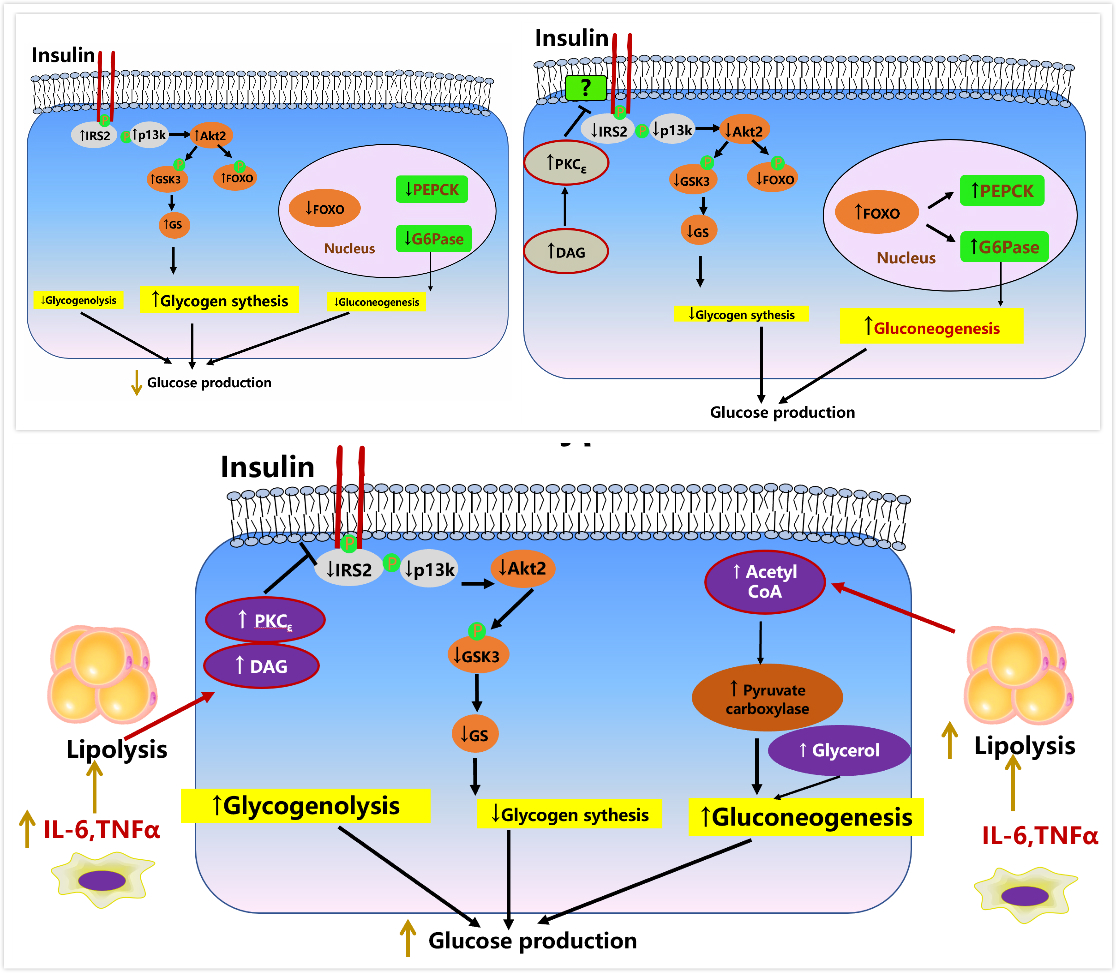 图6 肝脏的胰岛素调节的正常葡萄糖代谢(左上图)和慢性炎症导致的脂解-DAG-PKC导致的肝脏胰岛素抵抗—肝糖原合成减少,肝糖原分解增加和葡萄糖异生增加,最终导致血糖升高(下图)
图6 肝脏的胰岛素调节的正常葡萄糖代谢(左上图)和慢性炎症导致的脂解-DAG-PKC导致的肝脏胰岛素抵抗—肝糖原合成减少,肝糖原分解增加和葡萄糖异生增加,最终导致血糖升高(下图)
异位脂质代谢物的积累、未折叠的蛋白反应(UPR)通路和先天免疫通路的激活都与胰岛素抵抗的发病机制有关。然而这些途径也与脂肪酸吸收、脂肪生成和能量消耗的变化密切相关,这些变化会影响异位脂质沉积。在肝脏和骨骼肌中积累的脂质代谢物特别是二酰甘油酯和/或神经酰胺,可能是导致胰岛素信号转导受损和胰岛素抵抗的主要原因。
一种方法通过肝靶向线粒体解偶联促进肝线粒体脂肪氧化速率增加。舒尔曼博士说,通过减少肝脏脂肪,肝靶向线粒体解偶联还可以逆转三种非酒精性脂肪性肝炎( NASH )啮齿动物模型的肝脏炎症,以及肝硬化大鼠模型的肝纤维化。
肝脏的二酰基甘油含量是胰岛素抵抗的重要预测指标,如果能找到减少这些代谢物的方法,应该就能够逆转糖尿病。
三、异位脂肪沉积-脂肪代谢障碍对于肝脏-肌肉胰岛素抵抗的作用
肝脏和肌肉的胰岛素与这些脏器内的异位脂肪沉积和脂肪代谢紊乱有极其密切的关系。肌肉胰岛素抵抗与及细胞内脂的含量(IMCL)密切相关;肝脏胰岛素抵抗和非酒精脂肪肝(NAFLD)肝内脂的生成有密切关系(图7)。
肝糖原分解是肝葡萄糖产生的主要原因时,胰岛素对肝糖原代谢的直接影响将占主导地位。相反,如果在长期禁食或高脂喂养后研究胰岛素作用,糖异生是葡萄糖产生的主要原因,胰岛素作用对肝脏葡萄糖代谢的间接影响将占主导地位。
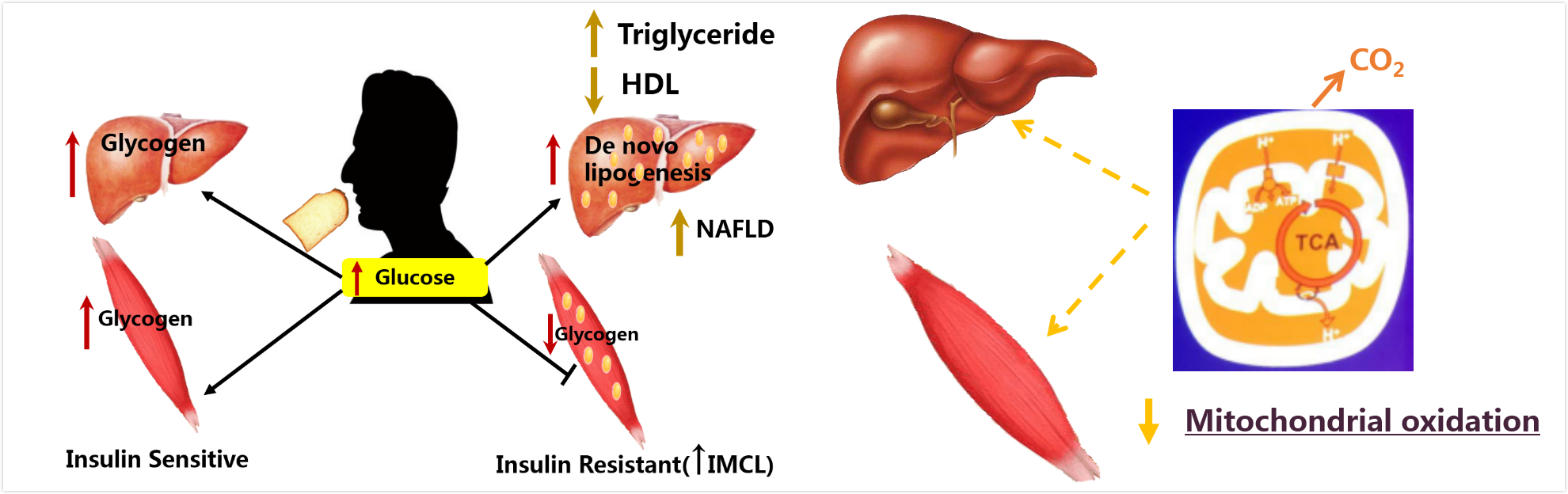
图8 脂类异位沉积对肝脏(脂肪肝)和肌肉线粒体氧化的影响
在饥饿状态下,没有碳水化合物,机体动员储存的脂肪分解,脂类物质在肝脏积聚,进而激活二酰基甘油(DAG)和蛋白激酶C(PKC)调节的胰岛素抵抗。
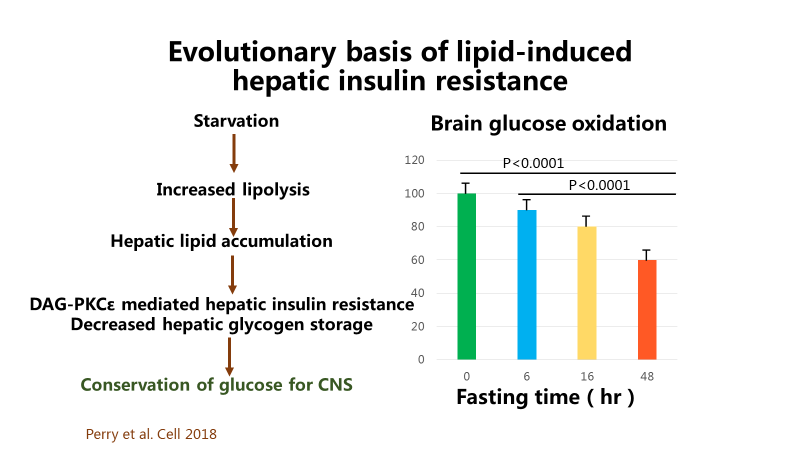 图9 脂类诱导的肝脏胰岛素抵抗的演化基础
图9 脂类诱导的肝脏胰岛素抵抗的演化基础
胰岛素抵抗并不只是发生在肥胖者的动物和人。舒尔曼等用动物实验证实,无脂肪小鼠伴有显著的肝脏胰岛素抵抗和乙酰辅酶A增加。给予脂肪移植,可以纠正肝脏和肌肉的胰岛素抵抗状态,使其肌肉正常,肝脏乙酰辅酶A下降至正常。
严重脂肪营养不良,也伴有显著的胰岛素抵抗,高甘油三酯血症,肝脏和其他组织脂肪浸润。此类患者伴有脂肪激素如瘦素的缺乏,给与瘦素治疗,可有显著的恢复,异位脂肪沉积显著减少,皮下脂肪增加(图10)。
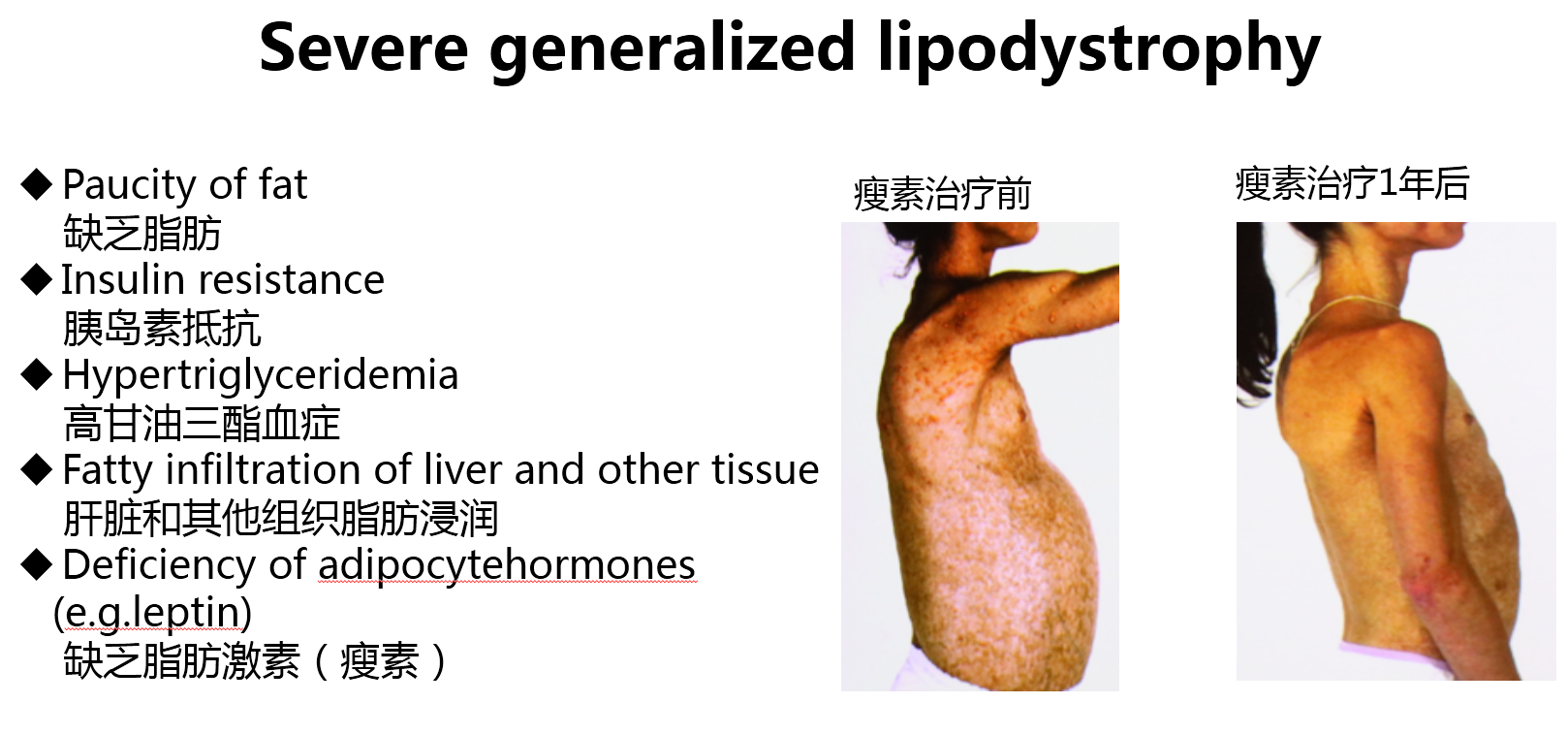 图10 严重的全身脂肪营养不良的临床表现和瘦素治疗前后的对比
图10 严重的全身脂肪营养不良的临床表现和瘦素治疗前后的对比
2型糖尿病多伴有肌肉糖原下降,而运动或者锻炼可以改变肌肉糖原缺乏的状况,可以逆转不正常的碳水化合物的储存方式。这为型糖尿病的治疗,早期型糖尿病的逆转提供了重要的实验基础。
四、改变生活方式对于胰岛素抵抗的影响
舒尔曼等使用1H磁共振光谱联合高胰岛素正常血糖钳夹试验对8例肥胖的2型糖尿病患者减重前后进行了研究,采用低热卡-极低脂肪膳食减重。减重前,肥胖的2型糖尿病患者肝脏脂(IHL)含量(12.2+-3.4)明显高于瘦型对照组(0.6+-0.1),肌肉脂(ICML)(2.0+-0.3)显著高于瘦型对照组(1.2+-0.2)。低脂饮食体重减少8kg左右,空腹血糖正常,基础葡萄糖产生率下降,肝脏脂IHL显著下降达82%;但是胰岛素刺激的肌肉葡萄糖摄取没有明显变化,肌肉脂IMCL也没有明显的变化(2.1+-0.3对1.9+-0.3),提示体重减少对肝脏脂、胰岛素抵抗和肝糖产生的影响并不依赖肌肉胰岛素抵抗的影响。
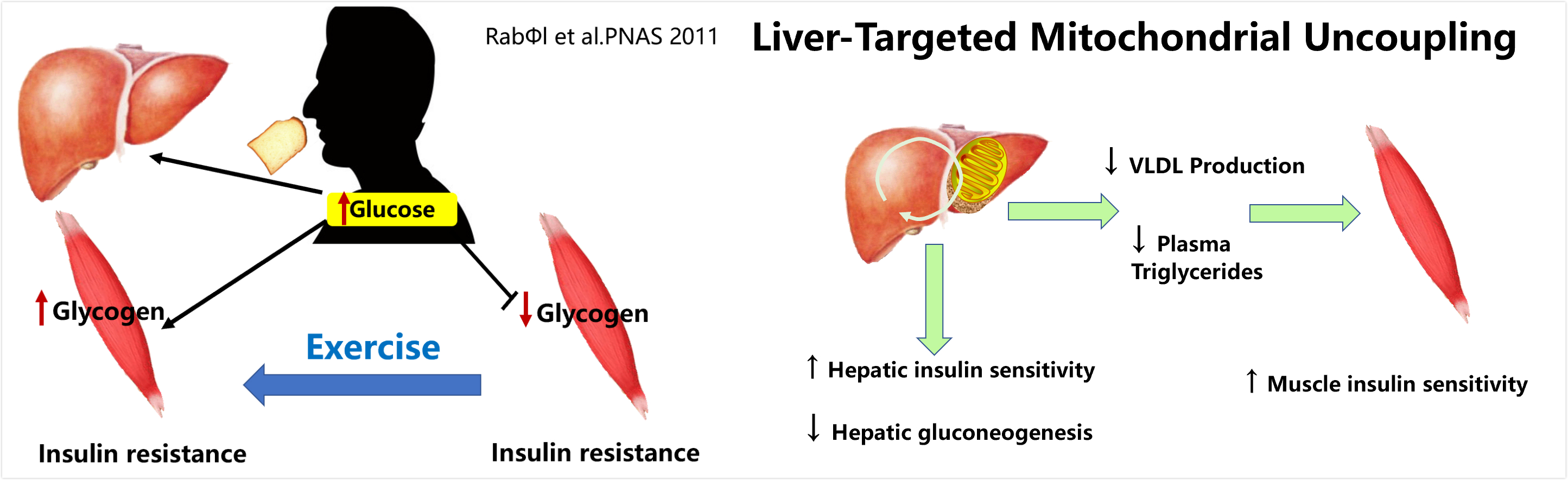 图11 一次锻炼就可以逆转胰岛素抵抗个体碳水化合物储存的异常类型(图11左),以肝脏线粒体解偶联为靶的治疗策略(图11右)
图11 一次锻炼就可以逆转胰岛素抵抗个体碳水化合物储存的异常类型(图11左),以肝脏线粒体解偶联为靶的治疗策略(图11右)
与运动一样,生活方式对于脂类诱导的肝脏胰岛素抵抗也有极其重要的作用,一次性运动就可以改变碳水化合物的储存方式,使肌肉糖原合成增加(图11)。
饥饿状态可以增加脂肪分解,肝脏脂类集聚,致使DAG-PKC调节的肝脏胰岛素抵抗,减少肝糖原储存,葡萄糖释放入血,维持中枢神经系统的血糖水平。
在药物治疗药物进行治疗的过程中,改善脂肪性肝炎(NASH)的努力取得了有限的成功。舒尔曼等研究了一种控制释放的线粒体质子载体(CRMP),它能产生轻度的肝靶向线粒体解偶联,可以降低高甘油三酯血症,并在小鼠模型(无脂肪的azip/f-1小鼠)中逆转NASH和糖尿病,在口服CRMP4wk(每天2毫克/公斤体重)或载体治疗后,小鼠经高胰岛素-高血糖的夹钳,评估肝脏和肌肉胰岛素的反应能力和组织脂质测量。CRMP治疗逆转了肝脏和骨骼肌中的高甘油三酯血症和胰岛素抵抗。胰岛素抵抗的逆转可以归结为减少二酰基甘油含量,并减少肝脏和肌肉中的PKC和PKC活化。CRMP治疗也逆转NASH。这些结果为肝靶向线粒体非偶联剂的发展提供了一个概念的证明,是一种潜在的新疗法,用于治疗脂血症相关的高甘油三酯血症、NASH和糖尿病(图11右)。
总之,舒尔曼的研究更新了我们对胰岛素抵抗的认识,特别是脂代谢在胰岛素抵抗中的作用,为糖尿病发病机制特别是胰岛素抵抗以及糖尿病的治疗找出了新的靶点,提供了新的治疗和预防途径。
点击下方【ADA2018】标签,查看专题更多精彩文章!
查看更多