查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






作者:黄浙勇 复旦大学附属中山医院心内科
本期话题——IABP治疗β受体阻断的难治性过敏性休克1例

黄浙勇 副主任医师
含碘造影剂发生过敏性休克几率低下,而且大多数患者经一线治疗(肾上腺素)配合二线治疗(补液、升压药物、激素和抗组胺药)后可迅速好转[1]。但由于本身存在的心血管疾病和广泛应用血管紧张素转化酶抑制剂(ACEI)和β受体阻滞剂等,心脏介入治疗时患者发生过敏性休克的情况变得非常复杂:
(1)过敏反应更加常见、更加严重;
(2)一旦发生过敏性休克后,患者对肾上腺素反应低下;
(3)基础心脏病使肾上腺素的心脏不良反应后果更为严重。
以上诸多因素综合作用,使过敏性休克的治疗陷入困境[2]。有不少关于胰高血糖素治疗获得成功的报道,但极少有主动脉球囊反博 (IABP)的报道。
最近,笔者对1例口服倍他乐克和替米沙坦的三支冠脉病变患者进行冠脉造影,含碘造影剂引发过敏性休克,但超大剂量的肾上腺素非但未能纠正低血压休克,反而引发室颤和冠脉痉挛等严重不良事件。最后,采用IABP装置成功地稳定了血流动力学状态,患者病情得到控制。
【病例简介】
71岁女性患者,因“反复心前区疼痛10余年,加重1年”于2015年6月17日入院。
自十多年前开始,患者反复出现心前区隐痛不适,多在劳累后发生,休息或含服保心丸后即可缓解。发作时无心慌、心悸,无黑矇、晕厥,无颈肩部放射痛,无呼吸困难,无汗出等,未予重视。
近一年,发作的频率、程度、持续时间较前均有所加重,劳累、受凉、紧张等均可诱发,严重时伴出汗、双手麻木及颈部僵硬感,服用保心丸需一小时左右方可缓解。
门诊心电图检查提示:窦性心律,陈旧性下后壁心肌梗死,ST段改变(Ⅰ、aVL、V3、 V4导联呈水平型压低0.5 mV)。
肌钙蛋白、肌酸激酶(CK)及同工酶(CK-MB、CK-MM)均正常,收住入院拟行冠脉造影。病程中二便正常,饮食欠佳,睡眠尚可。平时服用阿司匹林0.1 qd、倍他乐克缓释片47.5 mg qd 和保心丸等药物。
发现高血压2年,最高血压180/105 mmHg,口服替米沙坦 80 mg qd,血压控制在120~140/70~80 mmHg左右。
患有糖尿病2年,口服格列齐特90 mg/d,近期由于进食量少,频发低血糖,暂停用2周。
有青霉素药物过敏史,否认食物过敏史。否认抽烟、喝酒等不良嗜好,否认疫区驻留史和家族遗传病患者。
入院体检 T:36.7℃ P:64次/分 R:20次/分 BP:126/70 mmHg,神志清晰,精神尚可,甲状腺未及肿大,胸廓无畸形,双肺叩诊清音,听诊呼吸音清。心前区无隆起,心界不大,心率64次/分,律齐。腹部平软,肝脾肋下未及,下肢无水肿。
入院诊断:
① 冠状动脉粥样硬化性心脏病(不稳定性心绞痛,陈旧性下壁心肌梗死),高血压病(3级,极高危组);
② 2型糖尿病。
入院次日经桡动脉行冠状动脉造影,左主干管壁不规则,左前降支全程弥漫性病变,近段狭窄50%,中段狭窄90%,远段狭窄60%;第一对角支狭窄70%。回旋支弥漫性病变,近中段狭窄60%,粗大第一钝缘支近段狭窄50%。右冠近段狭窄80%,远段狭窄95%伴疑似血栓征象(图1)。
造影使用碘必乐(碘帕醇,Iopamidol)50 ml,肝素2500 U,硝酸甘油400 ug;术中血压120/70 mmHg,心率80 bpm。

△图1 冠状动脉造影结果
与家属沟通病情时(第一剂造影剂注入后5 min左右),患者诉上腹部瘙痒,查体发现腹部皮肤充血伴少量皮疹,患者无气促憋气、无胸闷胸痛、无腹痛腹泻,血压心率无明显变化。
考虑为造影剂过敏反应。立即终止手术,肌注1:1000肾上腺素0.5 mg,并静推地塞米松10 mg 2次,然后氢化可的松200 mg/500 ml生理盐水快速静滴、肌注非那根12.5 mg。患者症状暂时缓解,皮疹减少。
但5 min后症状再度加重,患者全身皮肤大面积充血伴皮疹(图2)、球结膜充血,并出现烦躁不安,血压从115/70 mmHg迅速下降至60/40 mmHg,心率从80 bpm上升到120 bpm。考虑造影剂相关过敏性休克。
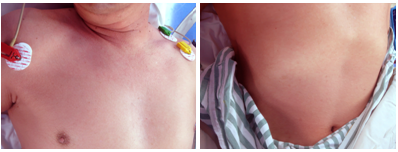
△图2 皮肤充血和皮疹
随即予吸氧(10 L/min),穿刺右侧颈内静脉,同时采取以下方式试图提升血压,纠正休克状态:
(1)经桡动脉鞘推注生理盐水 250 ml,然后生理盐水1000 ml加压静滴;
(2)先后经桡动脉鞘管及静脉通路推注多巴胺3次(每次10 mg,间隔3~5 min),然后多巴胺200 mg/500 ml生理盐水静滴维持;
(3)1:10000肾上腺素以递增方式静推(1 mg 4次,2 mg 4次,3 mg 4次,4 mg 3次,每次静推间隔1~5 min,总量达36 mg)。
但患者血压徘徊在40~70/10~25 mmHg之间,心率波动在100~160 bpm之间,血流动力学极不稳定。在静推肾上腺素和多巴胺后频发室早,并发生持续性室速、尖端扭转型室速和室颤,共8次(图3),其中2次首先出现心电监护导联ST段抬高,然后出现恶性室性心律失常。
每次室颤、室速均经200 J(双向)直流电除颤成功,并利多卡因静注100 mg,然后800 mg/500 ml生理盐水静滴维持。
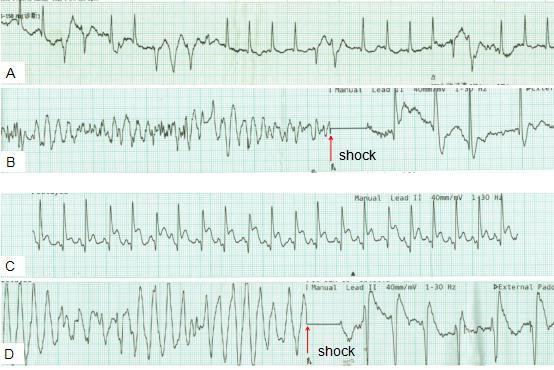
△图3 注射2 mg肾上腺素后出现频发室早(A),随后发生室颤(B);注射4 mg肾上腺素后出现心率加快合并ST段抬高(C),随后发生尖端扭转型室速,除颤成功后ST段抬高持续30秒左右后回落(D)
遗憾的是,尽管大量补液和应用大剂量升压药,但患者低血压休克并未得到纠正,病情进一步恶化,意识模糊进而陷入昏迷状态,自主呼吸不稳定,心电监护出现三度房室传导阻滞。
迅速穿刺右侧股动脉及股静脉分别置入IABP及临时起搏(100次/分),同时行气管插管和呼吸机辅助通气。
患者在IABP支持下血压回升,并稳定在90~100/50~60 mmHg左右,窦性心率110次/分左右。
紧急床旁心超未见心包积液,但显示心肌收缩严重受抑制。
以“造影剂过敏性休克、缺血缺氧性脑损害、冠心病”转入心内科监护室(CCU)进一步脑复苏治疗。转入CCU 1小时内患者频发短阵室性心动过速,考虑为交感风暴,静脉使用艾司洛尔加胺碘酮,从而控制交感风暴。
5天后停用IABP,拔除临时起搏器,1周后撤除呼吸机,2周后出院。
【讨论】
该患者发生过敏性休克后对肾上腺素反应不佳,加大药物剂量后未能改善低血压休克状态,反而出现恶性室性心律失常和一过性ST段抬高,病情进一步恶化。最终IABP植入后稳定了血流动力学状态,为后续治疗和转归赢得了生机。
为何发生顽固性过敏性休克?
肾上腺素是过敏性休克的一线用药,但部分患者无反应。本例患者静脉注射的肾上腺素剂量高达30 mg,远远超过之前治疗难治性过敏性休克的剂量[3-9],可谓超大剂量。同时进行大量扩容和多巴胺升压治疗,但仍然未能控制休克,可见本例患者属于真正的难治性休克。究其原因可能与严重冠脉三支病变、药物应用史(倍他乐克和ACEI)有关。
(1)缺血性心脏病特别是急性冠脉综合征患者心脏(尤其是动脉粥样硬化斑块)中肥大细胞数量增加,一方面增强全身过敏反应强度,另一方面局部释放组胺、白三烯、血小板活化因子(PAF)等介质可诱发冠脉痉挛和急性心肌梗死(Kounis综合症)[10]。
(2)应用β受体阻滞剂(可能包括ACEI)患者不仅过敏反应的发生风险增加,而且病情更加严重[8, 11-15]。β-受体阻滞剂通过调节腺苷酸环化酶活性增加介质的释放,最新研究[16]证实雷米普利和倍他乐克加重过敏反应机制为降低肥大细胞脱颗粒的阈值;减少心血管系统对休克后分泌增加的内源性肾上腺素的代偿反应,从而加重过敏反应;同样抑制外源性肾上腺素的作用,导致肾上腺素抢救无效[17];甚至可促进反射性迷走神经兴奋恶化血流动力学状态[3]。
究竟该如何处理?
1、过大剂量肾上腺素和多巴胺容易引起急性心血管事件:
肾上腺素抢救过敏反应和心肺复苏时并无绝对禁忌证[2],但在心血管疾病患者中应用时应充分认识到潜在的不良反应,二者存在相互作用的使用困局[2]。笔者从本病例得到的教训是,过大剂量肾上腺素可能诱发难以控制的交感电风暴、冠脉痉挛等严重不良事件[18],应该加以避免。
其中有2次室颤继发于ST段一过性抬高之后,笔者推测可能为过敏本身或药物诱发的冠脉痉挛所致。该患者本身就存在冠脉严重三支病变和心肌缺血,过敏反应严重低血压无疑进一步加重了心肌缺血。在此基础上甚至轻度的痉挛均可导致灾难性的后果。过敏本身释放的介质可诱发痉挛,此时大剂量肾上腺素和多巴胺的使用无疑增加了冠脉痉挛的风险。尽管肾上腺素是过敏性休克的一线用药,无绝对禁忌证,但在治疗心脏病时无疑风险大大增加。
2、胰高血糖素理论上不是合适用药:
有文献报道应用胰高血糖素可通过其正性肌力、正性变时和正性传导作用获得理想效果[6, 7, 9, 11, 19]。但胰高血糖素并不能收缩外周血管,外周血管阻力和平均动脉压反而下降[20, 21],因此理论上并不能解决过敏性休克的主要矛盾。另外还有诱发室性心律失常的忧虑[22],而该患者已发生多次室颤和持续性室速,笔者认为胰高血糖素可能不是理想的替代用药。
3、IABP可能更加安全有效:
最后采用IABP才成功稳定病情。血管途径过敏反应常常进展迅速;在心血管领域,一旦发生过敏性休克,往往更加严重,肾上腺素不良反应更常见、更具破坏性(更易引起继发性心血管事件)。
IABP对于肾上腺素无效患者有诸多优势:
(1)IABP能有效提升舒张压,增加心脏灌注,这在缺血性心脏病患者(心肌主要依赖于舒张期供血)合并过敏性休克(主要机制为外周血管扩张和舒张压显著下降)患者尤为重要。
(2)IABP机械支持可能比升压药或大剂量肾上腺素更具备优势,可避免药物相关不良反应,后者在原有基础心脏病患者可能是致命的。
(3)在心内科或心导管室,IABP随手可得,使用成熟,具有天然的优势。
因此,笔者认为,IABP比起指南推荐的二线治疗(升压药或大剂量肾上腺素)具有更好的安全性,甚至可以列为心导管室过敏性休克处理的新的二线治疗方案,而不仅仅是先前报道的“过敏性休克的最后救星”[5]。也就是说,对难治性过敏性休克患者,在充分液体复苏和肌注肾上腺素等前提下,如条件允许,应考虑及时植入IABP提供循环支持。但有效性究竟如何,尚需进一步观察和资料积累。
【参考文献】
1. Muraro A, Roberts G, Worm M, et al. Anaphylaxis: guidelines from the European Academy of Allergy and Clinical Immunology. Allergy, 2014, 69: 1026-1045.
2. Lieberman P, Simons F E. Anaphylaxis and cardiovascular disease: therapeutic dilemmas. Clin Exp Allergy, 2015.
3. Momeni M, Brui B, Baele P, et al. Anaphylactic shock in a beta-blocked child: usefulness of isoproterenol. Paediatric anaesthesia, 2007, 17: 897-899.
4. Yeguiayan J M, Ravisy J, Lenfant F, et al. Anaphylactic shock: the advantages of intra aortic balloon counter pulsation for the treatment of heart failure. Resuscitation, 2007, 72: 493-495.
5. Alam R, Anantharaman R. Use of IABP in contrast media-induced anaphylactic shock: the ultimate lifesaver. BMJ Case Rep, 2013, 2013.
6. Thomas M, Crawford I. Best evidence topic report. Glucagon infusion in refractory anaphylactic shock in patients on beta-blockers. Emerg Med J, 2005, 22: 272-273.
7. Javeed N, Javeed H, Javeed S, et al. Refractory anaphylactoid shock potentiated by beta-blockers. Cathet Cardiovasc Diagn, 1996, 39: 383-384.
8. Toogood J H. Risk of anaphylaxis in patients receiving beta-blocker drugs. J Allergy Clin Immunol, 1988, 81: 1-5.
9. Zaloga G P, DeLacey W, Holmboe E, et al. Glucagon reversal of hypotension in a case of anaphylactoid shock. Ann Intern Med, 1986, 105: 65-66.
10. Triggiani M, Patella V, Staiano R I, et al. Allergy and the cardiovascular system. Clin Exp Immunol, 2008, 153 Suppl 1: 7-11.
11. Laxenaire M C, Torrens J, Moneret-Vautrin D A. [Fatal anaphylactic shock in a patient treated with beta-blockers]. Ann Fr Anesth Reanim, 1984, 3: 453-455.
12. Lang D M, Alpern M B, Visintainer P F, et al. Increased risk for anaphylactoid reaction from contrast media in patients on beta-adrenergic blockers or with asthma. Ann Intern Med, 1991, 115: 270-276.
13. Jacobs R L, Rake G W, Jr., Fournier D C, et al. Potentiated anaphylaxis in patients with drug-induced beta-adrenergic blockade. J Allergy Clin Immunol, 1981, 68: 125-127.
14. Hannaway P J, Hopper G D. Severe anaphylaxis and drug-induced beta-blockade. N Engl J Med, 1983, 308: 1536.
15. Lang D M, Alpern M B, Visintainer P F, et al. Elevated risk of anaphylactoid reaction from radiographic contrast media is associated with both beta-blocker exposure and cardiovascular disorders. Arch Intern Med, 1993, 153: 2033-2040.
16. Nassiri M, Babina M, Dolle S, et al. Ramipril and metoprolol intake aggravate human and murine anaphylaxis: evidence for direct mast cell priming. J Allergy Clin Immunol, 2015, 135: 491-499.
17. Zhang W, Shibamoto T, Kurata Y, et al. Effects of beta-adrenoceptor antagonists on anaphylactic hypotension in conscious rats. Eur J Pharmacol, 2010, 650: 303-308.
18. Simons F E, Ardusso L R, Bilo M B, et al. World allergy organization guidelines for the assessment and management of anaphylaxis. World Allergy Organ J, 2011, 4: 13-37.
19. Lieberman P, Nicklas R A, Oppenheimer J, et al. The diagnosis and management of anaphylaxis practice parameter: 2010 update. J Allergy Clin Immunol, 2010, 126: 477-480 e471-442.
20. Parmley W W, Glick G, Sonnenblick E H. Cardiovascular effects of glucagon in man. N Engl J Med, 1968, 279: 12-17.
21. Madan B R. Effect of glucagon on ventricular arrhythmias after coronary artery occlusion and on ventricular automaticity in the dog. Br J Pharmacol, 1971, 43: 279-286.
22. Markiewicz K, Cholewa M, Gorski L. Cardiac arrhythmias after intravenous administration of glucagon. Eur J Cardiol, 1978, 6: 449-458.
《中国医学论坛报》策划制作,谢绝转载

查看更多