查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





急性缺血性卒中(AIS)早期治疗的关键是通过静脉溶栓或机械取栓等血管内治疗方法尽快使闭塞血管恢复再通,挽救缺血半暗带。但再灌注治疗后的出血转化(hemorrhagic transformation,HT)是困扰临床医生的主要问题,对于HT,如何早期预测,如何评价,如何防治,HT后如何重启抗栓治疗等都是再灌注治疗中经常面临的问题,下面就这些相关临床话题阐述其当前进展。

出血转化是指急性脑梗死后缺血区血管重新恢复血流灌注导致的出血,包括自然发生的出血 (自发性出血转化)和采取干预措施后(包括溶栓、取栓和抗凝等)的出血(继发性/治疗性出血转化);出血的部位既可在梗死灶内,也可在梗死灶远隔部位。
目前多数研究采用的定义为:脑梗死后首次头颅CT或MRI未发现出血,而再次头颅CT或MRI检查时发现有颅内出血,或根据首次头颅CT/MRI可以确定的出血性梗死。
根据有无神经功能缺损加重可分为症状性颅内出血(symptomatic intracranial hemorrhage,SICH)和无症状性颅内出血(asymptomatic ICH,aSICH),表1是不同研究中对SICH的具体定义。
根据影像学上有无血肿占位效应,又将HT分为脑实质内出血(parenchymal hematoma,PH)和出血性梗死(hemorrhage infarction,HI)。表2是根据影像学特点(部位和形态),不同研究对AIS后出血转化定义的影像学分型,其中ECASS分型比较常用,图1是ECASS出血分型。
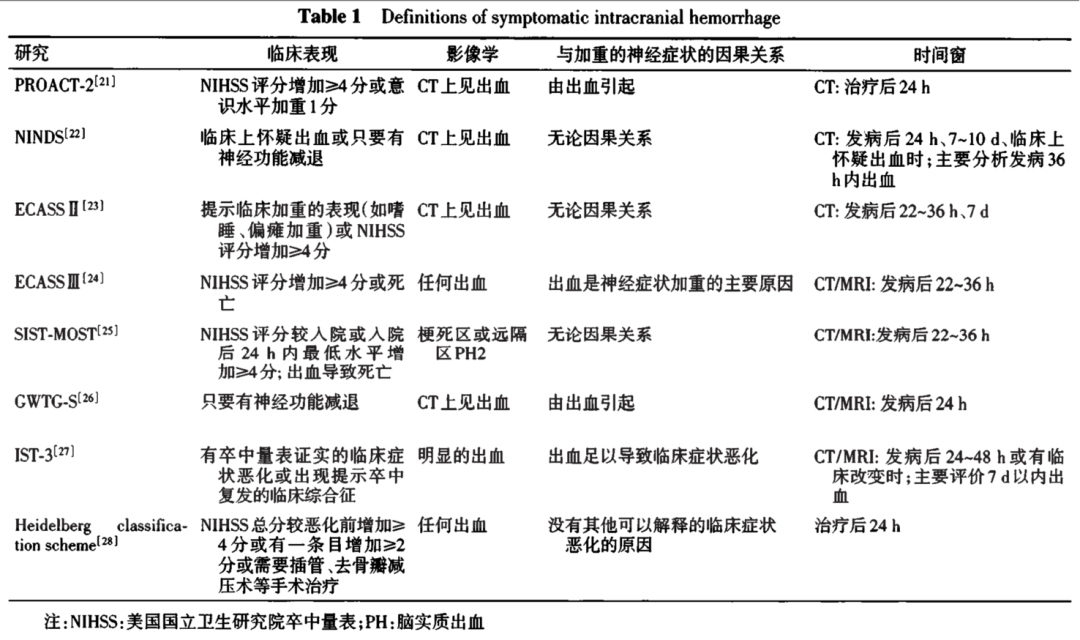

HI-1:沿梗死灶边缘的小点状出血;
HI-2:梗死灶内片状无占位效应出血或多个融合的点状出血;
PH-1:血肿<梗死面积的30%并有轻度占位效应;
PH-2:血肿>梗死面积的30%并有明显占位效应的出血或远离梗死灶的出血。
A~B为渗出型出血;C~D为血肿型出血。
图1 ECASS 出血转化分型

根据既往研究,自发性HT发生率为7%-29%;使用阿司匹林或肝素患者HT发生率为8%~22%,其中症状性HT占2%~9%;溶栓后HT为10%-48%,其中症状性HT为2%-7%。血管内治疗后HT发生率为46.0%~49.5%,其中症状性HT发生率为2%~16%。
溶栓后HT多发生在36 h内(96%的SICH发生在36h内),且大部分发生在24h内。美国2017年溶栓后出血转化共识指出36h后出现的HT不被认为与溶栓导致的凝血功能紊乱相关。
无症状性HT对预后无影响;症状性HT,有明显占位效应的PH-2型对预后不利,其病死率可达50%,轻微占位效应的PH-1型通常对近期预后不利,对远期预后无明显影响。因此,临床医生更关注的是能影响预后的SICH或有明显占位效应的PH。

出血转化机制主要与梗死后造成的脑组织损伤(脑水肿、占位效应、广泛急性脑损伤/BBB破坏等)、再灌注损伤、凝血功能紊乱(溶栓剂、基础疾病等因素所致)和血脑屏障破坏(原发、继发)等相关,明确的机制尚不完全清楚。
关于危险因素,分为临床因素、影像学因素和生化因素三个方面,前两者比较容易获得,研究较多。临床因素方面,2012年Stroke发表一项meta分析(n=65264)显示,年龄、高NIHSS评分及高血糖是静脉溶栓后HT的独立危险因素;2018年SVN杂志发表的纳入14项中国人群研究的meta分析(n=2548)显示,年龄、房颤、卒中史、服用抗血小板药物史、高NIHSS评分、血压及血糖水平是静脉溶栓后HT的独立危险因素。影像学因素,基于既往研究发现的危险因素有早期梗死灶大小(DWI)、脑动脉高密度征、广泛白质疏松/微出血、血脑屏障渗漏(CTP)、早期脑实质内强化信号(急性损伤)、脑血流下降(灌注成像)等。
关于血管内再通治疗后HT,2019年Expert Rev Neurother杂志发表一项包括10001例机械取栓患者的meta分析显示,女性、手术时长,使用替罗非班和入院时ASPECT评分(梗死面积)是SICH的独立危险因素。
总之,影响HT的重要因素包括卒中造成的病理损伤程度(卒中严重程度、梗死面积)、大脑的基础病理损伤(如广泛白质疏松等造成的血脑屏障破坏),对于取栓患者,是否成功开通、开通的时间都是影响HT的重要因素,此外,再灌注治疗前的血压、血糖水平也是重要的影响因素。卒中严重程度通过NIHSS评分评价,梗死面积可通过ASPECT评分评价。
关于预测静脉溶栓后出血的评分,有HAT评分、SEDAN评分、SITS-SICH评分、GRASPS评分、iScore评分。研究显示这些评分预测HT的ROC曲线下面积基本都在0.7左右。

对于预防静脉溶栓后HT,掌握好溶栓时间窗(梗死时间越长,病灶越大,加重血脑屏障破坏)及溶栓剂剂量,控制好血压、血糖等。对于预防机械取栓后HT,与上基本原则一致,正确选择适应证,缩短血管开通时间,管理好血压、血糖水平,合理使用抗凝、抗血小板药物等。
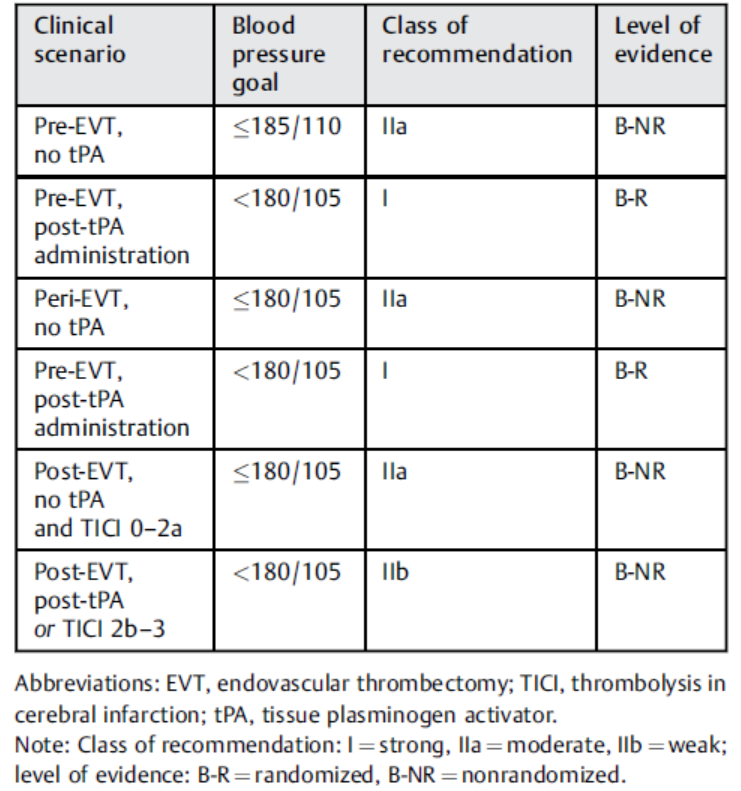
血糖宜平稳控制在≤10mmol/L;对于取栓围手术期(联合/不联合静脉溶栓)血压管理,2019年AHA/ASA缺血性卒中急性期管理更新指南中做了推荐,见表3。
在取栓时间窗延长至24h的DAWN研究中,取栓后血压控制情况是:
TICI 为2b-3时,SBP<160mmHg,大梗死灶SBP<140mmHg;
TICI<2b,BP<180/105mmHg。
表3 2019年AHA/ASA卒中急性期指南中对取栓围手术期血压管理的推荐
对于HT患者,重要的是再灌注治疗后如何重启抗栓治疗(抗血小板和抗凝)。
静脉溶栓后重启抗栓治疗:
2019年中国脑出血诊治指南 |
|
|
|
中国急性脑梗死后出血转化诊治共识2019 |
出血转化后可根据患者临床评估结果,个体化重新启用或继续使用抗栓治疗(包括抗血小板或抗凝药物)。对于症状性出血转化的患者,应评估患者临床情况并权衡利弊,待病情稳定后10 d至数周后开始抗栓治疗。 |
在美国自发性脑出血指南中:抗凝相关脑出血后,恢复口服抗凝药的最佳时机尚不确定,在无机械性心脏瓣膜患者中,出血后至少4周重启抗凝治疗可减少脑出血复发风险;抗血小板单药治疗可在出血后数天启动,但最佳时间仍不明确。
机械取栓后的抗栓治疗
取栓术后的抗栓治疗研究较少,基于目前一些循证及相关指南:
使用rtPA的患者,24h后排除明显出血后使用抗血小板药物。
未植入支架的患者,经过影像排除明显出血后,非心源性栓塞予单抗或双抗治疗(可以24h内使用,单抗或双抗根据病情严重程度及出血风险),房颤或其他心源性栓塞在合适的时间可考虑抗凝治疗(非瓣膜性房颤可于术后7~14天启动抗凝),由于颅内出血的风险,不建议取栓术后立即给予抗凝治疗。
同时予支架植入的患者建议予阿司匹林和氯吡格雷双抗治疗1~3个月,后改为长期单抗治疗。
抗凝治疗需考虑出血转化的风险,和抗凝治疗的紧迫性(房颤的预防用药或预防深静脉血栓、肺栓塞的迫切需求)。在有的中心,以梗死面积为参考标准,当梗死面积<30ml时,术后即予抗凝治疗,30-70ml时2-4周后,大于70ml时4-6周予抗凝治疗。
深静脉血栓的药物预防需要在连续影像监测确保出血稳定后24-48h再启动。
血肿型出血、与溶栓相关的出血可予冷沉淀,尤其是纤维蛋白原<100mg/ml者。
出血转化的患者抗血小板药物可以暂停5-7天,SICH需停用10天以上,除非有停用抗血小板治疗的禁忌证。
心、脑血管疾病很多治疗原则相通,卒中患者发生出血转化后的抗栓治疗可以参考心血管疾病相关指南。
冠心病双联抗血小板治疗中国专家共识(2021) |
|
急性冠状动脉综合征抗栓治疗合并出血防治多学科专家共识(2016) |
|
来源:长颈鹿智慧医学平台

最新指南 | 2022 AAN实践指南:症状性颅内大动脉粥样硬化性卒中预防
Neurology:中年时期进行中到剧烈运动有益于晚年的脑血管健康
【PDF下载】急性脑梗死缺血半暗带临床评估和治疗中国专家共识
查看更多