查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





超过半数头颈部鳞癌(HNSCC)患者可发生局部复发或远处转移,HNSCC患者一旦出现远处转移,仅约20%患者生存期能超过一年。免疫治疗药物的陆续获批为复发/转移性头颈部鳞癌(R/M HNSCC)患者带来新的希望,以免疫为基础的联合治疗也成为研究热点,可供联合的药物包括放疗药物、靶向药物、免疫药物等。《中国医学论坛报》有幸邀请到河南省肿瘤医院吴慧教授、苏州大学附属第一医院周菊英教授、南京大学附属鼓楼医院闫婧教授,对2021年HNSCC免疫治疗几项重要研究进展进行盘点和点评。本文将访谈内容总结如下,供读者参考。
CheckMate-651研究:纳武利尤单抗(NIVO)联合伊匹木单抗(IPI)对比EXTREME方案(西妥昔单抗+铂类+5-FU)一线治疗R/M HNSCC Ⅲ期研究
吴慧教授:近年来,免疫治疗在头颈部肿瘤领域取得了一些重要进展,对于R/M HNSCC一线治疗方案的选择也是探索不止。CheckMate-651研究旨在评估双免联合方案一线治疗R/M HNSCC的疗效和安全性。本研究纳入既往未接受过治疗,或曾针对局部晚期疾病进行过化疗且治疗后≥6个月无进展的R/M HNSCC(口腔、口咽、下咽或喉)患者,患者体力状态评分(ECOG PS)0-1分。947例患者按1:1比例随机分配到NIVO+IPI(NIVO 3 mg/kg Q2W、IPI 6 mg/kg Q6W)和EXTREME组。两组患者随访直至疾病进展或出现不可接受的毒性或NIVO+IPI治疗满2年。研究的主要终点为总人群和CPS≥20人群的总生存期(OS)(图1)。
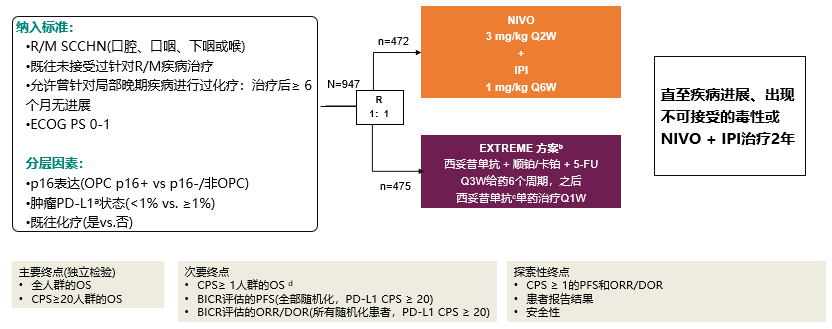
图1. CheckMate-651研究设计
研究结果
在所有随机化(HR:0.95;P=0.4951)或CPS≥20的患者(HR:0.78;P=0.0469)中,NIVO+IPl作为R/M HNSCC的一线治疗方案与EXTREME相比,OS无统计学改善。但在PD-L1 CPS≥20(图2)或CPS≥1(图3)的患者中,NIVO+IPl治疗与EXTREME相比具有临床获益,表现为OS时间延长和应答更持久。在CPS≥20患者中,与EXTREME相比,NIVO+IPl患者出现临床症状恶化的时间较晚、临床改善总体健康状况更佳(图4)。并且试验中接受NIVO+IPl治疗的患者的毒性数据与之前研究实体瘤患者中接受NIVO+IPl治疗所报道的毒性数据一致,未观察到新的安全性问题。
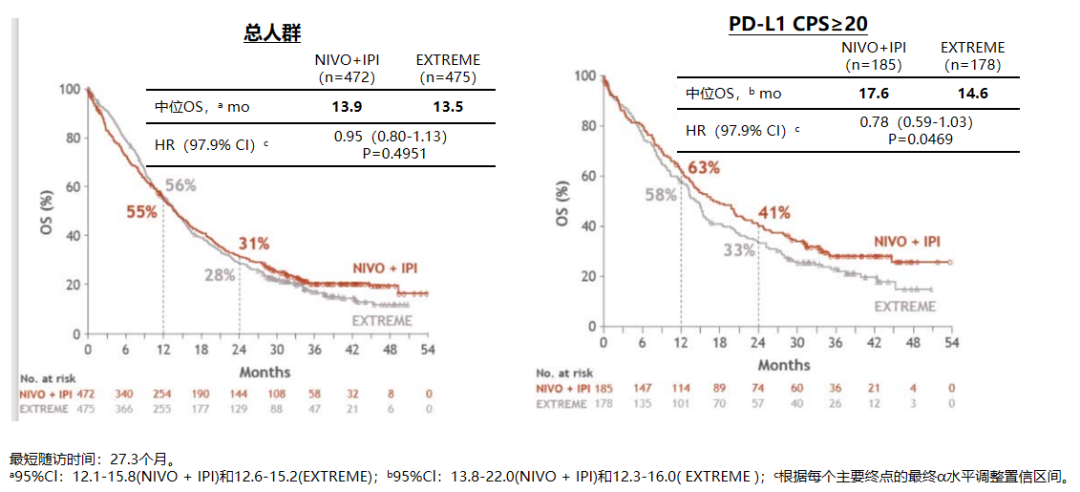
图2. CheckMate-651研究患者OS
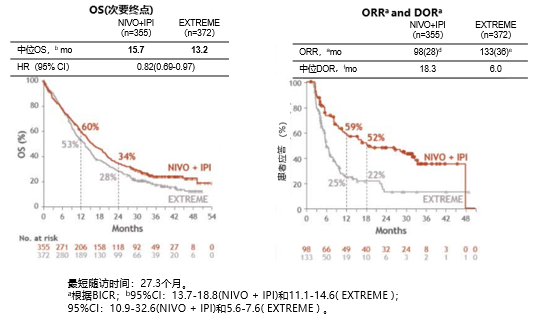
图3. CheckMate-651研究PD-L1 CPS≥1患者疗效
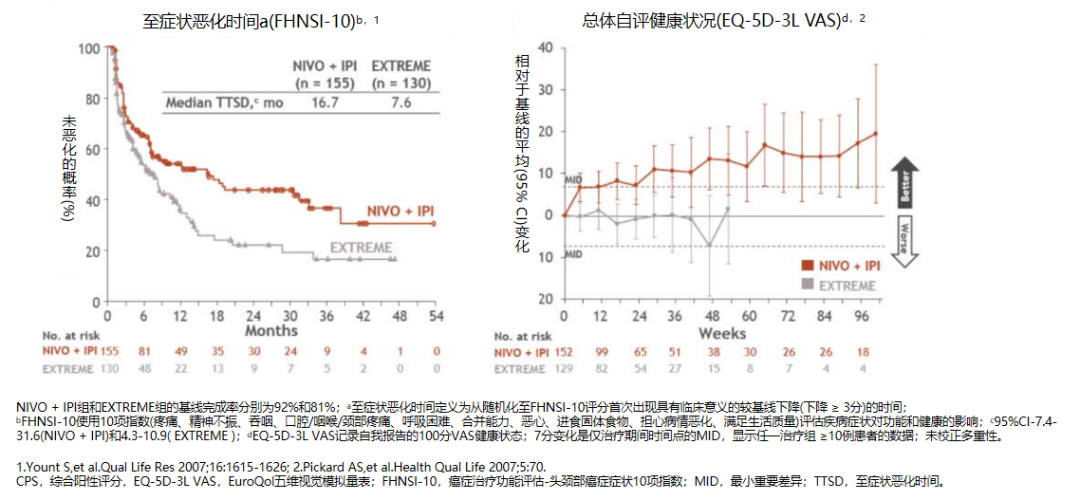
图4. CheckMate-651研究PD-L1 CPS≥20患者至症状恶化时间和总体自评健康状况
研究结论
双免疫一线治疗可延长PD-L1 CPS≥20或CPS≥1的R/M HNSCC患者OS、提高OS应答率,延缓CPS≥20的R/M HNSCC患者临床症状恶化时间并改善总体健康状态,总体用药安全可控。
专家点评
免疫检查点抑制剂的迅速崛起改变了R/M HNSCC的治疗格局,双免疫疗法被认为是替代化疗的潜在选择,但目前尚无研究显示双免疫药物一线治疗R/M HNSCC患者能够达到理想的治疗效果。CheckMate-651研究未达双终点,主要可能是对照组有63%的患者接受了后续治疗,其中46%的患者接受了二线免疫治疗,较NIVO+IPI组更高,后线交叉治疗的存在在一定程度上影响OS结果,导致对照组的OS值比我们标准的EXTREME方案高很多。但NIVO+IPI组在缓解持续时间(DOR)方面获益明显,且在CPS≥20的患者中双免治疗具有明确的生存获益趋势,可延缓临床症状恶化的时间并提高患者生活质量,因此不能完全否定双免治疗方案在头颈肿瘤中的疗效,还需要进一步亚组分析探索可能获益的人群。
R/M HNSCC患者整体预后较差,GLANCE H&N研究显示仅有39.4%和12.7%的R/M HNSCC患者有机会接受二线/三线治疗。因此对于R/M HNSCC患者,需要特别注重一线治疗的选择。从目前的几项头颈部鳞癌晚期治疗的大型III期研究结果来看,KEYNOTE-048研究彰显出了可喜的成果,国内外指南推荐帕博利珠单抗单药或联合化疗用于一线治疗复发或转移性的头颈部鳞癌。未来免疫治疗在R/M HNSCC领域我们可以考虑免疫治疗再加上新的靶点,比如联合LAG-3、TIGIT可能会对我们的免疫治疗产生协同增效的作用。期待更多的研究结果持续点亮免疫时代R/M HNSCC患者的治疗,提高患者的生活质量,改善患者的生存预后。
REACH研究:Avelumab+西妥昔单抗+放疗(RT)较标准治疗对局晚期头颈部鳞癌(LA HNSCC)患者疗效的开放标签、随机、多中心、III期临床研究
周菊英教授:基于PD-L1单抗Avelumab联合西妥昔单抗和放疗的潜在协同效应,本试验对比了在LA-HNSCC中该联合治疗方案与两种标准治疗(SOC)方案的疗效。研究共纳入707例既往未接受治疗的LA HNSCC患者,可耐受大剂量顺铂患者(Fit队列)接受放疗+顺铂或Avelumab+西妥昔单抗+放疗联合治疗;另一部分为不能耐受大剂量顺铂患者(Unfit队列)接受放疗+西妥昔单抗或Avelumab+西妥昔单抗+放疗联合治疗。此后Avelumab+西妥昔单抗+放疗联合组治疗后再接受Avelumab 12个月的维持治疗,研究主要终点为无进展生存期(PFS)。
研究结果
Unfit队列Avelumab+西妥昔单抗+放疗组PFS未达主要终点,但有延长趋势,24个月PFS率分别为44%和31%(图5)。联合Avelumab治疗后远处转移累计发生率降低,分别为5.4% vs 14.3%,具有统计学差异,但局部-区域进展累计发生率、既往未发生进展的累计死亡率和总生存率两组无显著性差异(图6)。安全性方面,两组患者发生3级以上不良事件(AE)比例均为80%,联合Avelumab组表现出非显著性的死亡事件增加,但其中没有Avelumab直接相关的毒性事件。
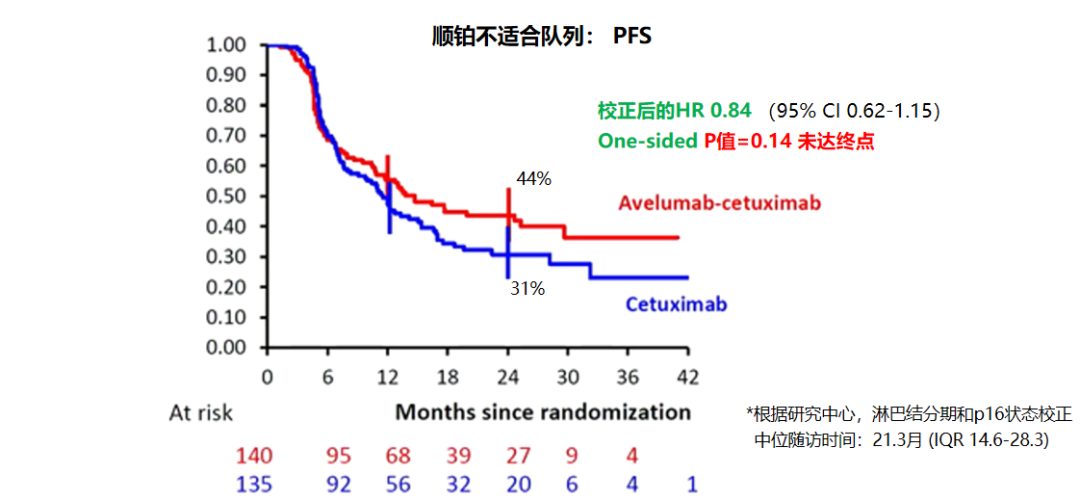
图5. REACH研究主要终点PFS结果对比

图6. REACH研究远处转移和局部区域进展发生率结果对比
Fit队列进行了计划的无效性中期分析,结果显示两组患者1年PFS率在标准治疗组为73%(95% CI 65%-81%),Avelumab+西妥昔单抗+RT组为64%(95% CI 54%-72%),风险比达到1.27(95%CI 0.83-1.93),已跨过无效性边界(图7)。
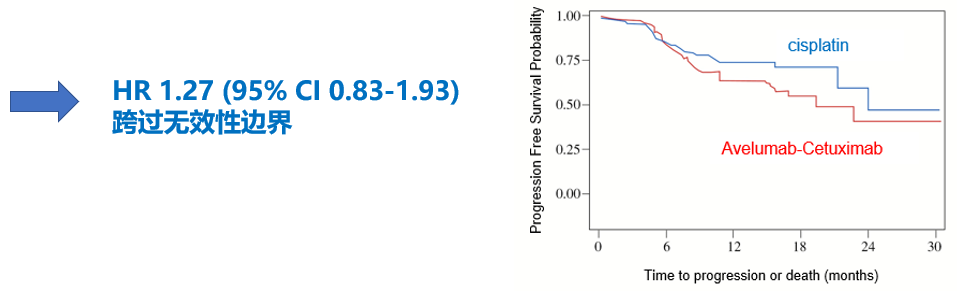
图7. REACH研究Fit队列疗效结果
研究结论
不耐受大剂量顺铂患者:Avelumab+西妥昔单抗+化疗联合治疗在LA HNSCC患者PFS、局部-区域控制、远处转移中显示出获益趋势;耐受大剂量顺铂患者:接受标准治疗放疗+顺铂的患者获益更佳。
专家点评
放化疗联合治疗可产生较明显的不良反应,影响患者治疗耐受性和安全性。REACH研究希望尝试去化疗方案,但研究分析显示为阴性结果,能够耐受顺铂的LA HNSCC患者,顺铂+放疗仍然是目前经典的规范化治疗方案。同步治疗的时候,放疗范围包括了肿瘤病灶、淋巴引流区,放疗可对免疫细胞造成较强的杀伤作用。尽管可通过营养支持和对症处理稍加改善,但是淋巴引流区大范围的照射可使患者淋巴细胞计数明显下降。在这样的前提下,使用免疫检查点抑制剂虽然可以提高免疫细胞对肿瘤的识别能力,但是由于免疫细胞数量太少,无法对肿瘤细胞发起有效的攻击,严重影响了放疗期间同步免疫治疗的疗效,因此未来仍有值得探索的方向,例如调整放疗的剂量、放疗的频率等,探索放疗同步免疫治疗相适应的最佳条件。不能耐受顺铂的LA HNSCC患者,以帕博利珠单抗为代表的PD-1单抗,不仅能够阻断PD-1与PD-L1之间的协同抑制信号,而且可以阻断PD-1与PD-L2之间的交互作用。既往研究显示,PD-L2的表达对HNSCC患者接受免疫治疗的疗效存在预测价值。我们非常期待KEYNOTE-412的研究结果,希望帕博利珠单抗联合同步放化疗能有个好的结果,可以指导我们未来的研究方向。
ALPHA研究:阿法替尼联合帕博利珠单抗治疗R/M HNSCC患者疗效的单臂、II期临床研究
闫婧教授:阿法替尼是一种不可逆的EGFR-酪氨酸激酶抑制剂(TKI),在体外和动物实验中已被证明能增强抗PD-1药物活性,ALPHA研究对阿法替尼联合帕博利珠单抗治疗R/M HNSCC患者的疗效进行了探索。研究纳入经组织学证实的口腔、口咽、下咽或喉部鳞状细胞癌,但不适合治愈性手术或根治性放化疗的复发或转移性患者,可根据RECIST 1.1标准评估病灶且患者ECOG PS≤2。患者入组后接受帕博利珠单抗200 mg q3w*35+阿法替尼40 mg/d口服治疗。研究的主要终点为客观缓解率(ORR)。
研究结果
ALPHA研究共招募了29例患者,中位PFS为4.1个月(95%CI,1.8-6.5),中位OS为8.4个月,总人群ORR为41.4%(图8)。生物标志物分析提示,PD-L1高表达患者显示出更高的缓解率(TPS≥50患者ORR为71%,CPS≥20患者ORR为63%),此外EGFR扩增也可能预示更高的应答率(ORR:3/3,100%),MTAP缺失或突变可能预示治疗的不良预后。
阿法替尼联合帕博利珠单抗治疗相关的常见AE如下:≥3级AE包括皮疹(22/29,4/29)、腹泻(17/29,3/29)、甲沟炎(13/29,0/29)、黏膜炎(9/29,1/29)和体重减轻(2/29,0/29);有1例患者出现2级AE:肺炎。
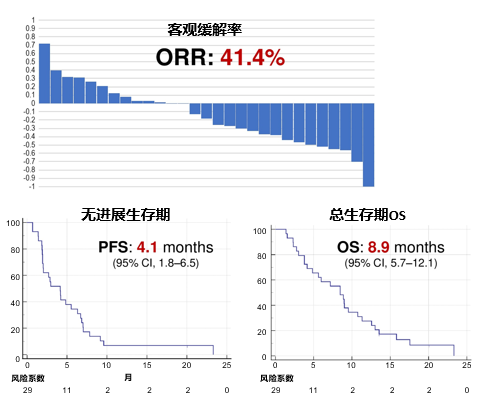
图8. ALPHA研究临床反应和生存率
研究结论
以帕博利珠单抗为基础的头颈部鳞状细胞癌治疗中,阿法替尼可能改变肿瘤微环境,提高临床治疗有效率。PD-L1、EGFR扩增和MTAP缺失/突变可能是癌症免疫治疗的生物标志物。
专家点评
EGFR-TKI可以通过抑制巨噬细胞功能、增加抗原呈递和增强T细胞反应,进而与PD-1抑制剂产生协同作用。ALPHA研究结果显示,阿法替尼联合帕博利珠单抗改善了R/M HNSCC患者的治疗结果,减少肿瘤负荷,一定程度缩小肿瘤,其中PD-L1高表达的患者能获得更高的ORR。此外,筛选适合免疫治疗人群是当前研究热点方向,ALPHA研究纳入了生物标志物作为影响因素,令人惊喜的是,研究提出了PD-L1表达、EGFR扩增和MTAP缺失/突变可能是影响癌症免疫治疗效果的生物标志物。ALPHA研究为未来HNSCC患者免疫治疗有效性提供了研究思路,有望进一步探索HNSCC免疫治疗的适宜人群,扩大获益人群,使免疫治疗精准化。与此同时,虽然免疫检查点抑制剂在R/M HNSCC一线治疗及后线治疗都已相继获批,但是PD-L1表达阴性的患者免疫单药获益有限。免疫联合靶向治疗能否扩大在R/M HNSCC中的适应证,尤其是针对PD-L1低表达的患者,是未来研究需要思考的一个重要方向。
总结
HNSCC是一种具有高度免疫缺陷的肿瘤,对免疫治疗较敏感。2016年,美国食品和药物管理局(FDA)批准了两种PD-1抑制剂用于R/M HNSCC患者的二线治疗。2019年,帕博利珠单抗凭借KEYNOTE-048研究的突出数据拿下单药和联合化疗一线治疗R/M HNSCC的适应证。以免疫为基础的联合治疗已初现成效,未来还有各种联合方案值得深入挖掘,期待更多积极的研究结果让HNSCC患者长期生存的梦想照进现实。
专家简历
吴慧 教授
主任医师/教授 医学博士 硕士研究生导师
河南省肿瘤医院头颈肿瘤放疗科主任
中国抗癌协会鼻咽癌专业委员会常务委员
中国抗癌协会放射治疗专业委员会委员
中国医师协会头颈部肿瘤专业委员会委员
河南省医学会放射治疗专业委员会副主任委员
河南省抗癌协会放射治疗专业委员会副主任委员
河南省肿瘤医院放射肿瘤规培基地主任
河南省卫健委5451领军人才
美国威斯康星医学院访问学者
中国抗癌协会胶质瘤专业委员会委员
河南省老年学会放射治疗分会候任主任委员
河南省劳动模范和先进工作者
五一劳动奖章获得者
周菊英 教授
医学博士 主任医师 教授 博士生导师
苏州大学附属第一医院放疗科主任
江苏省医学会放射肿瘤治疗学分会主任委员
江苏省放射治疗医疗质量控制中心副主任
江苏省抗癌协会肿瘤放射治疗专业委员会副主任委员
江苏省核学会放射治疗专业委员会副主任委员
中华肿瘤学杂志、中华放射医学与防护杂志、国际肿瘤学杂志等杂志编委
闫婧 教授
博士 主任医师 硕士生导师
南京大学医学院附属鼓楼医院肿瘤中心副主任
南京医学会放射肿瘤治疗学专科分会副主任委员
华人肿瘤放射治疗协作组放射免疫委员会江苏分会副主任委员
江苏省抗癌协会鼻咽癌专业委员会副主任委员
江苏省中西医结合学会肿瘤放疗专业委员会常委
江苏省免疫学会放射与免疫专业委员常委
江苏省医学会放射肿瘤治疗学分会委员
江苏省核学会放射治疗专业委员会委员
中国医师协会放射肿瘤治疗医师分会委员
中国抗癌协会肿瘤营养与支持治疗专业委员会委员
吴阶平医学基金会肿瘤放疗专业委员会委员
审批号:MI-PD1-2376-CN
免责声明:
本资讯由默沙东医学团队编辑提供,旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
查看更多