查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






作者:黄浙勇 复旦大学附属中山医院心内科
本期话题——造影剂过敏的抢救:激素不是一线用药!

黄浙勇 副主任医师
15年前参加一次国内心血管会议,其中有个个案为“成功处理碘造影剂过敏性休克1例”,术者将其“成功”归功于“超大剂量糖皮质激素”。第一次动摇了我的“三观”,后来,我在多次会议上听到类似观点,好像激素治疗过敏性休克成了国内的主流共识,便彻底无语了。
碘造影剂过敏在心脏介入中并不罕见,为了纠正过敏性休克救治过程中的常见误区,笔者结合中山医院的救治体会,结合最新资料,写就此文以飨读者,以正视听。
鉴于实用为主的原则,此文以问题解答的方式呈现。
【肾上腺素为何是首选药?】
所有过敏反应(anaphylaxis)相关指南均明确指出,肾上腺素是一线用药、救命药[1, 2]。无绝对禁忌证[3]。The importance of epinephrine cannot be overemphasized! 过敏反应一经诊断,应立即、尽快给药。因为所有临床观察性研究、随机对照研究、回顾性研究、动物实验和体外实验均确定无误地告诉我们:过敏反应的首选药物是肾上腺素,不是糖皮质激素,也不是抗组胺药。
为什么首选肾上腺素?过敏反应是累及皮肤、黏膜、呼吸道、消化道、心血管等多个脏器的全身系统性疾病,最严重的后果是低血容量性休克和呼吸道阻塞。就某一个体而言,过敏反应累及器官并无特定顺序,病情进展也无法预测,因此一旦发现过敏反应,应该首选疗效全覆盖的药物。
激素可缓解支气管痉挛,但对已经发生的过敏反应并无治疗作用,只能用于过敏反应的预防。
激素和异丙嗪(非那根)只能缓解皮肤症状,对致命性低血压和呼吸道阻塞并无疗效。
而肾上腺素可基本满足该需求。
肾上腺素抗过敏反应的全效性体现在以下几个方面(图1):
(1)α1肾上腺素能受体(α1受体)兴奋,机体大多数器官(骨骼肌除外)产生缩血管效应,预防和缓解粘膜水肿导致的气道阻塞,预防和缓解低血压休克;
(2)β1肾上腺素能受体(β1受体)兴奋,产生正性肌力和正性变时作用,缓解低血压;
(3)β2 肾上腺素能受体(β2受体)兴奋,减少过敏介质释放,舒张支气管。
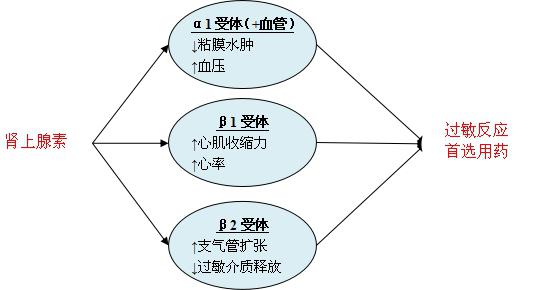
△图1 肾上腺素抗过敏反应的“全效性”
不仅国内,国外临床实践也普遍存在肾上腺素使用率低下的问题[4, 5]。英国每年大约发生20例致死性过敏反应,肾上腺素在心跳呼吸骤停发生前使用率只有14%,总体使用率也只有62%[4]。
【激素和非那根为何不是一线治疗?】
二线药物治疗过敏反应的依据主要来自于其他疾病,如荨麻疹(抗组胺药)和急性哮喘(β2受体激动剂和糖皮质激素)。由于缺乏临床试验,各个过敏反应指南和综述对抗组胺药、糖皮质激素和β2受体激动剂的推荐等级并不一致。一旦发生休克,抗过敏治疗是否有效还存在争议。更重要的是,二线药物的过度重视会影响一线药物的及时使用。
(1)激素:从急性哮喘治疗经验推断激素可治疗过敏反应。但事实上,其作用被大大高估:
①对已经发生的过敏反应无效。激素常被错误的当做一线药物使用,客观上影响了真正的一线药物肾上腺素的及时使用[6]。
②可能缓解延迟出现的过敏症状和防止双相过敏。但事实是,这些理论上的作用从未被证明,荟萃分析尚未证明糖皮质激素可有效治疗过敏反应;甚至对未经选择的放射造影剂人群预防性静脉注射抗组胺药或激素并不能预防致死性过敏反应的发生[7]。
③作用缓慢。静脉应用糖皮质激素,其发挥作用需要数小时,这也是为何过敏反应激素预防性用药要提早1h以上的原因。使用推荐:只是在肾上腺素已经给药的情况下,才注射糖皮质激素。
(2)H1抗组胺药:组胺是过敏反应的重要介质,H1抗组胺药[如非那根12.5~25 mg,肌肉注射(简称肌注)]能有效缓解瘙痒、充血、荨麻疹、血管性水肿、鼻涕和结膜充血等皮肤黏膜的过敏反应症状[8]。但是,并不能覆盖过敏的全部病理生理过程,关键是不能预防或缓解最严重的、致命性症状如上呼吸道阻塞、低血压和休克。因此H1抗组胺药不是救命药,不能替代肾上腺素。
由于缺乏随机对照试验的证据支持,一些指南并不推荐H1抗组胺药治疗过敏[9, 10]。
相对肾上腺素而言,H1抗组胺药起效缓慢(最大血药浓度需要1~3 h,而肾上腺素<10 min[11]),而且有潜在的中枢神经系统副作用(如嗜睡和认知功能损害)。
(3)H2抗组胺药:在H1抗组胺药基础上合用H2抗组胺药,可能有助于缓解充血、头痛等症状[12]。然而,只有少数几个指南推荐H2抗组胺药。快速静脉注射西咪替丁可加重低血压[13],而雷尼替丁本身可导致过敏[14]。相关的临床试验均存在方法学问题,证据力不强[15, 16]。
(4)β2受体激动剂:基于急性哮喘的治疗经验外推,选择性β受体激动剂(如沙丁胺醇)可作为过敏反应的辅助治疗,用于缓解肾上腺素未能缓解的喘息、咳嗽、气短等症状。虽然这些药有助于缓解下呼吸道症状,但由于其α1受体作用(缩血管效应)极小,不能防止或减轻喉头水肿、上呼吸道阻塞、低血压和休克,因此也无法替代肾上腺素。使用推荐:高剂量布地奈德气雾剂可有效缓解气道痉挛,推荐用于喘鸣患者。
【何时给肾上腺素?】
从理论上而言,假如患者只有血管神经性水肿或荨麻疹,口服或静脉注射抗组胺药即可控制皮肤症状;如果患者只有哮喘,给予吸入型β 2受体激动剂即可控制呼吸道症状;假如患者出现持续恶心呕吐或腹痛,或心血管系统表现,应该考虑肌注肾上腺素。
但所有指南均警告:过敏反应一经诊断,应立即尽快给肾上腺素!为何?也就是说,即使患者还没出现低血压,也应该肌注肾上腺素[17]!笔者分析了一下原因,可归纳为以下几点:
1、过敏反应进程不可预测。
过敏反应是累及皮肤、黏膜、呼吸道、消化道、心血管等多个脏器的全身系统性疾病(表1),就某一个体而言,其累及器官并无特定组合或特定顺序,也无法预测是否进展为致死性休克[18]!通俗一点讲,谁又能知道,皮疹和哮喘是患者过敏反应的终点,还是过敏反应的起点?患者使用心脏介入造影剂后出现皮疹,谁能保证患者不会进展为低血压休克呢?如心存侥幸,先用二线药物,赌注也未免太大了。还有部分患者存在双相过敏现象:症状缓解后,尽管不再接触过敏源,但在1~72小时内再发(通常8-10小时内)[19]。
因此一旦诊断或高度怀疑过敏反应,不要心怀侥幸。给肾上腺素!为防止再发,最好留院观察48小时[19]。
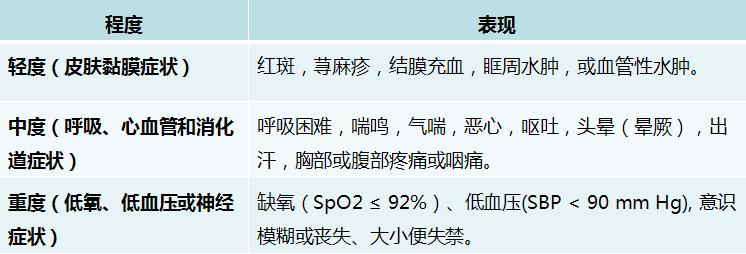
▽表1 过敏反应严重程度分级[20]
2、过敏反应进展迅速。
致死性过敏反应从发病到心跳呼吸骤停的中位时间为:食物过敏30分钟,昆虫叮咬15分钟,胃肠外药物5分钟[4]。症状出现越早,病情越严重,预后越差[21]。严重过敏反应留给我们抢救的时间非常短暂,可谓“机不可失,失不再来”。快速识别过敏反应后,立即给肾上腺素!一旦策略失误,不给或晚给肾上腺素,可能走上不归路。
【肾上腺素如何使用?】
使用方法:一旦诊断或高度怀疑过敏反应(即使血压正常!),立即于大腿中段前外侧肌注肾上腺素 0.01 mg/kg (浓度1:1000,即1 mg/mL) ,成人最大剂量 0.5 mg ,儿童0.3 mg。对院外过敏患者,欧洲指南甚至鼓励患者自己肌注肾上腺素以自救(图2)[2, 22]!扪心自问,假如导管室发生碘造影剂过敏,还有什么理由不给肾上腺素呢?
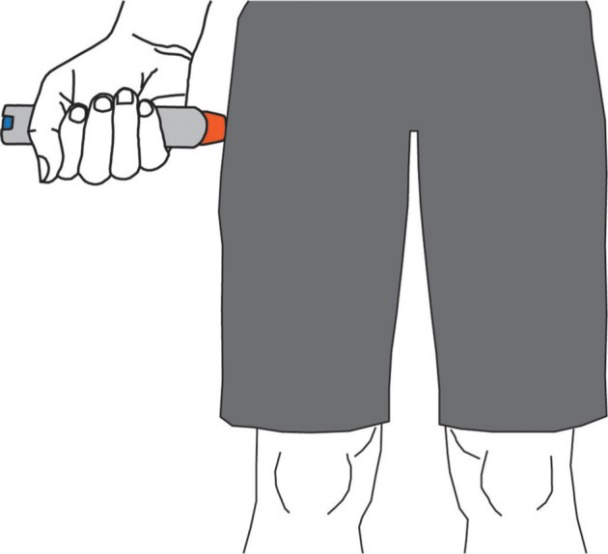
△图2 肾上腺素自我给药[23]
肌注可迅速达到血浆和组织峰值浓度,优于皮下注射[24]。如反应不佳,每隔5~15分钟可重复注射,直至症状缓解或出现肾上腺机能亢进症状(苍白,震颤,焦虑,心悸,头晕,头痛等)。大多数只需肌注1~2次,少数需要2次以上。
但在一些特殊情况下要灵活应用:
假如即将发生休克或已经发生,肾上腺素需要缓慢静脉注射。
假如心跳骤停即将发生或已经发生,肾上腺素需要快速静脉推注。
但在一般情况下,过敏反应应该避免静脉推注肾上腺素[25]。
任何途径给肾上腺素后会产生一过性药物反应(肾上腺机能亢进症状,包括苍白,震颤,焦虑,心悸,头晕,头痛等),说明已经达到治疗剂量。肾上腺素过量可出现严重副作用包括室性心律失常、高血压危象、肺水肿等,常发生在静脉注射时,如静脉注射过快,浓度过高(静脉推注一般1:10000即0.1 mg/mL,而肌注1:1000 即1 mg/mL)。
【肾上腺素无效(难治性过敏)怎么办?】
肾上腺素首先用药毫无疑问,但少数患者对肌注肾上腺素无反应或反应不足,对这些难治性低血压休克患者,应该边分析原因(表2),边作以下处理:
(1)取仰卧抬高下肢。
(2)积极静脉液体复苏,静脉弹丸注射晶体液20 ml/kg,恢复循环血容量是肾上腺素发挥疗效的前提。
(3)药物升压和器械升压。
常用升压药包括去甲肾上腺素、多巴胺、多巴酚丁胺、去氧肾上腺素和加压素,尚无临床试验比较孰优孰劣。无标准剂量,根据临床反应调节剂量,并严密监测血压、心率、心脏功能和氧合情况。剂量过大、检测不到位可能出现室性心律失常、高血压危象和肺水肿等致死性严重不良事件[1]。
此外,我们有使用主动脉球囊反博 (IABP)抢救成功的案例[26, 27],也有体外膜式氧合联合IABP的个案[28, 29]。
(4)吸氧,做好气管插管和心肺复苏准备。
气管插管:患者常有咽喉部和气管粘膜水肿,甚至大量黏液遮蔽上气道解剖标志,气管插管有一定难度,最好请有经验的医生操作。
在气管插管前预吸氧3~4分钟有一定帮助。
▽表2 肾上腺素无效(难治性过敏)原因

ACS:急性冠状动脉综合征;ACEI:血管紧张素转化酶抑制剂
【心血管疾病和过敏反应的相互作用】
心血管疾病和过敏反应存在复杂的相互作用。
(1)心血管疾病(CVD)增加严重或致命的过敏反应的发生风险;一些心血管药物包括β受体阻滞剂和ACEI也可加重过敏反应,并使过敏反应难治化。
(2)过敏反应时,心脏的肥大细胞释放组胺、白三烯、血小板活化因子(PAF)等介质,继而诱发冠脉痉挛和急性心肌梗死(Kounis综合征)[30]。
(3)抢救用药如肾上腺素等有显著的心血管效应和导致室性心律失常、高血压危象、ACS等潜在风险。但当过敏反应成为主要矛盾时,应该牢牢记住,肾上腺素的使用无绝对禁忌证[3]。
【含碘造影剂过敏的相关因素】
一般认为,造影剂过敏是体质问题。目前研究认为与以下因素也有一定关联。
1、造影剂属性。
碘为机体自然组分,含碘造影剂过敏并非碘过敏[31],因此与碘造影剂的种类有关。有人认为,越低渗,过敏反应越少。也与碘造影剂多次使用有关,Fujiwara N等[32]回顾性分析了1729例肝癌患者反复造影剂使用次数与过敏反应呈U型曲线关系,但由于其造影次数甚多,在心血管领域参考意义较小。
2、患者属性。
使用β受体阻滞剂和ACEI的患者静脉造影后,不仅过敏反应的发生风险增加,而且病情更加严重[33], 一旦发生过敏性休克,预后极差,常常是致命的[34]。女性更容易发生静脉造影剂过敏,且反应更加严重[35]。
【超敏、过敏、变态反应的区别】
△图3 超敏、过敏、变态反应的区别[36]
尽管过敏反应和变态反应是同义词,均指Ⅰ型超敏反应,但一般用法上,过敏反应往往指急性、有潜在致命风险的变态反应,如过敏性休克翻译为anaphylactic shock,而不是allergic shock。造影剂过敏无疑符合anaphylaxis的本意,尽管临床上无法区分过敏反应(IgE介导)或过敏样反应(非IgE介导的)。
【小结】
对造影剂过敏反应而言,肌注肾上腺素是一线治疗,激素只是二线治疗。对过敏性休克而言,肾上腺素是一线治疗,大量补液基础上升压是二线治疗;激素仅仅是三线治疗!
【参考文献】
1. Simons F E, Ardusso L R, Bilo M B, et al. World allergy organization guidelines for the assessment and management of anaphylaxis. World Allergy Organ J, 2011, 4: 13-37.
2. Muraro A, Roberts G, Worm M, et al. Anaphylaxis: guidelines from the European Academy of Allergy and Clinical Immunology. Allergy, 2014, 69: 1026-1045.
3. Lieberman P, Simons F E. Anaphylaxis and cardiovascular disease: therapeutic dilemmas. Clin Exp Allergy, 2015.
4. Pumphrey R S. Lessons for management of anaphylaxis from a study of fatal reactions. Clin Exp Allergy, 2000, 30: 1144-1150.
5. Dudley L S, Mansour M I, Merlin M A. Epinephrine for anaphylaxis: underutilized and unavailable. West J Emerg Med, 2015, 16: 385-387.
6. Choo K J, Simons F E, Sheikh A. Glucocorticoids for the treatment of anaphylaxis. Cochrane Database Syst Rev, 2010: CD007596.
7. Tramer M R, von Elm E, Loubeyre P, et al. Pharmacological prevention of serious anaphylactic reactions due to iodinated contrast media: systematic review. BMJ, 2006, 333: 675.
8. Gaeta T J, Clark S, Pelletier A J, et al. National study of US emergency department visits for acute allergic reactions, 1993 to 2004. Ann Allergy Asthma Immunol, 2007, 98: 360-365.
9. Brown S G, Mullins R J, Gold M S. Anaphylaxis: diagnosis and management. Med J Aust, 2006, 185: 283-289.
10. Sheikh A, Ten Broek V, Brown S G, et al. H1-antihistamines for the treatment of anaphylaxis: Cochrane systematic review. Allergy, 2007, 62: 830-837.
11. Fineman S M. Optimal treatment of anaphylaxis: antihistamines versus epinephrine. Postgrad Med, 2014, 126: 73-81.
12. Simons F E. Advances in H1-antihistamines. N Engl J Med, 2004, 351: 2203-2217.
13. Sampson H A, Munoz-Furlong A, Campbell R L, et al. Second symposium on the definition and management of anaphylaxis: summary report--Second National Institute of Allergy and Infectious Disease/Food Allergy and Anaphylaxis Network symposium. J Allergy Clin Immunol, 2006, 117: 391-397.
14. Foti C, Cassano N, Panebianco R, et al. Hypersensitivity reaction to ranitidine: description of a case and review of the literature. Immunopharmacol Immunotoxicol, 2009, 31: 414-416.
15. Lin R Y, Curry A, Pesola G R, et al. Improved outcomes in patients with acute allergic syndromes who are treated with combined H1 and H2 antagonists. Ann Emerg Med, 2000, 36: 462-468.
16. Runge J W, Martinez J C, Caravati E M, et al. Histamine antagonists in the treatment of acute allergic reactions. Ann Emerg Med, 1992, 21: 237-242.
17. Ko B S, Kim J Y, Seo D W, et al. Should adrenaline be used in patients with hemodynamically stable anaphylaxis? Incident case control study nested within a retrospective cohort study. Sci Rep, 2016, 6: 20168.
18. Pumphrey R. Anaphylaxis: can we tell who is at risk of a fatal reaction? Curr Opin Allergy Clin Immunol, 2004, 4: 285-290.
19. Ellis A K, Day J H. Diagnosis and management of anaphylaxis. CMAJ, 2003, 169: 307-311.
20. Brown S G. Clinical features and severity grading of anaphylaxis. J Allergy Clin Immunol, 2004, 114: 371-376.
21. Terr A I. Anaphylaxis. Clin Rev Allergy, 1985, 3: 3-23.
22. Mostmans Y, Grosber M, Blykers M, et al. Adrenaline in anaphylaxis treatment and self-administration: experience from an inner city emergency department. Allergy, 2017, 72: 492-497.
23. Posner L S, Camargo C A, Jr. Update on the usage and safety of epinephrine auto-injectors, 2017. Drug Healthc Patient Saf, 2017, 9: 9-18.
24. Simons F E, Gu X, Simons K J. Epinephrine absorption in adults: intramuscular versus subcutaneous injection. J Allergy Clin Immunol, 2001, 108: 871-873.
25. Kanwar M, Irvin C B, Frank J J, et al. Confusion about epinephrine dosing leading to iatrogenic overdose: a life-threatening problem with a potential solution. Ann Emerg Med, 2010, 55: 341-344.
26. Alam R, Anantharaman R. Use of IABP in contrast media-induced anaphylactic shock: the ultimate lifesaver. BMJ Case Rep, 2013, 2013.
27. Yeguiayan J M, Ravisy J, Lenfant F, et al. Anaphylactic shock: the advantages of intra aortic balloon counter pulsation for the treatment of heart failure. Resuscitation, 2007, 72: 493-495.
28. Zhang Z P, Su X, Liu C W. Cardiac arrest with anaphylactic shock: a successful resuscitation using extracorporeal membrane oxygenation. Am J Emerg Med, 2015, 33: 130 e133-134.
29. Sugiura A, Nakayama T, Takahara M, et al. Combined use of ECMO and hemodialysis in the case of contrast-induced biphasic anaphylactic shock. Am J Emerg Med, 2016, 34: 1919 e1911-1912.
30. Triggiani M, Patella V, Staiano R I, et al. Allergy and the cardiovascular system. Clin Exp Immunol, 2008, 153 Suppl 1: 7-11.
31. Scherer K, Harr T, Bach S, et al. The role of iodine in hypersensitivity reactions to radio contrast media. Clin Exp Allergy, 2010, 40: 468-475.
32. Fujiwara N, Tateishi R, Akahane M, et al. Changes in risk of immediate adverse reactions to iodinated contrast media by repeated administrations in patients with hepatocellular carcinoma. PLoS One, 2013, 8: e76018.
33. Lang D M, Alpern M B, Visintainer P F, et al. Increased risk for anaphylactoid reaction from contrast media in patients on beta-adrenergic blockers or with asthma. Ann Intern Med, 1991, 115: 270-276.
34. Laxenaire M C, Torrens J, Moneret-Vautrin D A. [Fatal anaphylactic shock in a patient treated with beta-blockers]. Ann Fr Anesth Reanim, 1984, 3: 453-455.
35. Lang D M, Alpern M B, Visintainer P F, et al. Gender risk for anaphylactoid reaction to radiographic contrast media. J Allergy Clin Immunol, 1995, 95: 813-817.
36. 杏树林官方微博. 超敏、变态、过敏,是一回事儿吗?, 2016.
《中国医学论坛报》策划制作,谢绝转载

查看更多