查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






余一祎 教授
复旦大学附属中山医院肿瘤内科副主任医师
复旦大学附属中山医院肿瘤早期研究病房质控秘书
CSCO青年委员会委员
中国老年学和老年医学学会肿瘤康复分会常委
中国抗癌协会肿瘤大数据与真实世界研究青委会委员
上海市抗癌协会肿瘤药物临床研究专委会委员
上海市药学会药物治疗专委会委员
医院免疫治疗不良反应MDT、胃癌MDT、肠癌MDT、胆道MDT等多学科综合诊治团队核心成员
参加国际、国内80余项大型临床试验

IF:49.962(2021)
Published Online First December 15, 2021
PD-1和HER2双重抑制治疗HER2阳性胃癌的KEYNOTE-811试验
【背景】大约20%的晚期胃或胃食管交界处腺癌会发生人表皮生长因子受体2(HER2,又称为ERBB2)扩增或过表达。十余年前,抗HER2抗体曲妥珠单抗联合化疗成为这类患者的标准一线疗法。尽管在化疗方案基础上联合抗程序性死亡1(PD-1)抗体帕博利珠单抗并未显著提高晚期HER2阴性胃癌的疗效,但在HER2阳性疾病中有其临床前及临床依据证实联合帕博利珠单抗或可带来获益。本研究给出了帕博利珠单抗联合曲妥珠单抗及化疗治疗不可切除或转移性HER2阳性胃或胃食管交界处腺癌的随机、双盲、安慰剂对照的Ⅲ期KEYNOTE-811研究预设的第一次中期分析结果(,NCT03615326)。
【方法】参与者按1:1的比例随机分组,分别接受200 mg剂量的帕博利珠单抗或安慰剂(生理盐水或葡萄糖)治疗,每3周静脉给药一次(Q3W,IV)。在总体队列中,所有参与者接受曲妥珠单抗,初始负荷剂量为8 mg/kg,之后剂量为6 mg/kg,Q3W,IV;顺铂(剂量为80 mg/m2,Q3W,IV)+5-氟尿嘧啶(剂量为800 mg/m2,每3周第1-5天,IV)或奥沙利铂(剂量为130 mg/m2,Q3W,IV)+卡培他滨(剂量为1000 mg/m2,每3周的第1-14天,口服,每日两次)。所有治疗持续长达35个周期(约2年)或直至疾病进展、出现不可耐受的毒副作用、研究者决定或参与者撤回知情同意。如果毒副作用明显由一种药物引起,则可单独停用该药物。在2018年10月5日至2020年6月17日期间,随机分组接受治疗的434例参与者(意向治疗人群)中,433例接受了至少一次研究方案治疗,217例被分配至帕博利珠单抗组,216例被分配至安慰剂组,并被纳入实际治疗人群中。有效性分析人群包括帕博利珠单抗组的133例和安慰剂组的131例受试者。中位(范围)研究随访时间(从随机分组至2020年6月17日数据截止),意向治疗人群为9.9(0.1-19.4)个月,有效性分析人群为12.0(8.5-19.4)个月。
【结果】研究观察到,在有效性分析人群中,根据实体瘤疗效评价标准(RECIST)1.1版,通过盲法、独立中心审查,帕博利珠单抗组的客观缓解率为74.4%(95% CI 66.2-81.6),安慰剂组的客观缓解率为51.9%(95% CI 43.0-60.7),这表明帕博利珠单抗组的客观缓解率提高了22.7%,且具有统计学显著性差异(95% CI,11.2-33.7;P=0.00006)。帕博利珠单抗组的缓解程度也较安慰剂组更深(目标病灶大小自基线变化的中位值为-65%对-49%;较基线缩小≥80%的人群比例,32.3%对14.8%)(图1),完全缓解率更高(11.3%对3.1%)(表1)。在应答者中,帕博利珠单抗组和安慰剂组分别有50.5%和44.1%的受试者至数据截止日期仍有持续应答。通过Kaplan-Meier评估,帕博利珠单抗组和安慰剂组分别有70.3%和61.4%应答者的应答时间至少为6个月,分别有58.4%和51.1%的应答者的应答时间至少为9个月。帕博利珠单抗组和安慰剂组的中位应答持续时间分别为10.6个月(范围,>1.1个月至>16.5个月)和9.5个月(范围,>1.4个月至>15.4个月)。
该研究中帕博利珠单抗组和安慰剂组的不良事件(AEs)发生率相似,3-5级AEs发生率分别为57.1%和57.4%;导致任一研究治疗终止的AEs发生率分别为24.4%和25.9%(表2)。两组最常见的AEs为腹泻(帕博利珠单抗组52.5%对安慰剂组44.4%)、恶心(48.8%对44.4%)和贫血(41.0%对44.0%)。
【结论】KEYNOTE-811研究中这些颇具前景的初步发现表明,帕博利珠单抗、曲妥珠单抗和化疗联合的治疗方案可能是HER2阳性胃或胃食管交界处腺癌一种变革性的治疗选择,并支持探索该联合治疗在早期疾病患者中的应用。
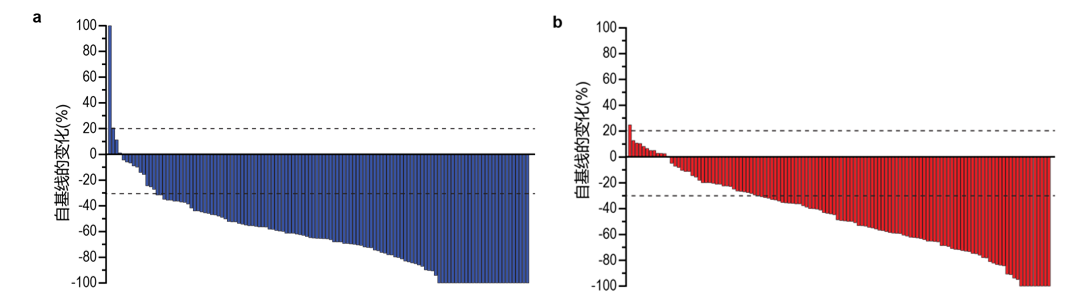
图1. 有效性分析人群中参与者靶病变大小自基线变化的最佳百分比
a,帕博利珠单抗组;b,安慰剂组。仅在基线时有RECIST可测量病灶和至少一项基线后可评估测量值的有效性分析人群参与者才能评估自基线的变化(帕博利珠单抗组 n=124,安慰剂组 n=122)。
两组治疗方案包括曲妥珠单抗和化疗。自基线增加超过100%则在100%截断。
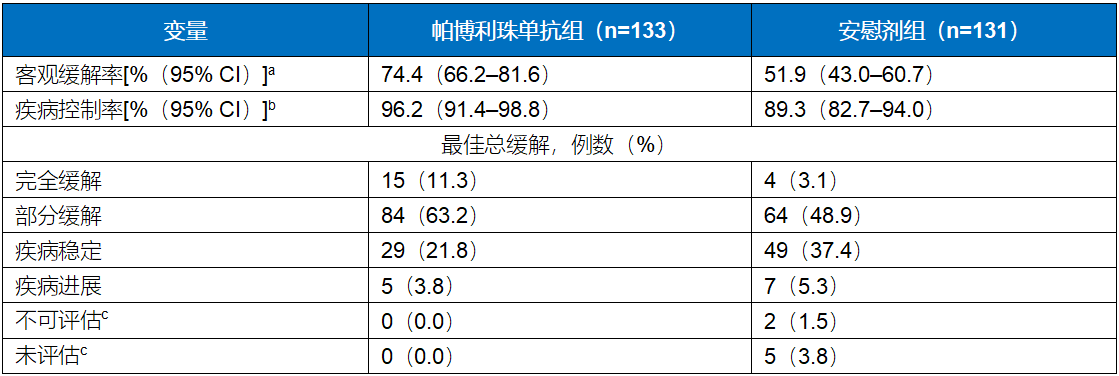
表1. 在有效性人群中确认的客观缓解总结
两组治疗方案包括曲妥珠单抗和化疗。
a客观缓解定义为具有完全或部分缓解的最佳缓解的参与者比例
帕博利珠单抗组和安慰剂组之间客观缓解的估计治疗差异为22.7%(95% CI 11.2-33.7;P=0.00006),这一数据使用Miettinen和Nurminen方法计算并按地域(澳大利亚、欧洲、以色列和北美对亚洲对全球其他地区)、PD-L1综合阳性评分(≥1对<1)及化疗选择(5-氟尿嘧啶+顺铂对卡培他滨+奥沙利铂)进行分层。
b疾病控制定义为具有完全缓解、部分缓解或疾病稳定的最佳缓解的参与者的比例
c不可评估的参与者是那些至少进行过一次基线后影像学评估的参与者,均无法根据RECIST v1.1评估缓解。
未评估的参与者包括未进行基线后影像学评估的参与者。
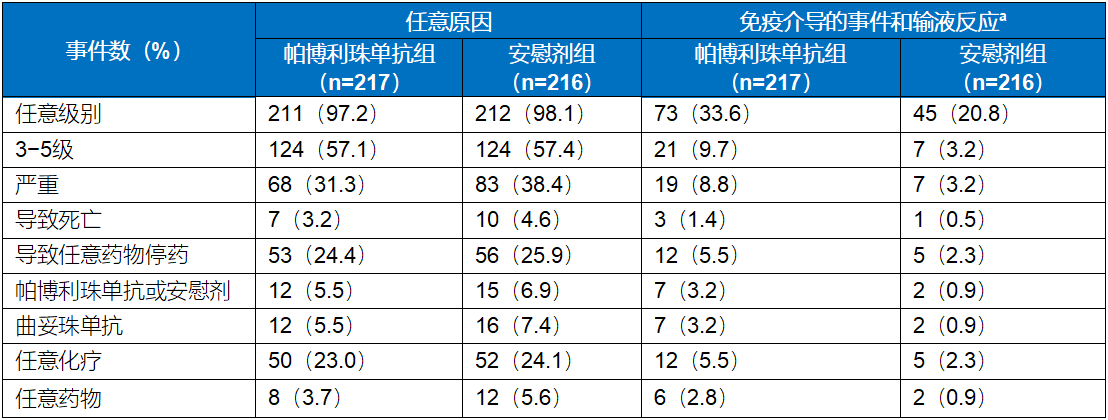
表2. 实际治疗人群的AEs总结
两组治疗方案包括曲妥珠单抗和化疗。
a无论研究者归因于研究治疗或免疫相关性,均需基于申办者提供的术语列表考虑免疫介导的原因和输液反应事件。
专家点评
对于HER2阳性晚期胃腺癌或者胃食管结合部腺癌的一线治疗来说,2010年的ToGA研究证实了抗HER2治疗的临床获益。然而在其后的10年中,其他的抗HER2治疗大型Ⅲ期临床研究却都以失败告终。研究者一直未放弃进一步的探索,进入免疫治疗时代后,临床前以及小样本临床研究证实免疫治疗与抗HER2治疗具有协同效应。基于此,KEYNOTE-811这一项大型随机对照Ⅲ期研究结果提供了充分的证据,帕博利珠单抗联合曲妥珠单抗和化疗将HER2阳性晚期胃腺癌的客观缓解率(ORR)提升至74.4%,并达到了更深的缓解程度,同时没有发生新的安全性事件。目前总生存数据尚不成熟,但可以预见免疫治疗联合抗HER2药物和化疗将是一个十分高效而且安全的治疗方案,将迅速改写HER2阳性胃癌一线治疗临床指南。此研究为HER2阳性胃癌患者全程治疗和临床结局带来了重大突破。其后抗HER2药物联合免疫治疗的临床研究(包括Margetuximab联合化疗、抗PD-1单抗、抗PD-1-LAG3双抗,ADC药物联合PD-1单抗、ZW25联合PD-1单抗、KN026联合KN046等研究)都在如火如荼地进行中。

IF:13.751(2021)
Published Online First December 10, 2021
Andecaliximab联合纳武利尤单抗对比纳武利尤单抗单药治疗晚期胃癌的随机、开放标签、II期研究证实与生存相关的生物标志物
【背景】基质金属蛋白酶-9(MMP9)选择性地裂解有助于肿瘤生长和免疫抑制微环境的细胞外基质蛋白。本研究评估了一种MMP9抑制剂—andecaliximab(ADX)联合纳武利尤单抗(NIVO)治疗晚期胃癌的疗效。
【方法】此项II期、开放标签、随机多中心研究评估了ADX+NIVO对比NIVO在经治的转移性胃癌或胃食管交界处(GEJ)腺癌患者中的疗效、安全性以及药效动力学。主要终点是ORR。次要终点包括无进展生存期(PFS)、总生存期(OS)和AEs。此研究也探索了疗效结局与生物标志物之间的相关性。
【结果】144例患者被随机分组;141例接受了治疗,81%为白人,69%为男性,ADX+NIVO治疗组中位年龄为61岁,NIVO单药治疗组为62岁。ADX+NIVO组和NIVO单药治疗组的ORR分别为10%(95% CI 4-19)和7%(95% CI 2-16)(OR 1.5;95% CI 0.4-6.1;P=0.8)。增加ADX没有额外应答和生存获益。两个治疗组的AEs发生率相当;最常见AEs包括疲劳、食欲下降、恶心和呕吐。程序性细胞死亡配体1(PD-L1)、干扰素-γ(IFN)和肿瘤内CD8+细胞密度与应答或生存率无关。上皮-间充质基因特征是与生存期较短最相关的基因特征;高转化生长因子(TGF)-β纤维化评分与OS呈负相关(P=0.036)。比较长期(1年以上)和短期(1年以下)生存者的基线肿瘤基因表达分析结果显示GRB7与生存期超过1年相关。HER2阳性与生存期显著延长相关(P=0.0077)。中位肿瘤突变负荷(TMB)水平为2.01,TMB≥中位数的患者生存期显著更长(P=0.0025)且PFS显著改善(P=0.016)。基于TMB、TGF-β纤维化和HER2的分析模型,TMB是该患者群体中生存的主要驱动因素。
【结论】在经治的转移性胃癌或GEJ腺癌患者中,相较于NIVO单药治疗,ADX+NIVO联合治疗具有良好的安全性,但没有提高疗效。HER2阳性、高TMB或GRB7以及低TGF-β水平与预后改善相关。
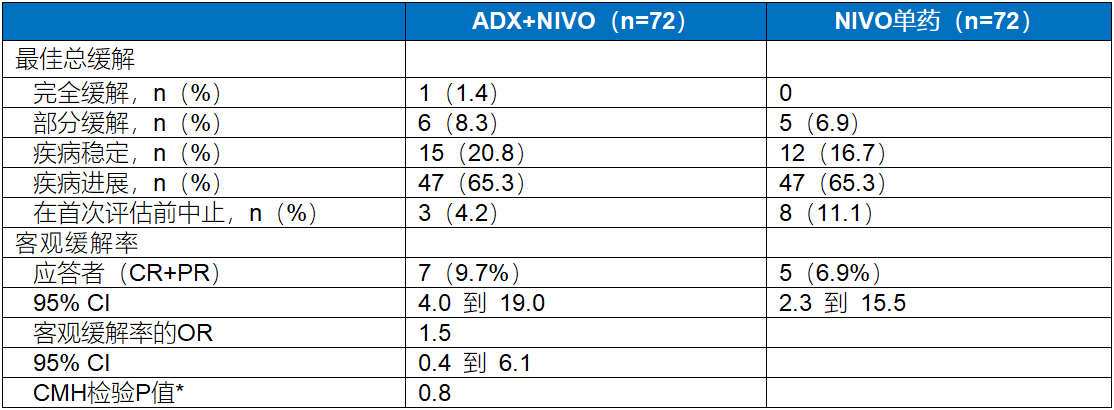
表3. 最佳总缓解
*P值 对比NIVO单药来自疾病控制率的CMH(Cochran-Mantel-Haenszel)检测,以及来自缓解持续时间的对数秩检验。
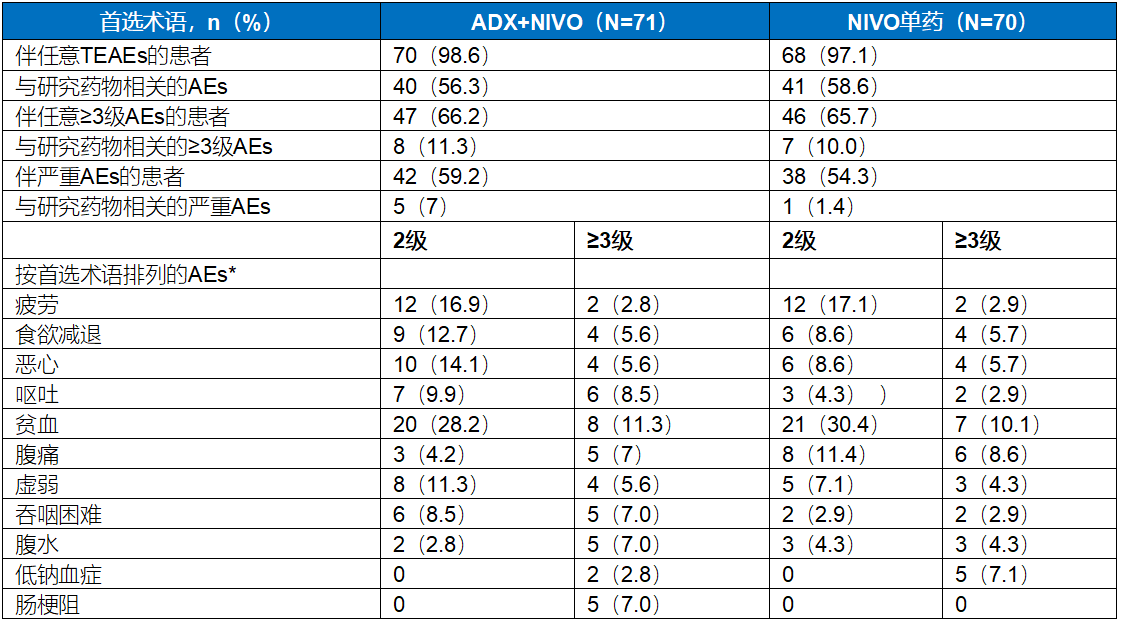
表4. AEs
*在任一治疗组,在≥10%的患者中观察到2级或2级以上TEAEs,或在≥5%的患者中观察到3级或3级以上TEAEs。TEAEs:治疗期不良事件。
临床研究证实晚期胃癌后线免疫检查点抑制剂单药治疗能够带来生存获益,药物也已经获批并得到指南推荐。但有效性以及中位生存期数据仍不如人意。研究者不断探索新的免疫机制以及联合用药方案。MMP9是在许多实体瘤中过表达的蛋白质,在胃癌中的表达量也十分高。它可以重塑细胞外基质,增加血管生成,同时还能增加髓样抑制细胞和调节性T细胞的募集。所以MMP9过度表达使免疫监视变得更加困难,影响免疫治疗疗效。基于此,MMP9抑制剂ADX联合NIVO治疗晚期胃癌的研究进入临床,然而该研究结果显示ADX+NIVO组ORR为10%,未观察到在NIVO基础上添加ADX有额外应答或生存获益。最终研究中探索性结果显示HER2阳性、高TMB或GRB7水平以及低TGF-β水平类型的肿瘤预后可能较好,该结果仍需在更精准人群中进一步研究。
参考文献
1、Janjigian YY,Kawazoe A,Yañez P,et al. The KEYNOTE-811 trial of dual PD-1 and HER2 blockade in HER2-positive gastric cancer. Nature. 2021 Dec;600(7890):727-730.
2、Shah MA,Cunningham D,Metges JP,et al. Randomized,open-label,phase 2 study of andecaliximab plus nivolumab versus nivolumab alone in advanced gastric cancer identifies biomarkers associated with survival. J Immunother Cancer. 2021 Dec;9(12):e003580.
胃肠癌免疫治疗学术前沿|解析精准医学时代胃肠肿瘤最新前沿进展
胃肠癌免疫治疗学术前沿|聚焦局晚期胃癌,看PD-1在特定人群中如何发挥精准诊疗
查看更多