查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者 北京大学肿瘤医院 王立军
本期分享的病例是一个直肠癌肝转移患者,除此之外,肝内合并多发血管瘤以及囊肿。当地化疗后评估缩小疾病稳定(SD)。就诊北京大学肿瘤医院后,通过精细的术前检查以及化疗前后的对比,鉴别肝转移、囊肿、血管瘤,并针对肝转移病灶进行手术,最终达到NED状态。
这个病例提示我们,针对肝转移的外科治疗,影像学评估非常关键,当然主管医生读片评估上也要做到细上加细。尤其是对于合并“好人[血管瘤,囊肿,肝脏局灶性结节增生(FNH)]”和“坏人(肝转移)”的患者,通常需要我们联合放射科、超声科的多维度评估,精准鉴别这些肝脏病灶的是是非非,才能使患者通过外科治疗达到一个最大的治疗获益。(仅供医疗卫生专业人士参考,患者信息已做隐私化处理)
病史简介
• xx,男, 37岁
• 病史:
患者2020年9月单位体检发现肝占位,行瘤标检查示 CEA:9.79 ng/ml,CA199:97.56 U/ml,外院行肠镜检查示距肛门15 cm可见一巨大结节样新生物,占据1/2肠腔,肠镜下活检病理示:腺癌。
腹部CT示肝内多发低密度结节、团块影,诊断为直肠癌伴同时性肝转移,于2020年9月行直肠癌低位前切除术,术后病理分期:pT4aN2a。
免疫组化:肿瘤细胞MLH(+), MSH2(+), MSH6(+), PMS2(+); Ki67 阳性率:70%。基因检测结果:KRAS/NRAS/BRAF野生型,PIK3CA突变。
患者术后于2020年10月~11月行FOLFOX联合西妥昔单抗治疗3周期,两周期评价肿瘤SD(缩小),当地评估肝内病灶较多,不可切除,遂继续化疗。
患者带来了当地的肝脏MRI胶片检查及报告,如下图。

这是我们临床实践中非常常见的一种情形。
目前,结直肠癌肝转移的患者,完整切除结直肠原发灶及肝转移灶,5年生存率可达到40%~50%,另有约20%~25%的患者甚至获得了治愈;而单纯姑息化疗5年生存率不足10%。所以,最大限度地追求手术治疗机会,才可能给患者带来更好的生存。该患者的选择无可厚非。
患者的外院报告中有转移瘤、有血管瘤、有囊肿,多种病灶糅合在一起,有良性有恶性;究竟哪个是转移瘤、哪个是血管瘤或囊肿?报告没法给我们确切的答案。当然在繁杂的临床工作中去描述每一份报告中的每一个结节也不现实。但这对于手术医生至关重要!所以再难,我们也要对每一个病灶进行定性,同时对每一个病灶定位并预估切除的范围!
但问题来了,患者带来的是胶片,能鉴别吗?该怎么办?答案是:胶片提供的信息可能不够。所以我们果断地让其返回当地刻录初始MRI影像,与本院化疗后的影像进行对比。
• 通过仔细对治疗前后肝内病灶的对比,结果显而易见。下图中红色箭头标记的即为肝转移瘤,治疗后肿瘤明细缩小。
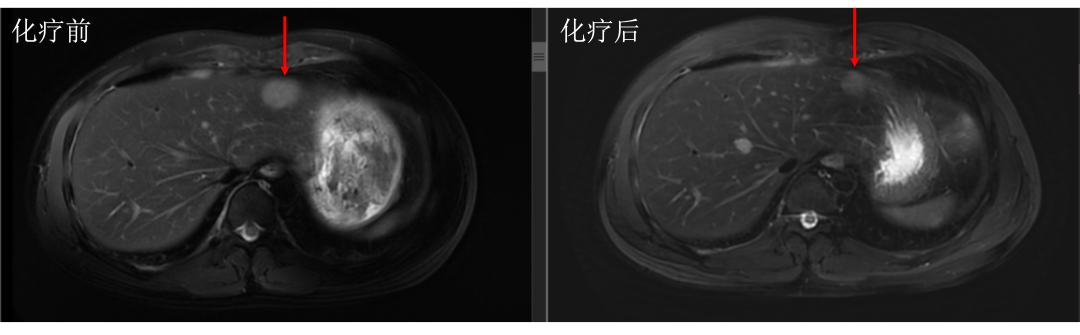
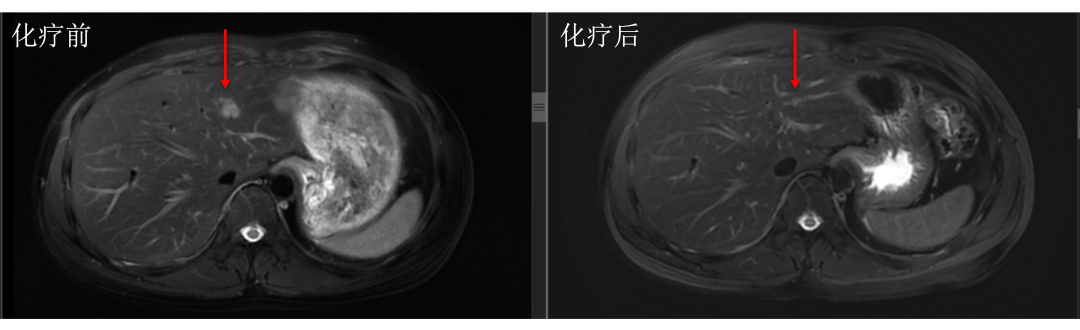
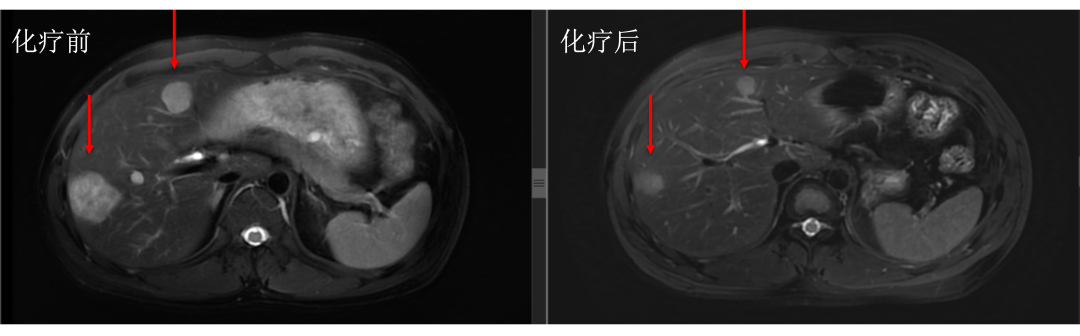
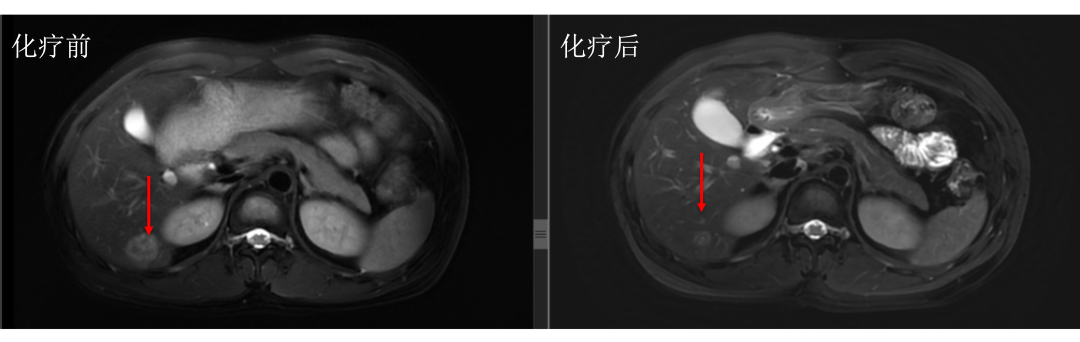
• 而治疗前后没有变化的就是肝囊肿或血管瘤,下图中蓝色箭头标记。
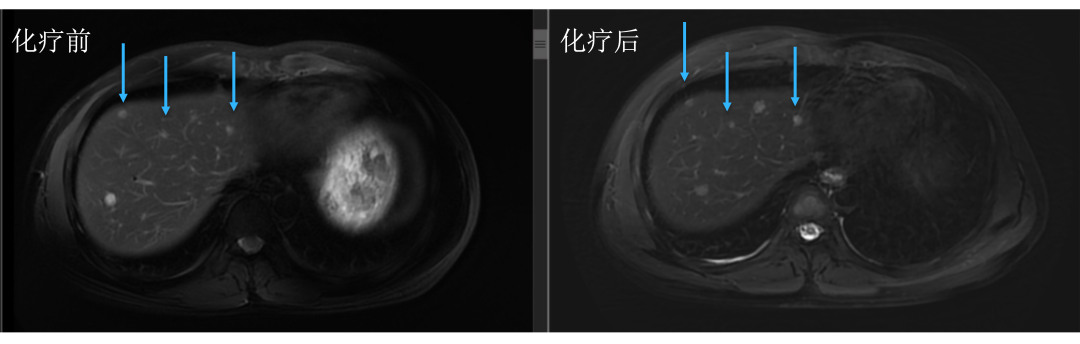

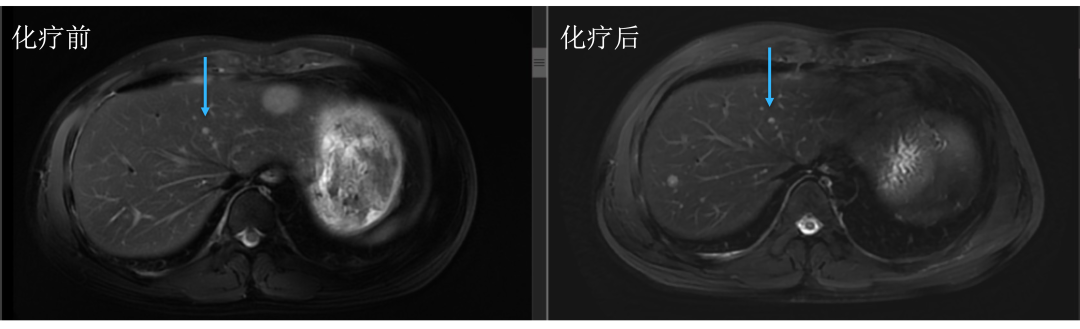
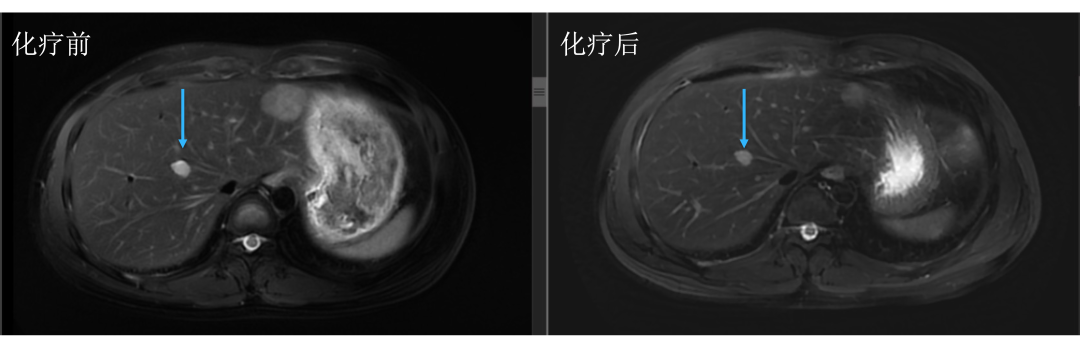
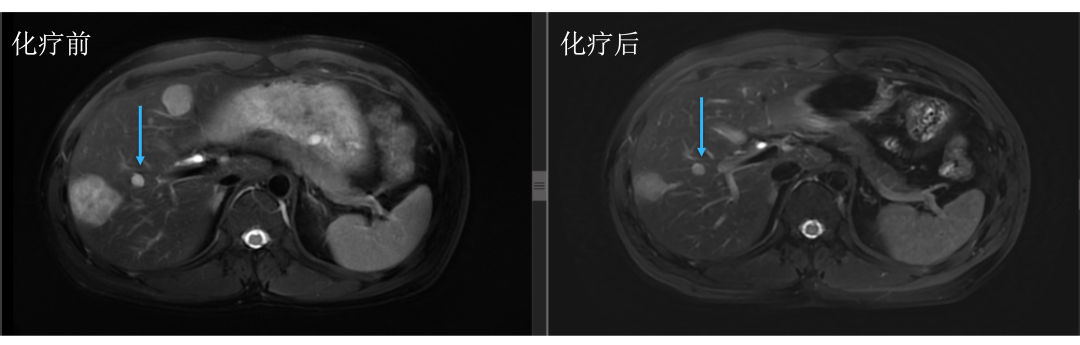
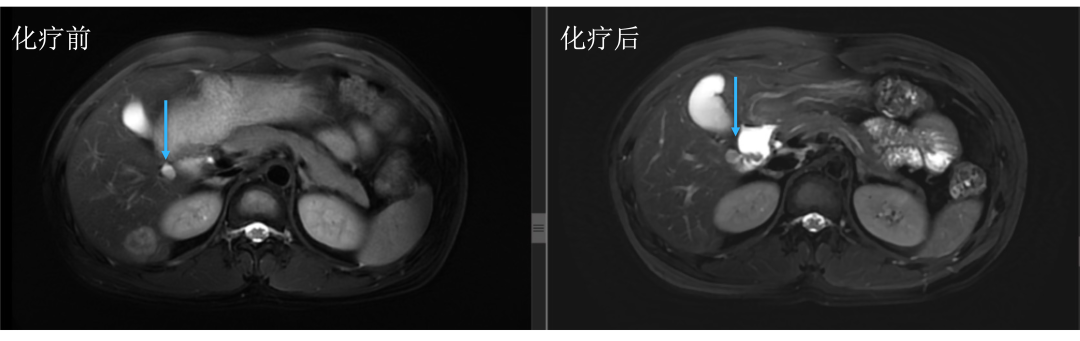
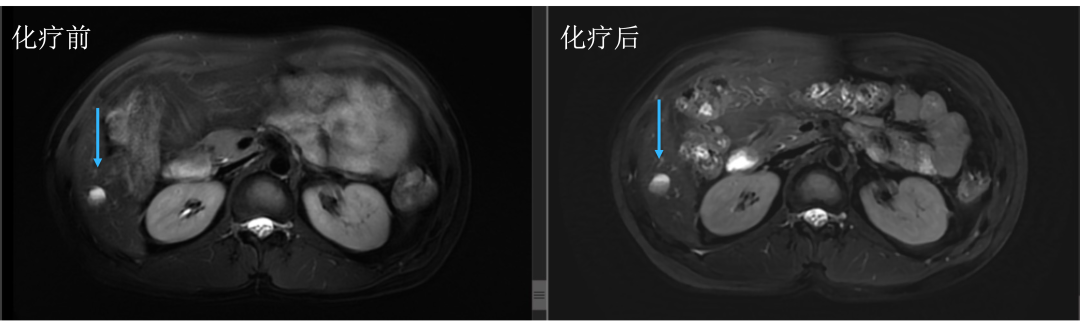
• 评估后只有5个病灶,对于我们来讲手术难度就大大降低了,患者顺利地进行了手术治疗,患者术后继续完成辅助化疗,目前仍无复发生存中。
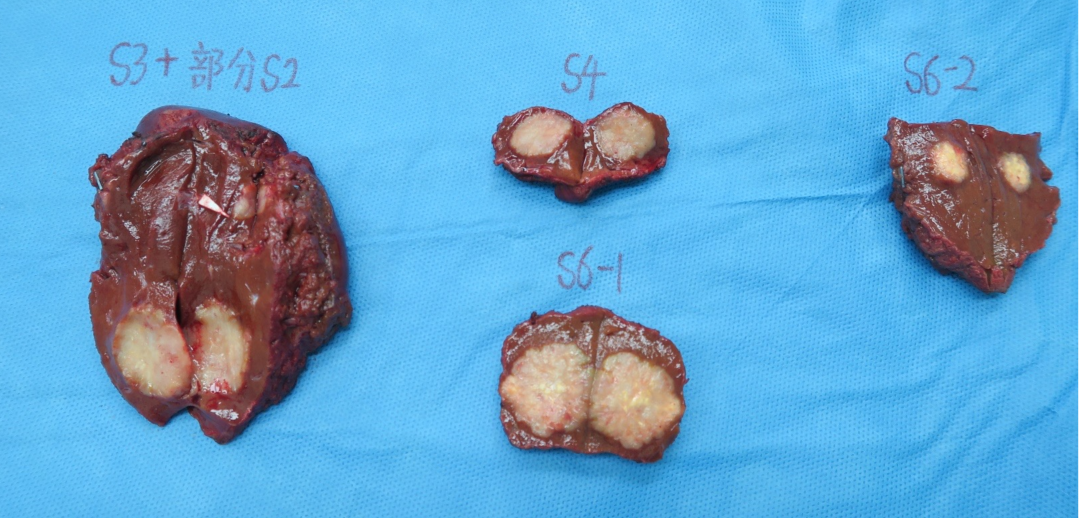
治疗体会
肝转移瘤处理应避免遗漏,否则手术的根治性会打折扣;肝囊肿和血管瘤是良性的,绝大多数不需要治疗,因此要避免过度治疗。对于肿瘤的鉴别至关重要,对于不典型的病灶(如不典型血管瘤、治疗后的肝转移以及1cm以下的结节),有时候即使是最有经验的影像科医生鉴别起来也存在困难。此时需要我们使用普美显核磁,以及在手术中联合使用超声以及超声造影检查,进一步确认。当然如果病灶就是非常难区分,并且病灶深在无法简单处理,可以术后密切观察。有问题联合补救局部治疗。
患者就诊时多数带来的是胶片,所提供的序列相对有限,另外对于每一个病灶的直径测量存在困难的。所以,最重要的是将患者治疗前、后的影像片子导入一个标准化平台,在同一屋檐下,肿瘤才可能显露出其“庐山真面目”。尽管这样会花费主管医生大量时间,但是也只有这样才能做到每一个患者得到最为精准的评估和外科治疗。
对肿瘤患者的关爱不仅包括语言的态度上的关心,更重要的是专业上的判断和“爱伤观念”:不仅要治病、还要尽量避免额外的创伤。如果你拿不准的病灶,那就交给时间吧。
北京大学肿瘤医院肝胆外一 平台发布
查看更多