查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





帕金森病作为一种常见的中老年神经系统退行性疾病,随着全球人口老龄化,患病率逐年升高,给患者和社会都带来了巨大的负担。基础研究和临床一直致力于帕金森病的机制探索和新药研发,旨在实现更有效的治疗。
2023年国际帕金森病与运动障碍大会(MDS)近日于丹麦哥本哈根举行。会议围绕帕金森病未满足需求、发病机制、临床症状管理、未来治疗方向进行了广泛讨论,我们结合相关精华内容进行总结,以飨读者。

吴云成 教授
上海交通大学医学院附属第一人民医院
主任医师、教授、博士生导师
上海交通大学医学院附属第一人民医院神经内科主任,神经病学教研室主任
国际神经病学联盟帕金森病及相关疾病协会(IAPRD) 委员
中华医学会神经病学分会帕金森病及运动障碍疾病学组委员
中华医学会神经病学分会神经调控协作组委员
中国医师协会神经内科医师分会委员&睡眠学组委员
中国卒中学会理事&重症脑血管病分会&脑小血管病分会委员
中国研究型医院学会脑血管病学专委会常务委员
中国康复学会睡眠专委会常务委员
上海市中西医结合学会神经内分泌专委会副主任委员
上海市中西医结合学会眩晕病专委会副主委委员
先后主持6项国家自然科学基金及上海市科委重大项目、科技部973项目、中国脑计划等项目子课题;发表SCI论文53篇,其中以第一/通讯作者在Arch Neurol、Hum Mol Genet、Parkinsonism Relat Disord、Atherosclerosis、Neurobiol Aging等专业期刊发表45篇SCI论文;担任Front Aging Neurosci, BMC Neurol, Clin Parkinsonism Relat Disord、中国卒中杂志等专业期刊编委
临床擅长:帕金森病和运动障碍、不宁腿综合征和睡眠障碍,老年性痴呆和记忆障碍、脑血管病等临床诊治
帕金森病患病率逐年升高,负担沉重
2019全球疾病负担研究显示, 2019年全球帕金森病(PD)患病人数高达851.102万,较1990年增长155.5%,且患病率呈逐年升高趋势1。2023年MDS大会的一则报告亦显示,近年来存活超过20年的PD病例比例显著增加,存活少于10年的病例数量则显著减少2。
因而为了满足日益增加的医疗服务需求,深入研究PD发病机制以寻找更为有效的治疗手段至关重要。
目前认为,帕金森病是由环境因素和遗传变异共同作用引起的。环境因素包括线粒体毒物、农药暴露、创伤性脑损伤和衰老;遗传因素则可能与SCNA、LRRK2、VPS35、GBA等基因突变相关3。MDS会议报告指出帕金森病相关遗传因素通过三个主要相互关联的细胞通路(囊泡运输、溶酶体功能、线粒体维持)在PD发病机制中发挥作用,且均与α-突触核蛋白(α-syn)有关(图1)4。此外,有学者提出α-突触核蛋白p.V15A变体会导致α-syn聚集增加,携带该变体的PD患者疾病进展更为迅速5。

图1.帕金森病的潜在发病机制4
除了机制方面的探索,本次MDS大会还着眼于帕金森病治疗的现状,强调对PD症状临床管理的进一步关注。
帕金森病症状临床管理:全面综合治疗
2023年发表在Journal of Parkinson’s Disease杂志的一项综述报道,截至2023年1月1日,正在进行的139项PD相关临床试验仍以对症治疗为主(55%)6。
帕金森病的临床症状表现复杂,通常在出现运动症状后确诊。在确诊之前,可能有几年甚至几十年的前驱期,以非运动症状为特征。整个病程中都会有这两类症状,共同导致PD的进行性残疾(图2)7。因此,治疗帕金森病时应对运动症状和非运动症状采取全面综合治疗8。

图2.与帕金森病进展相关的临床症状7
Regina Katzenschlager博士在MDS大会上分享了PD运动症状的管理策略。根据2018年MDS运动症状治疗指南,在早期对症治疗的药物中,左旋多巴类药物、非麦角类多巴胺受体激动剂(DAs)、MAO-B抑制剂和抗胆碱能药均被证明临床有效9。
然而,随着帕金森病进展以及左旋多巴类药物的长期使用,PD患者可能出现运动并发症,给临床带来棘手的难题8。因此,在治疗早期和进展期PD患者运动症状的同时,还应考虑预防/延缓运动并发症的发生10。既往研究表明,对多巴胺受体产生较少脉冲性刺激的长效药物可以延迟运动并发症的出现11。
到了PD中晚期,患者普遍出现运动并发症,严重影响生活质量。此时可通过提供持续性多巴胺能刺激的药物或手段对运动并发症进行治疗,调整服药次数、剂量或添加药物亦可能改善症状8。
总而言之,PD运动症状治疗的起始药物选择需要强调患者的个性化特点,综合考虑所用药物的安全性、快速改善运动症状或推迟运动并发症的迫切性、联合用药方案等因素。在整个病程中也需要及时根据个体情况进行调整,以患者的目标和选择为中心10。
一项回顾性研究发现,几乎所有的PD患者(99.7%)都存在非运动症状,从疾病早期开始就被患者高度关注12,13。其中,抑郁症状(56.4%)和睡眠障碍(86.5%)是常见的非运动症状12。MDS大会报告指出,抑郁症状在PD整个病程中持续存在,可能与运动症状、睡眠、焦虑、认知功能等症状相互影响,造成更严重的生活质量下降(图3)14。
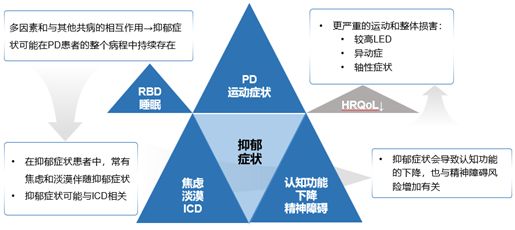
图3.帕金森病抑郁症状的临床影响14。LED,左旋多巴等效剂量;RBD,快速眼球运动睡眠期行为障碍;ICD,冲动控制障碍;HRQoL,健康相关生活质量
对于PD抑郁症状的治疗,选择性5-羟色胺再摄取抑制剂(SSRIs)、5-羟色胺及去甲肾上腺素再摄取抑制剂(SNRIs)、三环类抗抑郁药(TCAs)药物显示出一定程度的疗效和良好的耐受性,而多巴胺能药物中仅有普拉克索可改善PD抑郁症状(图4)15。普拉克索作为一种非麦角类多巴胺受体激动剂,可直接作用于D3受体,改善PD抑郁症状,是目前唯一获得国内外指南推荐的可有效改善PD抑郁症状的抗PD药物16,17,18,19,20。
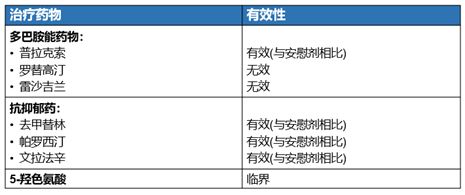
图4.帕金森病抑郁症状的药物治疗15
既往一项多中心、横断面研究显示,抑郁症状是导致PD睡眠障碍的重要因素21。PD睡眠障碍主要包括失眠、快速眼球运动期睡眠行为异常(RBD)、白天过度嗜睡(EDS)和不宁腿综合征8。根据中国PD患者睡眠障碍管理建议,多巴胺受体激动剂(普拉克索、罗匹尼罗、罗替高汀)可用于治疗PD伴失眠(图5)22。
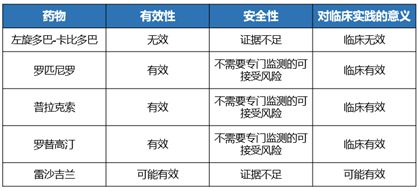
图5.帕金森病伴失眠的药物治疗22
目前,PD的临床治疗仍旧存在许多未满足的需求,本次MDS大会还放眼未来,探讨了PD治疗的新靶点、新药物。
抗PD药物的未来之路
相较于2022年,2023年与疾病修饰疗法相关的临床试验比例(45%)增加,对于疾病修饰疗法的药物研发仍在不断探索中6,23。疾病修饰治疗是通过对神经元保护、再生以及替代等作用机制,在改善临床症状的同时,达到减缓疾病临床进程、最终减少致残的目的24。
目前正在进行试验的疾病修饰疗法主要是针对胰高血糖素样肽-1(GLP-1),靶向α-突触核蛋白,葡糖脑苷脂酶基因(GBA), 富亮氨酸重复激酶2(LRRK2)等靶点以及细胞治疗、抗氧化剂等治疗手段(图6)6。研究表明GBA突变加速了PD患者认知能力的下降。此次MDS大会亦披露了首次在帕金森病中进行的临床概念验证试验结果,结果显示抗α-Syn抗体可预防GBA-PD认知功能减退25。同时,MDS大会报道了一种具有前景的PD新型免疫疗法——Glunomab,可通过抑制组织型纤溶酶原激活剂(tPA)诱导的神经炎症来预防神经变性,从而改善PD运动症状26。
期待此类新型疗法能够为帕金森病患者打开新的治疗篇章。

图6.帕金森病的新兴治疗靶点6
帕金森病患病率逐年升高,使得医疗服务体系面临严峻挑战。目前,PD的临床管理强调针对患者的个性化特点,对运动症状和非运动症状采取全面综合治疗。路漫漫其修远兮,帕金森病的治疗仍存在许多未满足的需求,开发能够延缓甚至阻止帕金森病进展的药物是临床的迫切需求和研发热点,期待未来能够出现更为有效的治疗选择,为患者带来获益。
参考文献:
1. Ou Z, et al. Global Trends in the Incidence, Prevalence, and Years Lived With Disability of Parkinson's Disease in 204 Countries/Territories From 1990 to 2019. Front Public Health. 2021 Dec 7;9:776847.
2. Noyes E, et al. 2023MDS Poster#639.
3. Vázquez-Vélez GE, Zoghbi HY. Parkinson's Disease Genetics and Pathophysiology. Annu Rev Neurosci. 2021 Jul 8;44:87-108.
4. Shinji Saiki. 2023 MDS session#2405.
5. Diaw S, et al. 2023MDS Poster#1464.
6. McFarthing K, et al. Parkinson's Disease Drug Therapies in the Clinical Trial Pipeline: 2023 Update. J Parkinsons Dis. 2023;13(4):427-439.
7. Poewe W, et al. Parkinson disease. Nat Rev Dis Primers. 2017 Mar 23;3:17013.
8. 中华医学会神经病学分会帕金森病及运动障碍学组,等. 中国帕金森病治疗指南(第四版)[J]. 中华神经科杂志,2020,53(12):973-986.
9. Fox SH, et al. International Parkinson and movement disorder society evidence-based medicine review: Update on treatments for the motor symptoms of Parkinson's disease. Mov Disord. 2018 Aug;33(8):1248-1266.
10. Regina Katzenschlager. 2023MDS session#1101.
11. Olanow CW, et al. Continuous dopamine-receptor treatment of Parkinson's disease: scientific rationale and clinical implications. Lancet Neurol. 2006 Aug;5(8):677-87.
12. Rodriguez-Blazquez C, et al. Prevalence of Non-Motor Symptoms and Non-Motor Fluctuations in Parkinson's Disease Using the MDS-NMS. Mov Disord Clin Pract. 2020 Dec 21;8(2):231-239.
13. Port RJ, et al. People with Parkinson's Disease: What Symptoms Do They Most Want to Improve and How Does This Change with Disease Duration? J Parkinsons Dis. 2021;11(2):715-724.
14. Jee-Young Lee. 2023 MDS session#1102.
15. Weintraub D, et al. Management of psychiatric and cognitive complications in Parkinson's disease. BMJ. 2022 Oct 24;379:e068718.
16. Wei SZ, et al. Brain Res Bull. Pramipexole regulates depression-like behavior via dopamine D3 receptor in a mouse model of Parkinson's disease. 2021 Dec;177:363-372.
17. Ferreira JJ, et al. Summary of the recommendations of the EFNS/MDS-ES review on therapeutic management of Parkinson's disease. Eur J Neurol. 2013 Jan; 20(1): 5-15.
18. Seppi K, et al. The Movement Disorder Society Evidence-Based Medicine Review Update: Treatments for the Motor Symptoms of Parkinson’s Disease. Movement Disorders .2011;26(S3):S42-S80.
19. Klaus Seppi MD, et al. Update on Treatments for Nonmotor Symptoms of Parkinson’s Disease—An Evidence-Based Medicine Review. Mov Disord. 2019 Feb;34(2):180-198.
20. 中华医学会神经病学分会帕金森病及运动障碍学组. 帕金森病非运动症状管理专家共识(2020). 中华医学杂志. 2020,100(27): 8 (2084-2091).
21. Suzuki K, et al. Characteristics of sleep disturbances in Japanese patients with Parkinson's disease. A study using Parkinson's disease sleep scale. Mov Disord. 2007 Jul 15;22(9):1245-51.
22. Liu CF, et al. Management Recommendations on Sleep Disturbance of Patients with Parkinson's Disease. Chin Med J (Engl). 2018 Dec 20;131(24):2976-2985.
23. McFarthing K, et al. Parkinson's Disease Drug Therapies in the Clinical Trial Pipeline: 2022 Update. J Parkinsons Dis. 2022;12(4):1073-1082.
24. 中华医学会神经病学分会帕金森病及运动障碍学组,等. 中国帕金森病早期运动症状治疗循证医学指南[J]. 中国神经免疫学和神经病学杂志,2021,28(4):267-279.
25. Brockmann K, et al. 2023 MDS poster#32
26. Torrente D, et al. 2023MDS Poster#1359.
审批号:SC-CN-14610
有效期至:11/22/2024
仅供相关医药专业人士进行医学科学交流
↓↓↓
查看更多