查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2021年欧洲肿瘤内科学会(ESMO 2021)年会上,邢宝才教授团队发表了一项“KN046联合仑伐替尼治疗晚期不可切除或转移性肝细胞癌(HCC)的Ⅱ期临床研究”的研究结果,于2021年9月16日以壁报形式公布。
该研究是一项开放性的II期研究,目的是研究KN046联合仑伐替尼在晚期HCC受试者中的安全性和初步疗效[1]。设立安全性导入期,先入组6个受试者,接受KN046 5 mg/kg Q3W+仑伐替尼12 mg QD (BW ≥60 kg)或8 mg QD (BW <60 kg)治疗,6例受试者全部完成28天的剂量限制性毒性(DLT)观察期后,研究者将根据安全性数据,决定是否按原剂量继续入组。如果受试者不耐受(发生2例及以上DLT事件),考虑后续入组的受试者将接受KN046剂量为 5 mg/kg Q3W,仑伐替尼降低剂量为8 mg QD (BW≥60 kg)或4 mg QD (BW <60 kg)。研究的主要终点是安全性和研究者根据RECIST 1.1评估的ORR。
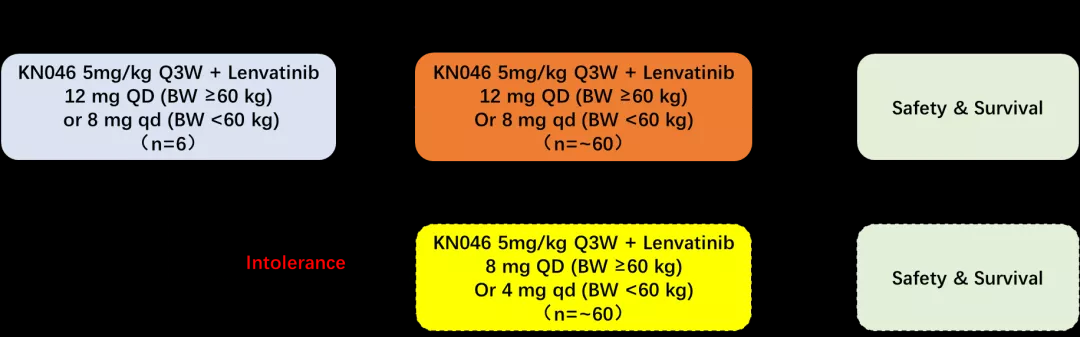
图1. 研究设计
邢宝才 教授
北京大学肿瘤医院
主任医师,博士生导师
肝胆胰外一科主任
中华外科学会肝脏外科学组 全国委员
中国医师协会结直肠肿瘤分会,肝转移委员会 主任委员
中国抗癌协会大肠癌专委会肝转移学组 副组长
中国医师协会外科分会MDT专委会 副主任委员
中国医促会肝脏外科分会 副主任委员
中国研究型医院协会肿瘤外科委员会 副主任委员
问题1:邢宝才教授,在介绍您的研究结果前,能请您介绍一下晚期肝癌治疗现状?
邢宝才教授:肝癌是亚洲最常见的恶性肿瘤之一,由于乙肝病毒的高感染率,中国的肝癌新发病例和死亡病例分别占全球近50%[2],在我国致死率高居恶性肿瘤第2位。总体上中国肝癌患者预后差,5年生存率只有12.1%,中晚期肝癌患者5年生存率不到5%。
2019年免疫联合靶向治疗在肝癌取得令人鼓舞的结果,阿替利珠单抗联合贝伐珠单抗显著提高了患者的无进展生存和总生存,根据最新的结果总生存延长到19.2个月[3],肝癌领域真正开启了系统性治疗的时代。虽然目前开展了各种不同的PD-1/PD-L1抑制剂联合抗血管治疗的研究,但免疫联合靶向药物的客观缓解率仍然偏低,ORR在30%-40%[3-6],肝癌患者期待着更有效的新的药物能够进一步提高目前的治疗效果。
问题2:您认为如何进一步提高晚期肝癌疗效?
邢宝才教授:局部治疗[如经动脉化学栓塞(TACE)、肝动脉持续灌注化疗 (HAIC)]仍然是中晚期肝癌的重要治疗方法。理论上,局部治疗可以增强免疫识别,进而提高免疫治疗的效果,同时局部治疗本身也有肿瘤杀伤作用,因此在PD-1/PD-L1抑制剂联合抗血管的基础上,联合局部治疗期望可进一步改善疗效。但是由于肝脏双血供的特殊性,HAIC需要长时间保留导管,操作和效果上都不太理想。另外,随着Checkmate 040试验的成功,我们也看到了PD-1/PD-L1抑制剂与CTLA-4等其他免疫检查点抑制剂联合的可能性,肝癌可能从联合免疫疗法获益。我们希望通过PD-L1/CTLA-4双特异性抗体KN046联合抗血管治疗使肿瘤降期成为可能,最终通过手术切除,实现患者长期无瘤生存的目标。
问题3. 那PD-L1/CTLA-4双特异性抗体联合抗血管生成药物的理论基础是什么呢?
邢宝才教授:HCC 是一种血管丰富的肿瘤,血管内皮生长因子(VEGF)在驱动异常血管生成、促进肿瘤扩散转移外,还被认为在癌症免疫逃避中发挥作用。双免治疗在促进免疫应答方面有协同作用,PD-1/PD-L1可以通过阻断抑制作用直接促进免疫应答,CTLA-4可以通过阻断免疫调节细胞(Treg)细胞的活化发挥效应。此外,免疫治疗还可以促进血管正常化和肿瘤微环境(TME)重塑[7]。因此,理论上,抗血管生成疗法与免疫疗法结合可以在血管正常化和免疫重构之间形成了一个正反馈回路,为临床实践中联合应用提供支持。
问题4. 您能具体介绍一下您的研究结果?
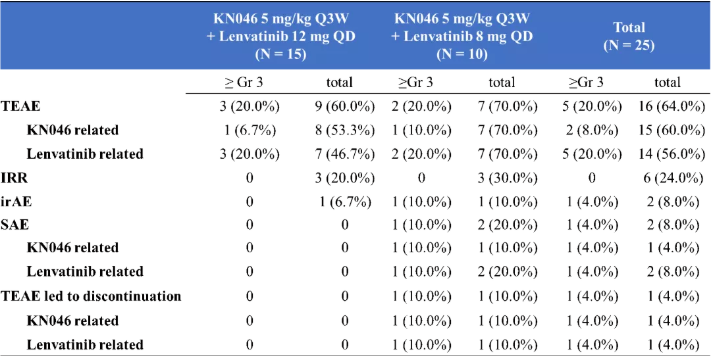
邢宝才教授:至截止日期,共入组25例患者,84%的患者为BCLC C期,中位治疗时长为10周。可肿瘤评估的患者21例,根据RECIST1.1标准,客观缓解率(ORR)为57%,疾病控制率(DCR)为95%。根据mRECIST标准,ORR和DCR则提高为76.2% 和 95%。安全性良好,没有DLT事件发生,与KN046相关的3级及以上的不良事件有1例间质性肺炎(4.0%)和1例血小板计数降低(4.0%)。
表1. 肿瘤疗效评估结果
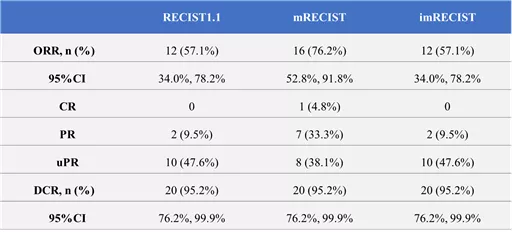
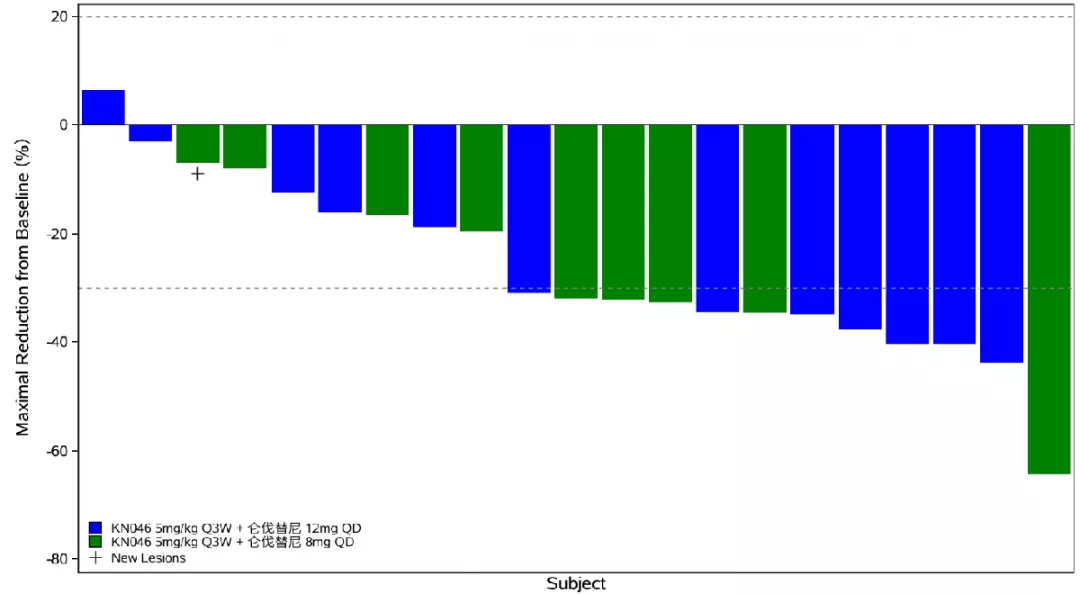
图2. 靶病灶长径之和自基线百分比变化
表2. 安全性分析
问题5. 您认为本研究对于临床实践的有何提示或改变?
邢宝才教授:KN046双抗联合仑伐替尼的单臂II 期研究的ORR突破50%,明显提高了肝癌免疫联合靶向治疗的有效率,显示了双免疫抗体治疗的优势,而且仑伐作为口服的TKI,与贝伐珠单抗相比,半衰期较短,用药的安全性管理更好,这也将为晚期肝癌患者提供更大的转化成功的机会,也将极大减少手术风险和并发症,使患者实现长期无瘤生存状态。因此,这一组合有望发展为晚期肝癌的新的治疗模式。
问题6. 能谈谈您对晚期肝癌系统治疗的未来展望?
邢宝才教授:中国大多数肝癌患者在首次诊断时已是中晚期,手术切除率低,复发率高。有效的系统治疗可减轻肿瘤负荷,为手术根治创造条件。免疫联合抗血管治疗模式在临床实践中非常常见,但ORR仍旧不能满意,因此,对于不能手术切除的HCC患者,通过双免/双抗联合抗血管治疗,或者辅以适当的局部治疗,能使更多的患者获得更高的ORR,转化为可手术患者的比例会在目前单纯免疫加靶向的基础上进一步增加,晚期肝癌经过系统治疗获得根治性手术机会也会增加,进而明显提高肝癌患者的整体5年的生存率。
1.B. Xing, et al. KN046 (an anti-PD-L1/CTLA-4 bispecific antibody) in combination with lenvatinib in the treatment for advanced unresectable or metastatic hepatocellular carcinoma (HCC): Preliminary efficacy and safety results of a prospective phase II trial. Annals of Oncology (2021) 32 (suppl_5): S818-S828. 10.1016/annonc/annonc677
2. Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021. 71(3): 209-249.
3. Richard S Finn, et al. Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. N Engl J
Med . 2020 May 14; 382(20): 1894-1905.
4. Finn RS, Ikeda M, Zhu AX, et al. Phase Ib Study of Lenvatinib Plus Pembrolizumab in Patients With Unresectable Hepatocellular Carcinoma. J Clin Oncol. 2020. 38(26): 2960-2970.
5. Xu J, Shen J, Gu S, et al. Camrelizumab in Combination with Apatinib in Patients with Advanced Hepatocellular Carcinoma (RESCUE): A Nonrandomized, Open-label, Phase II Trial. Clin Cancer Res. 2021. 27(4): 1003-1011.
6. Ren Z, Xu J, Bai Y, et al. Sintilimab plus a bevacizumab biosimilar (IBI305) versus sorafenib in unresectable hepatocellular carcinoma (ORIENT-32): a randomised, open-label, phase 2-3 study. Lancet Oncol. 2021. 22(7): 977-990.
7. Yu-Yang Lin, et al. Immunomodulatory Effects of Current Targeted Therapies on Hepatocellular Carcinoma: Implication for the Future of Immunotherapy. Semin Liver Dis. 2018 Nov; 38(4): 379-388.
审批号:MI-LEN-0129-CN
免责声明:
本资讯由默沙东医学团队编辑提供,旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
查看更多