查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





点击下图↓,查看专题更多内容
2025华山年度盘点 | 重症肌无力——国际篇:范式重塑与精准诊疗
作者:复旦大学附属华山医院 贺定贤 许雅芳 罗苏珊 赵重波
2025年,重症肌无力(MG)的诊疗范式正在经历从经验医学向精准医学的深刻转型。作为中国重症肌无力协作组(CMGCG)的组长单位,复旦大学附属华山医院神经内科神经肌病亚专业组在这一年中,依托丰富的临床资源与严谨的科研体系,聚焦危象管理、靶向治疗的真实世界应用以及新型生物标志物探索等核心问题,产出了一系列有临床指导价值的临床研究成果。
复旦大学附属华山医院神经肌病团队始终致力于解决临床实际痛点,从危重症的早期阻断到生物制剂的精细化分层治疗,为改善MG患者的长期预后提供了中国人群的医学证据。

在危重症管理领域,团队将目光前移至“危象前状态(IMC)”的识别与干预,并深入分析了导致患者死亡的深层原因。
针对“IMC”向“肌无力危象(MC)”转化的风险,王颖等团队的研究纳入了37例IMC患者,发现在接受静脉注射免疫球蛋白(IVIg)或血浆置换等标准化挽救治疗后,仅有24.32%(9/37)的患者最终进展为MC,这意味着超过3/4的患者成功避免了插管风险。研究进一步揭示,病程较长(88.0±71.43个月)是IMC向MC转化的显著风险因素。免疫学分析显示,IMC与MC患者体内的辅助性T细胞(Th)17比例均较健康对照显著升高,且MC组呈现出更为复杂的免疫微环境紊乱,提示早期识别并在48小时内启动强力免疫干预是改善预后的关键。
对于更为严峻的死亡风险,团队联合四川大学华西医院开展了一项跨度10年的双中心回顾性研究。在纳入的3723名MG住院患者中,总体院内死亡率为2.12%,但胸腺瘤相关MG(TAMG)患者的死亡率高达4.87%,显著高于非胸腺瘤MG组的1.02%。分析显示,脓毒性休克(40.51%)和MC(22.78%)是导致TMG患者死亡的前两大原因。值得高度警惕的是,暴发性心肌炎是TMG患者特有的第三大死因(占17.31%),而在非胸腺瘤MG组中未见此情况(图1)。这一发现警示临床医生,在救治危重TMG患者时,除了关注呼吸功能和感染控制外,必须密切监测心脏风险。
图1 MG死亡患者的直接死因与根本死因
随着新生儿Fc受体(FcRn)拮抗剂等新型生物制剂进入临床,如何实现精准用药成为新的挑战。
团队牵头的全国15家中心真实世界研究,绘制了艾加莫德(Efgartigimod)在乙酰胆碱受体(AChR)抗体阳性全身型MG(gMG)不同亚型中的疗效图谱。研究显示,87.1%的患者可获得有意义的临床改善,30.2%达到最小症状表达(MSE)。其中,晚发型MG(LOMG)患者获益最显著,MSE应答率达42.9%;而TAMG患者反应相对较差,MSE应答率仅为21.1%,且有相当比例患者因疗效不佳需切换药物。基线MG日常活动量表(MG-ADL)评分被证实是疗效的独立预测因子。
针对新发gMG患者,团队的研究对比了艾加莫德与传统标准治疗(SoC)的疗效差异。结果表明,艾加莫德组不仅MSE的应答率显著更高(45.61% 对 13.33%),且起效更迅速,平均达标时间缩短了约3.4周。更为重要的是,该组患者激素减量的幅度达到了22.6%,远优于对照组,证实了其作为早期快速诱导治疗的优势。此外,针对难治性的肌肉特异性受体酪氨酸激酶(MuSK)抗体阳性MG,团队的研究发现艾加莫德能使MG-ADL评分从基线的10.1分大幅降至第12周的1.3分;若联合CD20单抗或他克莫司治疗,半数患者在第24周可达到MSE且激素用量≤5 mg,展现了一定的激素豁免潜力(图2)。
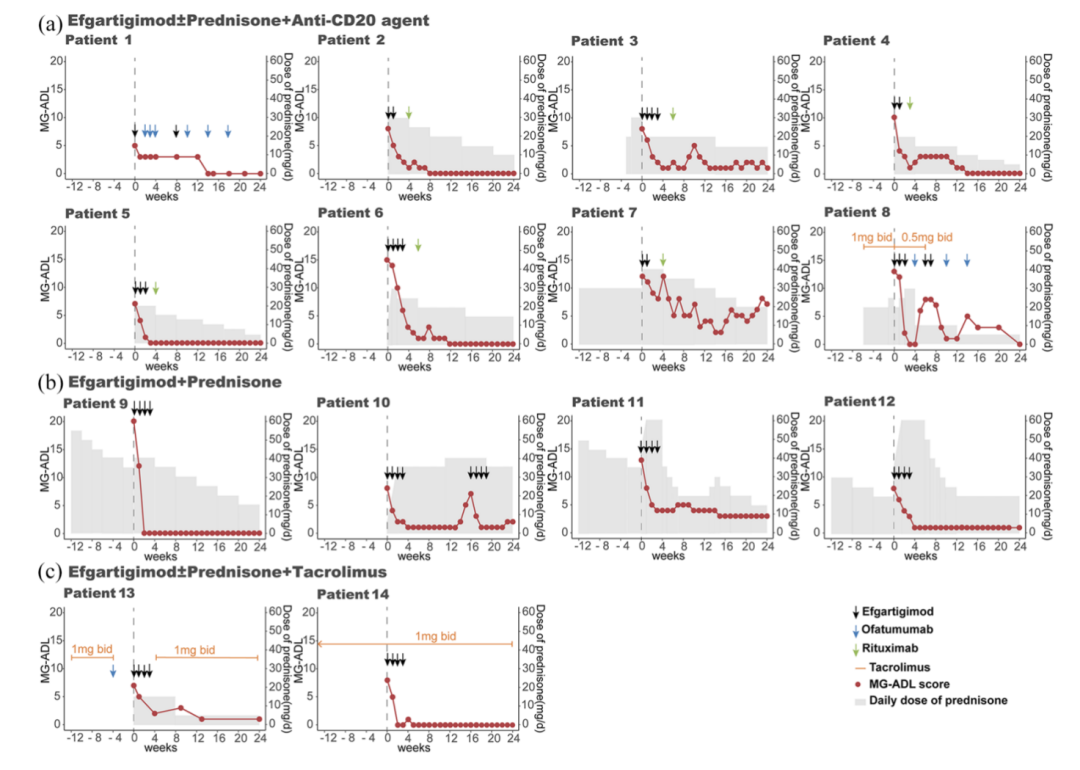
图2 艾加莫德及后续维持治疗在MuSK-MG中的疗效
在机制探索方面,团队的研究揭示了艾加莫德的双重免疫调节作用:它不仅能清除病理性免疫球蛋白(Ig)G,还能直接下调单核细胞和淋巴细胞表面的FcRn表达,导致非经典单核细胞及Th17.1细胞亚群显著减少。这一发现为FcRn拮抗剂的长期免疫调节效应提供了新的理论支撑。
对于围手术期管理,团队探索了依库珠单抗(Eculizumab)在TAMG患者术前的应用,发现其能在1周内显著改善MG定量评分表(QMG)评分(下降7.39分),并将术后危象发生率控制在9.1%,为重症患者的手术安全提供了新策略。
在解决常见临床问题的同时,团队亦未忽视对罕见表型及新型标志物的探索。
基于UK Biobank与华山队列的联合分析,发现血清胱抑素C(Cys-C)可作为评估疾病活动度的潜在生物标志物。研究数据表明,MG患者血清Cys-C水平显著升高,且与QMG评分呈正相关(R=0.40)(图3);有效治疗后其水平随病情好转而下降,且与Th1/Th2免疫平衡密切相关。
图3 MG患者Cys-C水平显著升高,且与QMG评分呈正相关
在罕见病例方面,团队报道并系统复习了以远端肌无力为首发症状的TAMG病例。文献回顾显示此类患者占比不足5%,极易被误诊为远端肌病或运动神经元病,诊断延迟甚至可达15年。该研究强调了对于不明原因远端无力患者,常规筛查神经肌肉接头功能及相关抗体的重要性。此外,针对难治性眼肌症状合并甲状腺眼病(TED)的复杂病例,团队创新性地引入定量磁共振成像(qMRI) 技术评估眼外肌炎症水肿情况,成功指导了1例经多轮治疗失败患者进行改良的利妥昔单抗治疗,实现了症状的完全缓解与影像学的客观改善。
除了在科研领域的深耕,团队在2025年亦积极履行社会责任并扩大国际影响力。团队举办了第三期MG临床研究基地参访项目;并通过“华山医直播”、“华山罕见病”、“神经科的那些事”和“重症肌无力的天空”微信公众号及小红书账号等平台推广MG科普知识,提升基层医务工作者和社会公众对疾病的认知和健康素养,全年共发布各类推文314篇;开展本地及多地联动的MG患者教育活动9场,累计参与人数超过1万人次。
在患者管理与服务创新方面,今年起,团队自主研发的MG患者自我管理平台也集成了预问诊系统,并将其与医院HIS系统实现无缝对接。患者可在就诊前自主填写规范化病情信息,相关数据实时同步至结构化电子病历,有效提升了医生接诊效率与病历完整性,同时显著改善患者就诊体验。
今年,平台还同步开发了智能对话机器人功能,面向更广泛的院外人群,提供疾病教育、风险提示以及心理关怀等多维度支持服务,进一步提高患者满意度。目前平台注册用户已超过4000人,参与患者管理的医护人员超过45人,逐步形成了以患者为中心的持续管理与关怀新模式。
在国际学术舞台上,团队多位成员在世界神经病学大会(WCN)、日本神经病学年会(JSN)及美国重症肌无力基金会(MGFA)科学会议上频频发声,向世界展示了中国MG诊疗的真实世界数据与创新思考,持续推动全球MG诊疗水平的共同进步。
道阻且长,行则将至。2026年,华山团队将继续携手全国同道,以严谨的科学态度和温暖的医者仁心,在攻克神经免疫疑难病的征途上破浪前行,为每一位MG患者点亮回归正常生活的希望之光。

1. Jin L, Zou Z, Wang Q, et al. Patterns and predictors of therapeutic response to efgartigimod in acetylcholine receptor-antibody generalized myasthenia gravis subtypes. Ther Adv Neurol Disord. 2025;18:17562864251319656.
2. He D, Zhou Y, Zhang Y, et al. Response of refractory residual ocular symptoms to efgartigimod in generalized myasthenia gravis: A real-world case series. J Neuroimmunol. 2025;401:578558.
3. He D, Zhong H, Jin L, et al. Serum cystatin C as a potential biomarker for generalized acetylcholine receptor antibody-positive myasthenia gravis. Front Immunol. 2025;16:1578359.
4. Wang Y, Huan X, Song J, et al. Clinical outcome and peripheral CD4+ T profile in impending myasthenic crisis: A prospective cohort study. J Neuroimmunol. 2025;402:578572.
5. He D, Jin L, Wang S, et al. Efgartigimod versus standard of care in new-Onset AChR subtype generalized myasthenia gravis: A prospective cohort study. Clin Immunol. 2025;281:110587.
6. Chen H, Wang Y, Zhang N, et al. The Etiology Analysis of Myasthenia Gravis with In-Hospital Mortality in the Neurocritical Care Unit. Neurocrit Care. 2025;43(3):1033-1042.
7. He D, Li X, Wang B, et al. Rituximab for refractory ocular symptoms in myasthenia gravis with thyroid eye disease: a case report with quantitative MRI assessment. Front Immunol. 2025;16:1717260.
8. Jin L, Dong L, Wang Y, et al. In-Depth Profiling Highlights the Effect of Efgartigimod on Peripheral Innate and Adaptive Immune Cells in Myasthenia Gravis. Ann Clin Transl Neurol. Published online December 18, 2025.
9. Wu H, Chu X, Zhong H, et al. Eculizumab as a new option for perioperative treatment in thymoma-associated myasthenia gravis. Clin Immunol. 2025;283:110657.
10. Zhou Y, Zhou Q, Yue Y, et al. Efgartigimod for induction and maintenance therapy in muscle-specific kinase myasthenia gravis. Ther Adv Neurol Disord. 2025;18:17562864251326778.
11. Wu X, Xu XT, Zhou L, Qiao K, Zhao CB, Luo SS. Distal muscle weakness as the main onset symptom in thymoma-associated myasthenia gravis: a case report and literature review. Front Immunol. 2025;16:1498847.
查看更多