查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2025年7月31日,《美国医学会杂志·肿瘤学》(JAMA Oncology)杂志在线发表了复旦大学附属肿瘤医院胡夕春教授和中山大学肿瘤防治中心王树森教授共同领衔的TIFFANY研究。该研究是一项在中国69个中心开展的随机、双盲、安慰剂对照、Ⅲ期临床试验,支持泰瑞西利联合氟维司群作为内分泌治疗(ET)后进展的HR+/HER2-晚期乳腺癌患者的有效治疗选择。

HR+/HER2-乳腺癌约占所有乳腺癌病例的70%,ET是这些患者的标准治疗选择,但大多数患者最终会对ET产生耐药性,因此需要替代策略以延长患者生存期并提高生活质量。
CDK4/6是多种肿瘤细胞G1/S期转变的关键调节因子,在HR+乳腺癌中过度活跃,导致对ET单药治疗的耐药。关键性临床试验(包括PALOMA3、MONALEESA3、MONARCH2及DAWNA1研究)证实,对于接受ET后出现疾病进展的HR+/HER2-晚期乳腺癌患者,在氟维司群基础上联用CDK4/6抑制剂,相较于氟维司群单药治疗可显著延长PFS期。基于上述循证医学证据,CDK4/6抑制剂联合ET已被确立为HR+/HER2-晚期乳腺癌的标准治疗策略。
泰瑞西利是一种新型CDK4/6抑制剂,在临床前肿瘤模型中展现出显著的抗肿瘤活性。既往I期临床试验表明,泰瑞西利联合氟维司群在经治HR+/HER2-晚期乳腺癌患者中显示出初步疗效及可控的安全性特征,研究者评估的客观缓解率(ORR)达到60.5%。在TIFFANY研究的期中分析中,泰瑞西利联合氟维司群的中位PFS期为11.1个月,显著优于安慰剂加氟维司群的5.5个月,疾病进展或死亡风险降低69%,且超过了预设的优效性边界。
本文报告了泰瑞西利联合氟维司群对比安慰剂联合氟维司群的预设最终PFS结果及长期随访数据。
1.年龄≥18岁,处于绝经状态;
2.经组织学确诊的激素受体阳性/HER2-局部晚期或转移性乳腺癌,且不适合根治性手术或放疗;
3.所有患者均存在影像学证实的疾病复发或进展,且符合以下任一情形:①正在接受新辅助或辅助ET期间;②完成辅助ET后12个月内;③正在接受转移性疾病一线ET治疗;
4.至少存在1处可测量病灶,或仅存在不可测量的溶骨性/混合性骨病变。
晚期阶段接受过>1线化疗;既往使用过氟维司群、依维莫司或其他CDK4/6抑制剂;研究药物给药前14天内接受过ET或小分子酪氨酸激酶抑制剂;心率校正QTc平均值>470毫秒。
患者按2:1比例随机分配至泰瑞西利联合氟维司群(泰瑞西利组)或安慰剂联合氟维司群(安慰剂组),分层因素包括内分泌耐药类型(原发对继发)和内脏转移状态(有对无)。患者、研究者和研究中心人员对治疗分配不知情。主要终点为研究者评估的无进展生存(PFS)期,次要终点包括客观缓解率(ORR)、疾病控制率(DCR)、临床获益率(CBR)、总生存(OS)期和安全性。
2022年5月25日至2023年4月25日期间共筛查370例患者,274例(74.1%)符合条件入组并随机分配。其中泰瑞西利组184例(67.2%),安慰剂组90例(32.8%)。
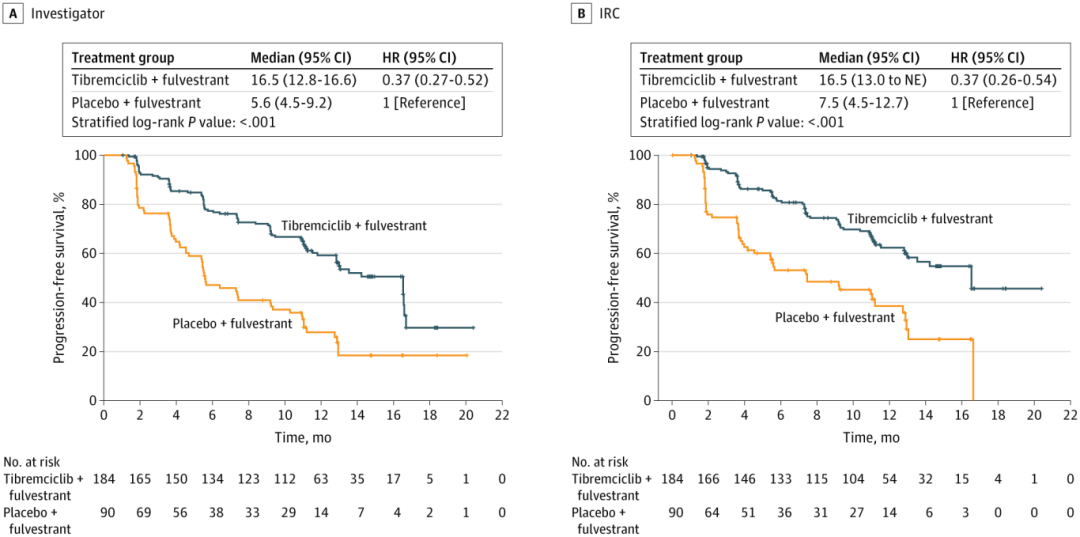
结果显示,截至2024年3月31日,泰瑞西利组和安慰剂组的中位随访时间均为12.9个月。泰瑞西利组中位PFS期达16.5个月,显著优于安慰剂组的5.6个月(延长10.9个月),疾病进展或死亡风险降低63%(HR=0.37,P<0.001)。经盲法独立审查委员会(IRC)评估的泰瑞西利组PFS期获益也一致(HR=0.37,P<0.001)。所有预设亚组(包括内分泌耐药类型、内脏转移状态等)均显示一致获益(HR范围0.28~0.52)。
泰瑞西利组全人群ORR为39.1%,显著高于安慰剂组的10.0%(P < 0.001);在基线存在可测量病灶的患者中,两组ORR分别为45.6%与12.9%(P < 0.001)。DCR方面,泰瑞西利组达89.1%,较安慰剂组的76.7%显著提升(P = 0.01);CBR亦呈现显著优势(74.5%对42.2%,P < 0.001)。DOR对比显示,泰瑞西利组为14.9个月,而安慰剂组为11.0个月。
安全性方面,泰瑞西利组和安慰剂组最常见的3级或以上治疗中出现的不良反应为中性粒细胞减少(15.2%对5.6%)、贫血(12.0%对4.4%)和低钾血症(12.0%对0),未发生药物相关死亡事件,安慰剂组发生1例死亡病例。泰瑞西利的不良反应谱与现有CDK4/6抑制剂相似,整体安全可控。
TIFFANY随机临床试验的预设最终PFS期分析表明,泰瑞西利联合氟维司群方案可显著延长患者PFS期,且各亚组获益一致并具有可控的安全性特征。支持泰瑞西利联合氟维司群作为既往接受内分泌治疗后疾病进展的HR+/HER2-晚期乳腺癌患者的治疗选择。
中国医学论坛报 桂晶晶 整理
查看更多