查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





点击进入专题:
作者:复旦大学附属华山医院神经内科 血管组 张怡然 洪澜
替奈普酶(Tenecteplase,TNK)是一种经对阿替普酶上3个位点的修饰得到的具有高纤维蛋白特异性和强纤溶酶原激活抑制剂抵抗的组织型纤溶酶原激活剂。因其具有更长的血浆半衰期,使用时只需一针bolus静脉注射,相比传统的阿替普酶更加便捷,收到业界的广泛关注。自2005年起[1],替奈普酶在脑梗适应证的探索已然启动。在一系列剂量探索的临床Ⅱb期研究中[2-4],研究者们发现0.25 mg/kg的TNK较其他剂量具有更佳的功能预后和更低的出血转化风险。2022年ESOC公布的AcT研究[5]首次证明了窗内溶栓使用0.25 mg/kg TNK相较于标准0.9 mg/kg阿替普酶的非劣效性,为4.5小时静脉溶栓窗内使用TNK提供了强有力的证据。事实上,在本次ISC会议的公众投票中,36%的参与者已经开始使用TNK静脉溶栓,37%的参会者正在考虑切换。
但应当注意以上研究都是在以白人为主的西方国家进行,尚不能直接推论到被认为具有更高的溶栓后出血转化风险[6]的亚洲人上。来自中国天坛医院的研究团队于2018年起开始开展TRACE系列研究对我国本土自主研发的TNK——rhTNK-tPA在亚洲人群的脑梗适应证进行探索。该系列第一步研究,TRACE-I于2022年发表,该Ⅱ期临床研究[7]提示和高加索人群合适的TNK剂量类似,对发病3小时内的中国急性脑梗患者来说,0.25 mg/kg的rhTNK-tPA具有较好耐受性,且和0.9 mg/kg阿替普酶有相似的安全性。
2023年2月9日,来自中国首都医科大学附属北京天坛医院的李姝雅博士在ISC大会上公布了TRACE-Ⅱ(Tenecteplase Reperfusion therapy in Acute ischaemic Cerebrovascular Events-2)研究结果,研究论文也同步于Lancet杂志在线发表[8]。
TRACE-Ⅱ由首都医科大学附属北京天坛医院王拥军教授牵头,全国53家中心参与,是一项前瞻性、开放标签、终点盲法、非劣效设计的随机对照Ⅲ期临床试验。该研究旨在评估对于4.5小时发病符合溶栓适应证且不考虑行血管内治疗的脑梗患者,0.25 mg/kg rhTNK-tPA是否非劣效于0.9 mg/kg的阿替普酶。

研究的纳入标准:
年龄≥18岁
最后正常时间4.5小时内
临床诊断为急性缺血性脑梗死
发病前mRS评分0~1分
基线NIHSS评分5~25分
患者或者患者家属知情同意
研究的排除标准:
不符合静脉溶栓适应证
计划行血管内治疗 (但不除外随后根据患者情况治疗医生建议下行血管内治疗)
NIHSS评分意识评分>2
对替奈普酶或者阿替普酶过敏
其他研究者认为研究药物会给患者带来伤害的情况或者会影响患者入组的情况
研究终点:
主要终点:
90天改良Rankin(mRS)评分0~1分。
次要终点:
90天mRS评分0~2分
90天mRS评分的分布情况(位移分析)
24小时症状改善:NIHSS评分降低≥4或者NIHSS评分降低至<1
7天或者出院时(若出院>7天)症状改善:NIHSS评分降低≥4或者NIHSS评分降低至<1
90天EQ-5D评分
90天Barthel指数≥95
安全性结局:
36小时症状性出血(ECASS-3标准)
90天症状性颅内出血(ECASS-3标准)
90天颅内出血PH2型(SITS标准)
90天任何颅内出血
90天系统性出血(GUSTO标准)
90天死亡率
90天不良反应或者严重不良反应
基于既往TRACE-I的结果[7],研究假设rhTNK-tPA组相较传统rtPA组获得良好功能预后(90天mRS 0~1)的绝对风险比为1.07(63.64% vs 59.32%)。设定检验效能85%,单侧Alpha 0.025,预计失访率10%,研究计划按照1:1分组各纳入样本量715人。阿替普酶随机对照试验Meta分析[9]的结果显示相较安慰剂组,阿替普酶获得良好功能预后的风险比为1.24(95%CI 1.14~1.36)。本研究在此基础上,界定rhTNK-tPA非劣性应至少大于阿替普酶的保守疗效估计的50%,即当本研究RR的95%可信区间下限大于exp(–1[(Log[1.14])/2])=0.937时即认为rhTNK-tPA非劣效于阿替普酶(此时对应3.74%绝对风险差异)。
在2021年6月至2022年5月期间,研究共纳入1430名患者,分别由716名、714名患者随机至rhTNK-tPA和rtPA组。其中2组中分别有6名和7名患者没有按照分组用药方案进行治疗,最终rhTNK-tPA组710人、rtPA组707人纳入改良意向性治疗(m-ITT)分析。
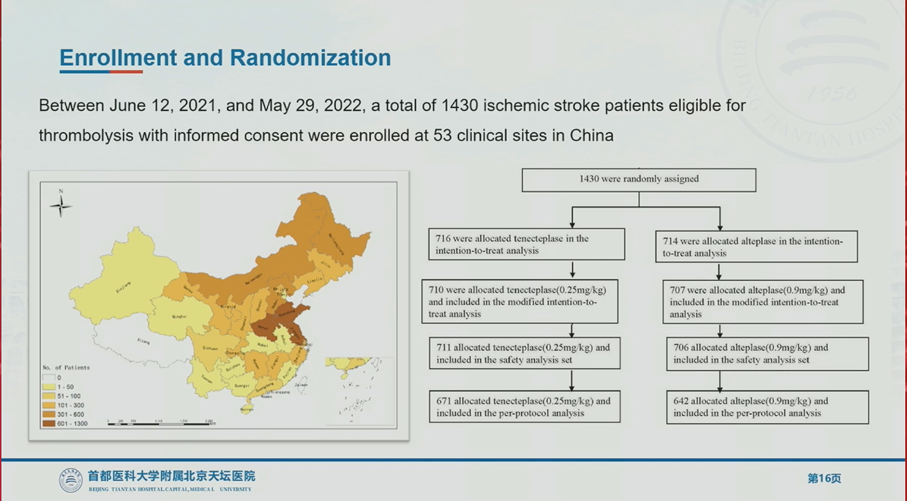
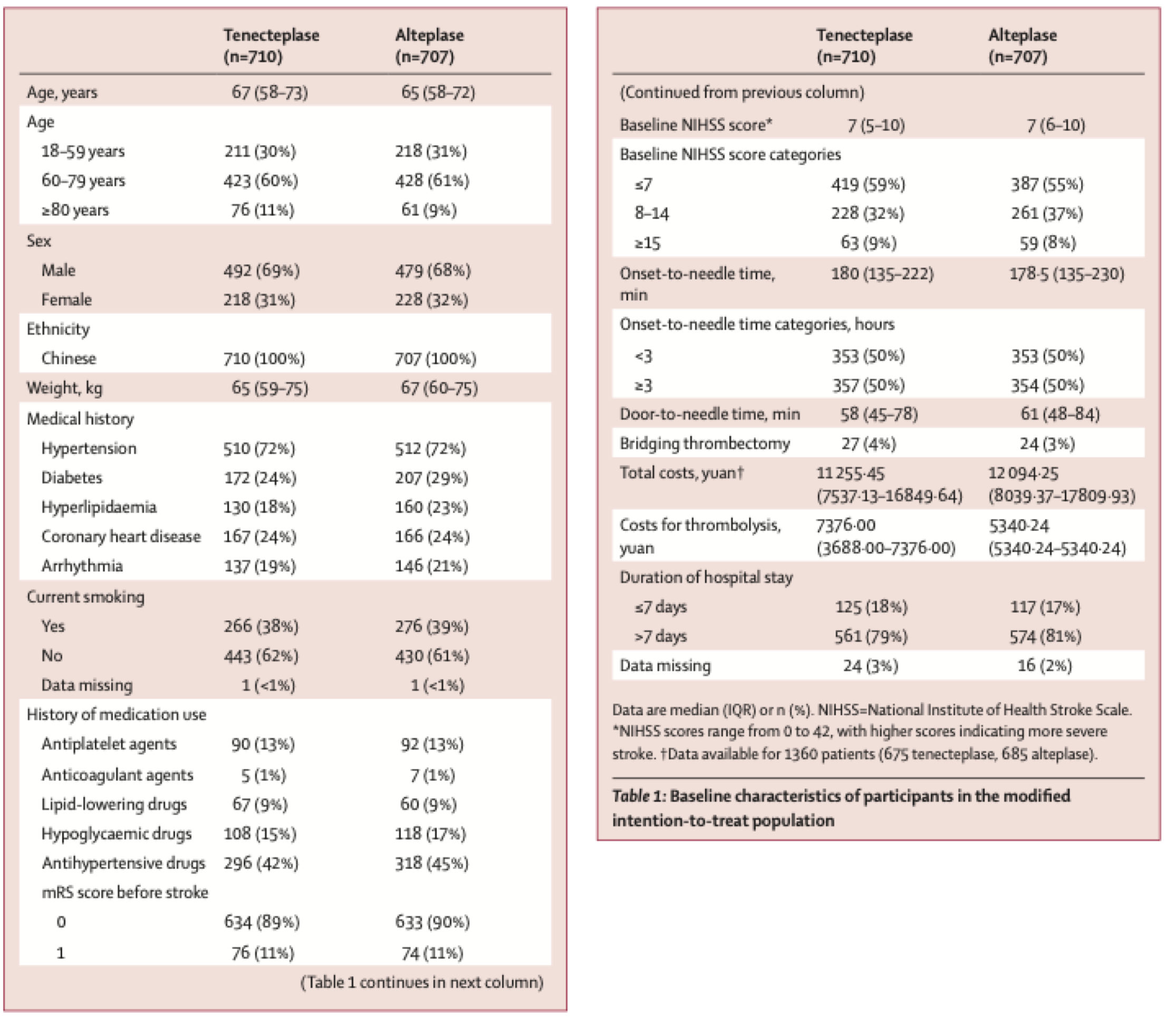
两组患者的年龄中位数65~67岁,NIHSS评分中位数7分,发病到静脉溶栓时间中位数约3个小时。有3%~4%的患者在入组后接受了血管内治疗。
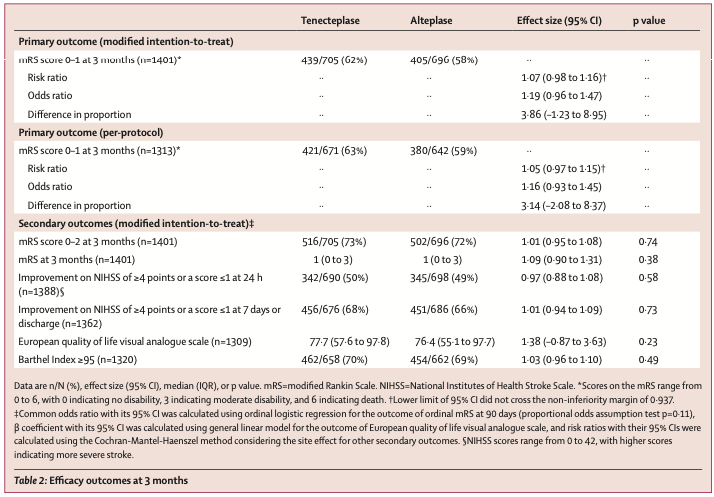
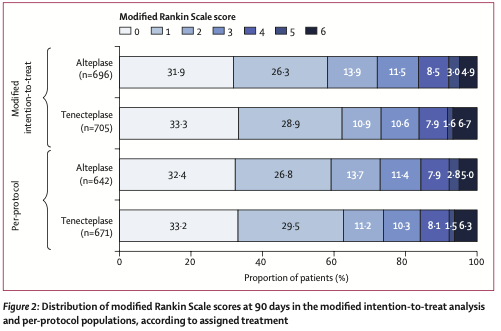
在发病后90天,rhTNK-tPA组和rtPA组分别有62%和58%达到了主要终点(良好功能预后mRS 0~1分),风险比值为1.07(95% CI 0.96~1.16)。其可信区间下限0.96大于非劣效性界值0.937,提示rhTNK-tPA非劣效于rtPA同时也不优效于rtPA。在包括90天mRS分析等终点的次要疗效结局上,两组也具有相似的数值。各个亚组间也没有明显差异。使用符合方案分析集(PP)亦得到类似的结果。
就安全性结局而言,rhTNK-tPA组和rtPA组的36小时症状性颅内出血的比例均为2%,但rhTNK-tPA组中可能存在较高的PH2型颅内出血风险(1% vs.<1%, P=0.053),尽管该差异不存在统计学意义。两组中分别有7%和5%的患者在90天内发生死亡事件。

本研究结果提示在中国人群中,rhTNK-tPA治疗发病4.5小时内的急性缺血性卒中患者的疗效不劣于阿替普酶,且两种药物存在相似的安全性结局。静脉溶栓窗内使用rhTNK-tPA替代阿替普酶可能是合理的。
值得注意的是,TRACE-Ⅱ纳入的并非所有的符合传统静脉溶栓适应证的患者,其对患者的NIHSS评分和动脉内治疗进行了限制。一方面,本研究要求患者为致残性卒中(NIHSS评分≥5分)同时也限制了NIHSS评分上限不能超过25分。就研究结果而言,我们也可以看到患者的NIHSS评分明显低于AcT研究[5],NIHSS评分大于15分的严重脑梗患者在TRACE-Ⅱ研究中仅占9%,而在AcT研究中这一比值为28%。另一方面TRACE-Ⅱ研究除外了计划行血管内治疗的患者,尽管并不禁止后续的血管内治疗,但最终行桥接治疗的比例仅占4%,而事实上在AcT研究约32%的患者接受了血管内治疗,这也说明本研究人群以中等程度的脑梗为主,因而不难解释两组的良好预后率接近甚至高达60%的原因。对于本研究较少覆盖的轻症和重症/大血管闭塞卒中,研究结果能否推广尚待进一步试验的验证。
rhTNK-tPA的上市填补了国内替奈普酶的空白,让更多患者可以用上最新一代溶栓药物。此外,笔者也十分期待TNK在超窗大血管闭塞患者中的探索。既往研究业已表明TNK对大血管的开通具有优势。目前天坛医院的TRACE-Ⅲ研究、华山医院的CHABLIS-T2研究、国际上的TIMELESS、TASTE、TEMPO-2与ETERNAL-LVO研究都在如火如荼开展,TNK大势已来,只差一点点东风扭转剩余21%医生的想法。
参考文献:
[1] HALEY E C, JR., LYDEN P D, JOHNSTON K C, et al. A pilot dose-escalation safety study of tenecteplase in acute ischemic stroke [J]. Stroke, 2005, 36(3): 607-12.
[2] HUANG X, CHERIPELLI B K, LLOYD S M, et al. Alteplase versus tenecteplase for thrombolysis after ischaemic stroke (ATTEST): a phase 2, randomised, open-label, blinded endpoint study [J]. The Lancet Neurology, 2015, 14(4): 368-76.
[3] HALEY E C, JR., THOMPSON J L, GROTTA J C, et al. Phase IIB/Ⅲ trial of tenecteplase in acute ischemic stroke: results of a prematurely terminated randomized clinical trial [J]. Stroke, 2010, 41(4): 707-11.
[4] PARSONS M, SPRATT N, BIVARD A, et al. A randomized trial of tenecteplase versus alteplase for acute ischemic stroke [J]. N Engl J Med, 2012, 366(12): 1099-107.
[5] MENON B K, BUCK B H, SINGH N, et al. Intravenous tenecteplase compared with alteplase for acute ischaemic stroke in Canada (AcT): a pragmatic, multicentre, open-label, registry-linked, randomised, controlled, non-inferiority trial [J]. The Lancet, 2022.
[6] MEHTA R H, COX M, SMITH E E, et al. Race/Ethnic differences in the risk of hemorrhagic complications among patients with ischemic stroke receiving thrombolytic therapy [J]. Stroke, 2014, 45(8): 2263-9.
[7] LI S, PAN Y, WANG Z, et al. Safety and efficacy of tenecteplase versus alteplase in patients with acute ischaemic stroke (TRACE): a multicentre, randomised, open label, blinded-endpoint (PROBE) controlled phase II study [J]. Stroke Vasc Neurol, 2022, 7(1): 47-53.
[8] WANG Y, LI S, PAN Y, et al. Tenecteplase versus alteplase in acute ischaemic cerebrovascular events (TRACE-2): a phase 3, multicentre, open-label, randomised controlled, non-inferiority trial [J]. The Lancet, 2023.
[9] EMBERSON J, LEES K R, LYDEN P, et al. Effect of treatment delay, age, and stroke severity on the effects of intravenous thrombolysis with alteplase for acute ischaemic stroke: a meta-analysis of individual patient data from randomised trials [J]. Lancet, 2014, 384(9958): 1929-35.
中国医学论坛报原创文章,转载须授权
查看更多