查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2型糖尿病(T2DM)的治疗需要综合考虑多种病理生理因素。许多患者在控制血糖的同时,还面临着心血管和肾脏疾病的风险。虽然二甲双胍常作为首选的一线降糖药物,通常是降糖药物的首选,但如今医生们有了更多具有综合获益潜力的有效选择。本文将重点介绍两类新型降糖药物:钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)与基于肠促胰素的药物。我们将深入探讨这两类药物如何在有效降糖的同时,还为患者带来减重、降压,乃至保护心脏和肾脏等多重益处。最后,我们汇总了降糖药物选择的考量因素,为T2DM个体化降糖用药提供参考路径。

降糖药速览:工具箱里的多样选择[1]
T2DM患者常伴发心血管、肾脏等多系统损害,且个体间的病理生理差异显著,因此,血糖管理策略必须遵循个体化原则。在降糖药物的选择上,医生不仅需要考虑药物的降糖效果,更应全面评估患者的心、肾等靶器官状态。为此,表1梳理了当前主流降糖药的降糖效力及其对心、肾功能的影响。
表1.T2DM降糖药物的特点
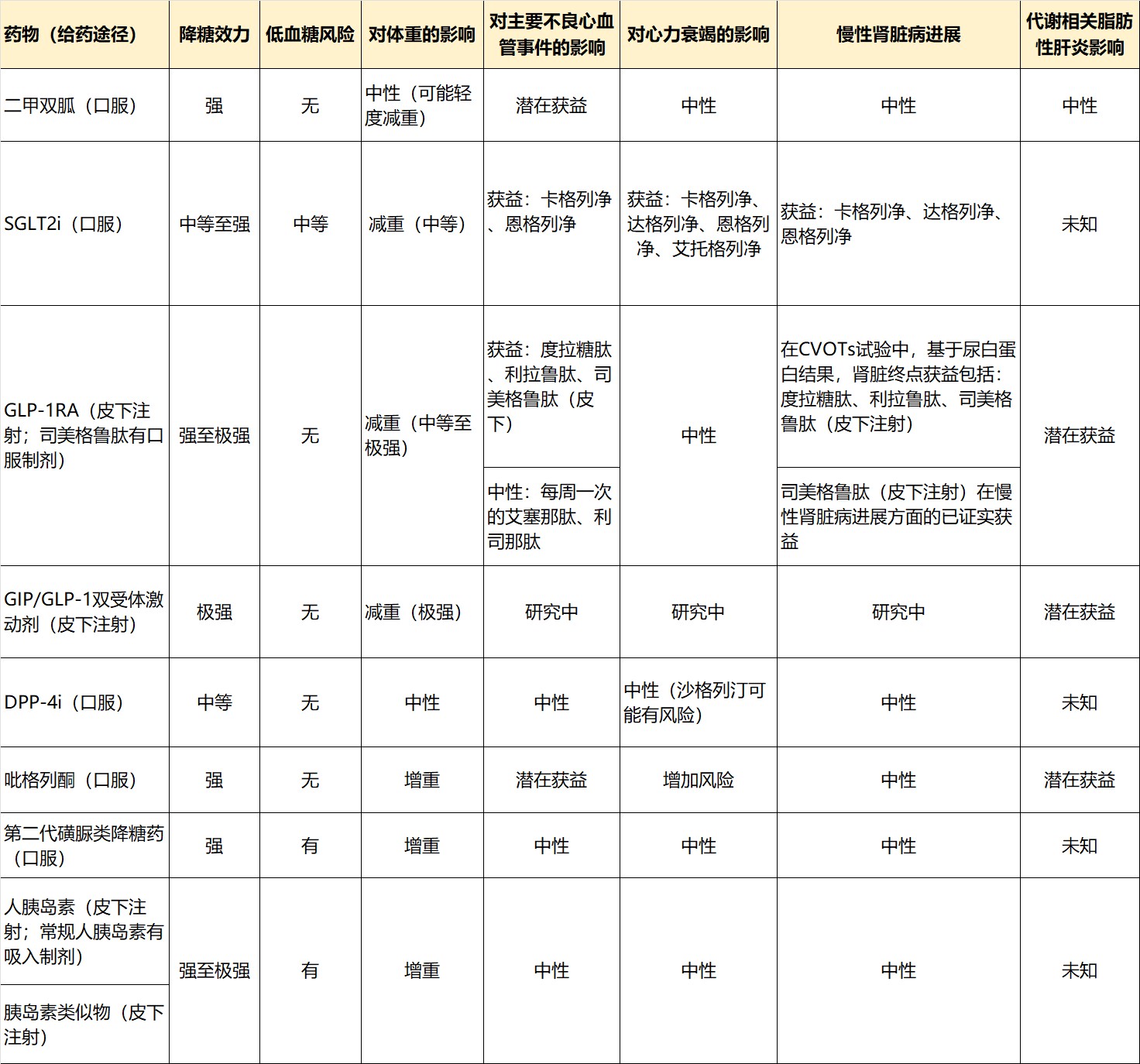
注:葡萄糖依赖性促胰岛素多肽(GIP)、胰高糖素样肽-1(GLP-1)、胰高糖素样肽-受体激动剂(GLP-1RA)、钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)、二肽基肽酶Ⅳ抑制剂(DPP-4i)。

1. 作用机制与核心优势
SGLT2i通过抑制肾脏近曲小管S1段对葡萄糖和钠离子的重吸收,降低肾糖阈,促进过量的葡萄糖和钠离子从尿液中排出,从而以非胰岛素依赖的方式降低血糖,它具有以下特点:
多重代谢获益 除降糖外,兼具减重、降压、调脂、降尿酸等多重效果。
心肾直接保护 通过渗透性利尿、改善心脏能量代谢、抑制心肌重构、降低肾小球内压等机制,提供直接的心脏和肾脏保护。
胰岛β细胞功能保护 通过有效降糖、减重,改善肥胖,减少脂肪组织介导的炎症反应。
2. 临床疗效和心血管与肾脏获益
图1展示了SGLT2i在临床应用中的疗效和心血管与肾脏获益
图1.SGLT2i的疗效和心血管肾脏获益
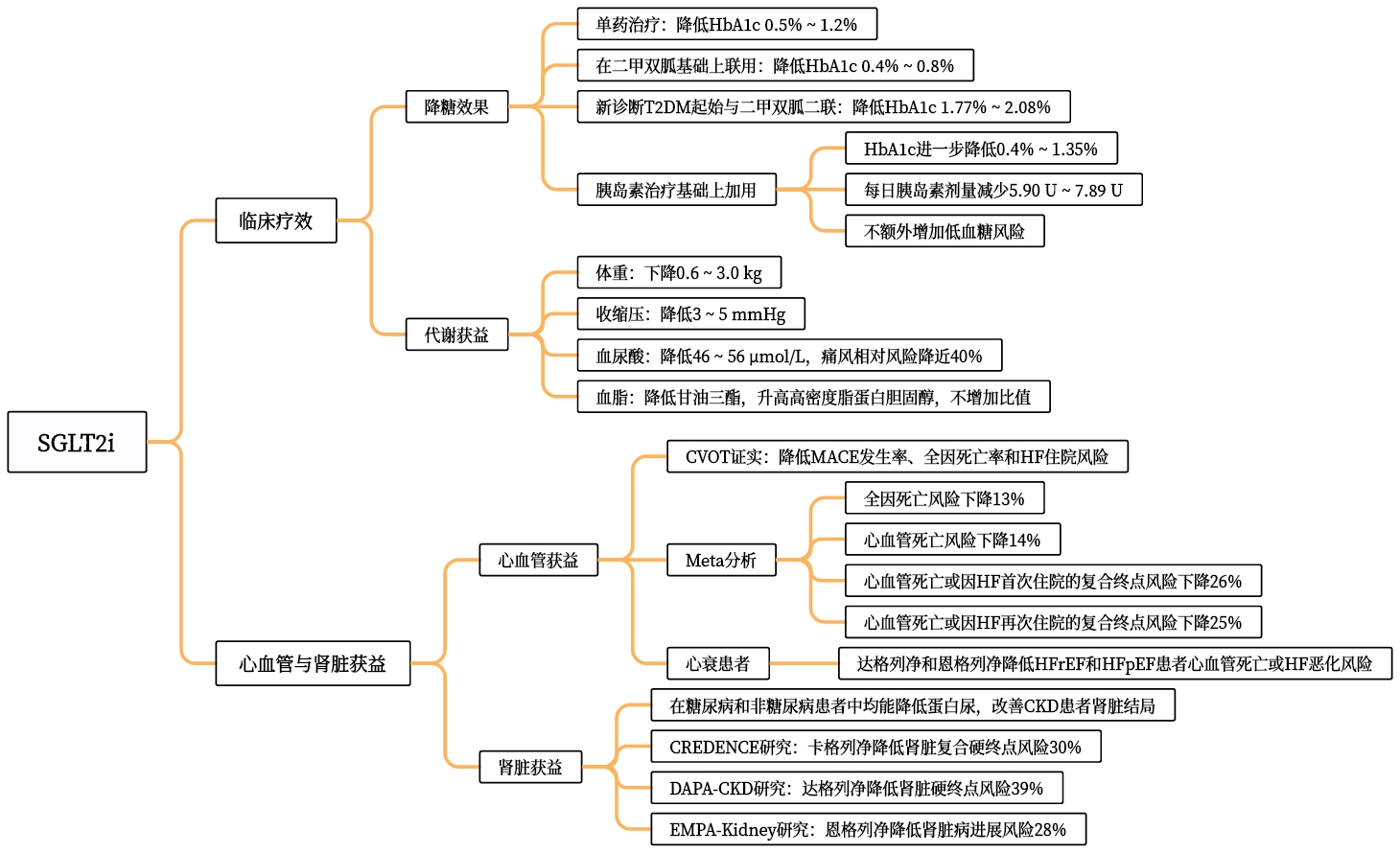
注:钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)、糖化血红蛋白(HbA1c)、心力衰竭(HF)、射血分数保留型心力衰竭(HFpEF)、射血分数降低型心力衰竭(HFrEF)、心血管结局试验(CVOT)、主要不良心血管事件(MACE)、慢性肾脏病(CKD)。
3. 临床疗效和心血管与肾脏获益
SGLT2i在轻、中度肝功能受损(Child‑Phgh A、B级)患者中使用无须调整剂量,在重度肝功能受损(Child‑Phgh C级)患者中不推荐使用。
SGLT2i不建议用于估算肾小球滤过率(eGFR)<30 ml·min-1·1.73 m-2患者 的血糖控制,但是已经使用SGLT2i的T2DM伴动脉粥样硬化性心血管疾病(ASCVD)或心力衰竭(HF)的患者,其间即使eGFR<20 ml·min-1·1.73 m-2仍可继续使用,直至开始透析或进行肾移植为止。
T2DM患者存在糖尿病酮症酸中毒(DKA)或高渗性高血糖状态时,应停止使用SGLT2i,并对患者进行评估,立即进行补液、静脉输注胰岛素等治疗。
SGLT2i不推荐应用于计划妊娠的T2DM或妊娠期显性糖尿病患者。
3. SGLT2i应用的潜在风险
SGLT2i在应用过程中存在多种潜在风险,包括:①用药初期eGFR的短暂下降;②泌尿生殖系统感染;③DKA或血糖正常型酮症酸中毒(euDKA);④高磷血症、骨折与截肢风险;⑤膀胱功能异常或膀胱癌风险;⑥低血糖风险;⑦血容量不足与直立性低血压风险;⑧持续性体重下降等。其中,部分风险较常见或严重,值得临床重点防范。
eGFR的早期下降 初次使用SGLT2i,尤其肾病中晚期或接受利尿剂治疗的患者,2~4周后部分患者出现短暂的eGFR下降>10%或血肌酐升高>30%,此时应积极评估患者是否有其他急性肾损伤的原因,停用肾毒性药物,并通过减少或停用利尿剂和(或)增加液体摄入量来纠正低血容量。在等待肾功能恢复期间可暂停SGLT2i,一旦急性肾损伤逆转,药物治疗即可重启。
泌尿生殖系统感染 因尿糖浓度升高,泌尿生殖系统感染风险增加,感染多为轻中度,常规抗感染治疗有效。对于无症状性菌尿和生殖器真菌轻度感染的患者,常规抗感染治疗反应良好,一般不需要停用SGLT2i。
DKA/euDKA风险 SGLT2i的使用增加了euDKA风险,但总体而言,SGLT2i相关的euDKA风险仍然相对较低。对于接受手术、严重感染、血容量不足等存在DKA相关诱因的患者,建议暂时停用SGLT2i。患者发生DKA后,也建议停用SGLT2i,并积极进行补液、静脉输注胰岛素等治疗,纠正DKA后,可以重新恢复SGLT2i的使用。

1. 作用机制与核心优势
此类药物模拟或协同增强内源性肠促胰素的作用,通过多靶点机制改善T2DM的复杂病理生理。
(1) 胰高糖素样肽-受体激动剂(GLP-1RA)
促胰岛素 GLP-1RA通过模拟天然存在的胰高糖素样肽-1(GLP-1)作用,通过与胰岛β细胞的GLP‑1受体结合后,从而增强胰岛素的出胞作用增加胰岛β细胞的胰岛素分泌。
抑胰高糖素 GLP-1RA通过与胰岛α细胞上的受体结合,直接抑制胰高糖素的分泌,还可以通过作用于胰岛δ细胞,刺激生长抑素的分泌,间接抑制胰高糖素分泌;当血糖浓度升高时,GLP-1RA促进胰岛素的分泌,同时抑制胰高糖素的释放,这对于控制高血糖状态至关重要。
增加饱腹感和延缓胃排空 GLP-1RA可作用于下丘脑的背内侧区域内的特定神经元,增加饱腹感。同时,GLP-1RA也可以直接作用于胃的平滑肌细胞,减缓胃的收缩频率和力度,从而延缓胃内容物的排空速度。
(2) 替尔泊肽 (GIP/GLP-1RA双受体激动剂)
作为单分子多靶点药物,同时激动葡萄糖依赖性促胰岛素多肽(GIP)和GLP-1受体,相较GLP-1RA,产生更接近生理的肠促胰素效应。
2. 临床疗效和药物不良反应
图2展示了GLP-1RA和替尔泊肽的疗效和不良反应
图2. 肠促胰素为基础的药物的疗效和不良反应
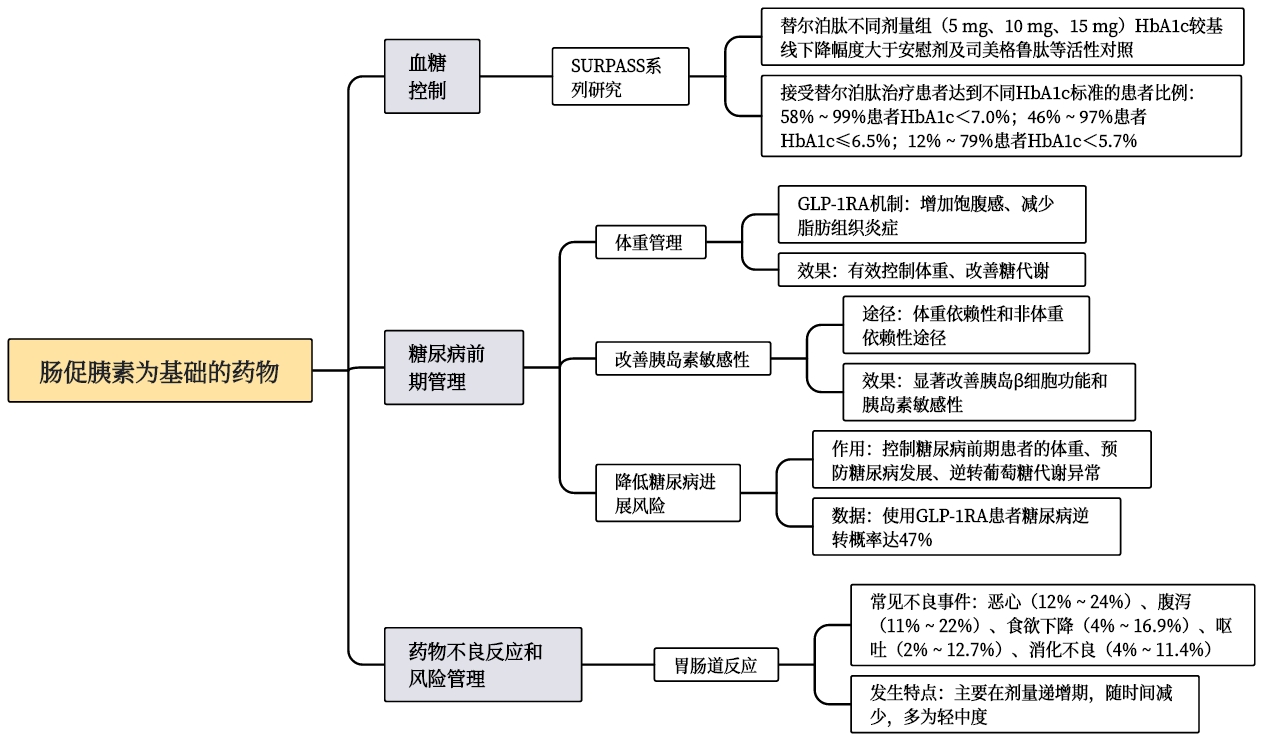
注:糖化血红蛋白(HbA1c)、胰高糖素样肽-受体激动剂(GLP-1RA)。
糖尿病的药物降糖策略核心是根据患者具体情况个体化用药,这不仅需要考虑患者是否存在心肾功能受损,同时还需要明确核心治疗目标,比如降糖或减重。以下决策路径图可为降糖药的选择提供参考。
图3. 降糖药物在不同治疗目标中的选择
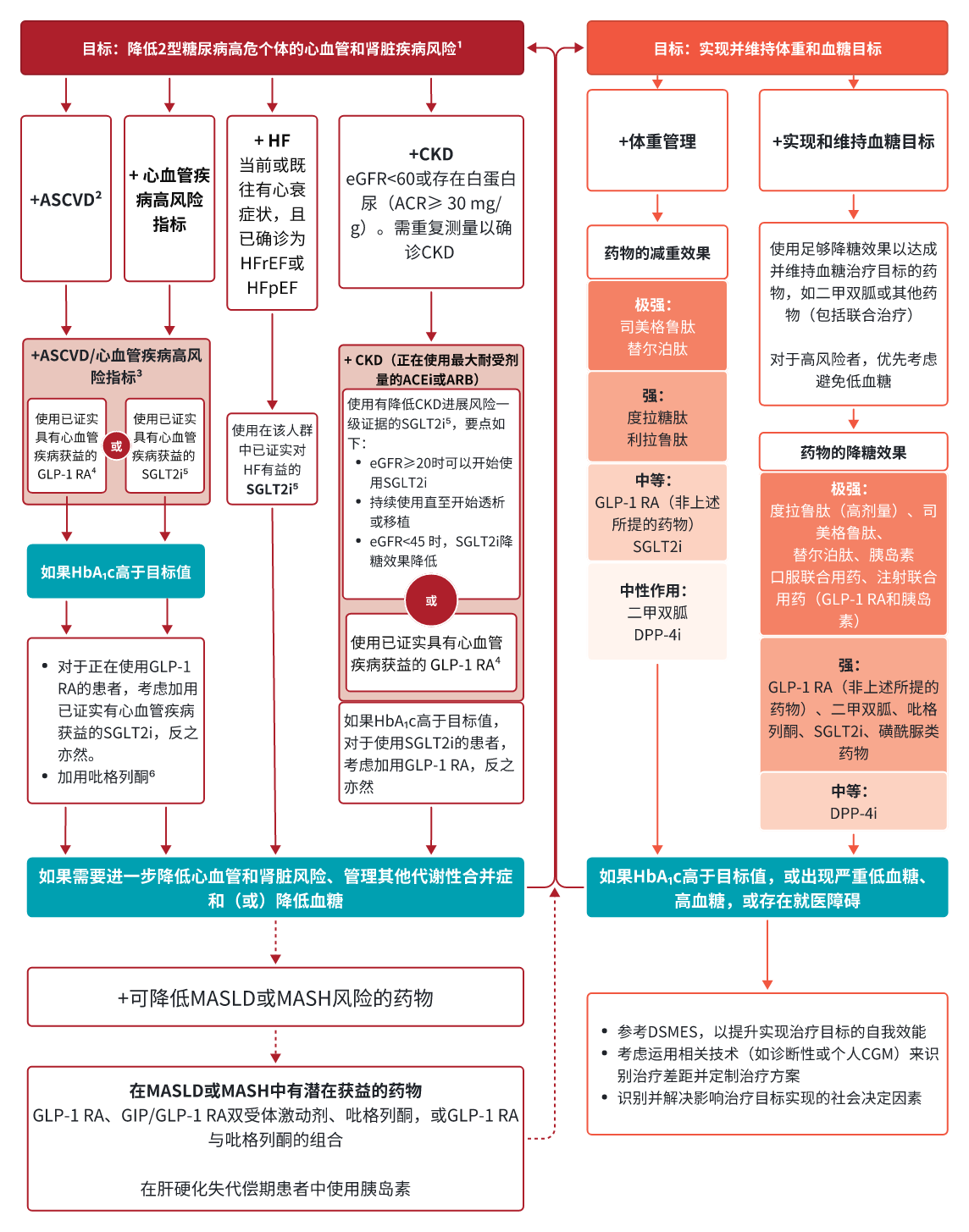
1对于患有心力衰竭(HF)、慢性肾脏病(CKD)、已确诊心血管疾病(CVD)或存在多种心血管疾病危险因素的患者,无论是否正在使用二甲双胍或糖化血红蛋白(HbA1C)水平如何,都应使用已证实有获益的胰高糖素样肽-1受体激动剂(GLP-1RA)或钠-葡萄糖协同转运蛋白2抑制剂(SGLT2i)。
2动脉粥样硬化性心血管疾病(ASCVD):在不同心血管结局试验(CVOTs)中的定义有所不同,但均纳入已确诊心血管疾病(如心肌梗死、卒中和动脉血运重建)的个体,且不同程度纳入如短暂性脑缺血发作、不稳定型心绞痛、截肢以及有症状或无症状冠心病等情况。高风险指标:尽管定义各异,但大多为年龄≥55岁且伴有两项或更多其他危险因素(包括肥胖、高血压、吸烟、血脂异常、白蛋白尿)。
3对于CVD人群,强烈建议采取相应措施,而对于有心血管疾病高风险指标的人群,建议力度稍弱。此外,在基线风险较高的情况下,能看到更高的绝对风险降低,因此所需治疗人数更少,这一点应纳入共同决策过程。
4对于GLP-1RA药物,CVOTs表明,其在改善T2DM合并已确诊CVD或具有CVD高风险患者的硬结局上具有疗效。硬结局包括:主要不良心血管事件(MACE)复合终点、心血管死亡、全因死亡率、心肌梗死、心衰住院和肾脏终点事件。一项肾脏结局试验表明,对于合并CKD和T2DM的个体,GLP-1RA可有效减少eGFR持续下降的风险,同时还能降低心血管死亡的风险。
5对于SGLT2i而言,心血管和肾脏结局试验表明,其在降低T2DM合并已确诊CVD或具有CVD高风险个体的硬结局上具有疗效。硬结局包括:MACE复合终点、心血管死亡、全因死亡、心肌梗死、心衰住院及肾脏结局。
6低剂量吡格列酮可能比高剂量耐受性更好,且疗效相似。
注:该流程图的左侧优先考虑减轻糖尿病相关并发症和终末器官影响,而右侧则针对体重和血糖管理目标。eGFR的单位是(ml·min-1·1.73 m-2)、糖尿病自我管理教育与支持(DSMES)、持续葡萄糖监测(CGM)、代谢相关脂肪性肝病(MASLD)、代谢相关脂肪性肝炎(MASH)、血管紧张素转化酶抑制剂(ACEI)、血管紧张素受体拮抗剂(ARB)、葡萄糖依赖性促胰岛素多肽(GIP)、胰高糖素样肽-1(GLP-1)、二肽基肽酶Ⅳ抑制剂(DPP-4i)。
整理:王天任
审校:邢英

查看更多