查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





本文作者 北京大学肿瘤医院 王立军
肝脏同时接受肝动脉及门静脉的双重血供,因此,很多身体其他部位的肿瘤容易扩散至肝部,肝转移癌高发。
本期分享的病例是一个横结肠癌肝转移患者,肝转移初始不可切除。当地进行了一线、二线的化疗,评效一线疾病进展(PD),二线疾病稳定(SD)。医院就诊后完善基因检测,结果显示为微卫星高度不稳定(MSI-H)的患者。随后进行免疫治疗,治疗后进行手术切除以及肝转移活检,提示为病理学完全缓解(pCR),患者最终获得长期生存。(本资料旨在促进学术信息的沟通和交流,仅供医疗卫生专业人士参考。出于对患者隐私保护,本资料中患者的信息均做了隐私化疗处理。)
病史简介
• xx,男, 29岁
• 病史:患者2018年6月开始间断出现腹痛,无黑便,2018年7月5日当地结肠镜检提示:横结肠近脾曲交界处菜花样新生物,占据管腔2/3,肠腔狭窄,镜身不能通过。活检:中分化腺癌。
IHC:MLH1(-), MSH2(+),MSH6(+),PMS2(-),Ki-67(+80%), P53(+,框移突变-)。
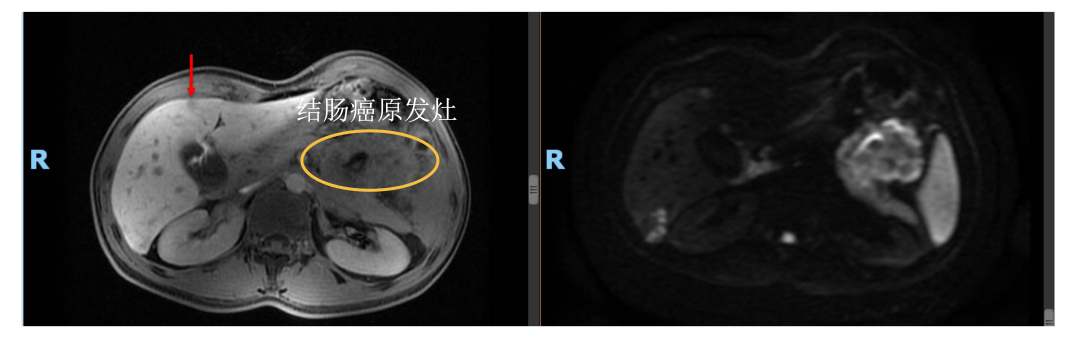
胸腹盆CT(2018年7月):横结肠、结肠脾区及部分小肠异常改变,考虑恶性肿瘤伴肝脏多发转移,肝内病灶最大径3 cm。
肿瘤标志物:CEA 172.2 ng/ml,CA199 5661 U/ml。基因检测:KRAS Exon-2突变,NRAS,BRAF野生型。
• 患者于当地行一线FOLFOX方案化疗2周期,复查肝内病灶增大,最大径增至4.6 cm。
肿瘤标志物 上升:CEA 344.7 ng/ml,CA199>10000 U/ml。化疗后评价:PD。
• 2018年8月25日开始二线行FOLFIRI联合贝伐珠单抗治疗,4周期后评估肿瘤较前SD(缩小),肝转移最大径约3.8 cm。共化疗11周期,末次2019年1月21日。
• 随后患者为进一步评估及治疗于2019年2月再次入院。MRI:肝多发占位,考虑转移,最大病灶直径2.6 cm。
腹盆腔CT:结肠脾曲占位,73x61 mm,浸透浆膜,侵犯空肠起始段。胸部CT:未见转移。瘤标:CEA 261.5 ng/ml,CA199 3526 U/ml。完善大Panel检测提示:MSI-H。
• 既往史、个人史、婚育史及家族史:无特殊。
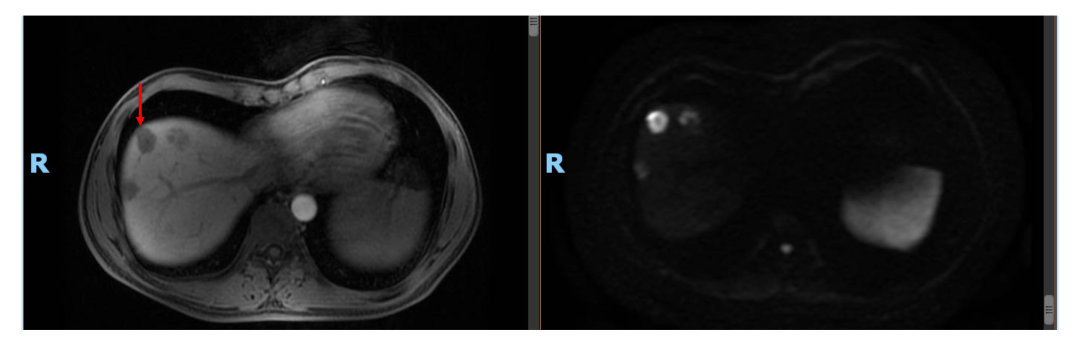
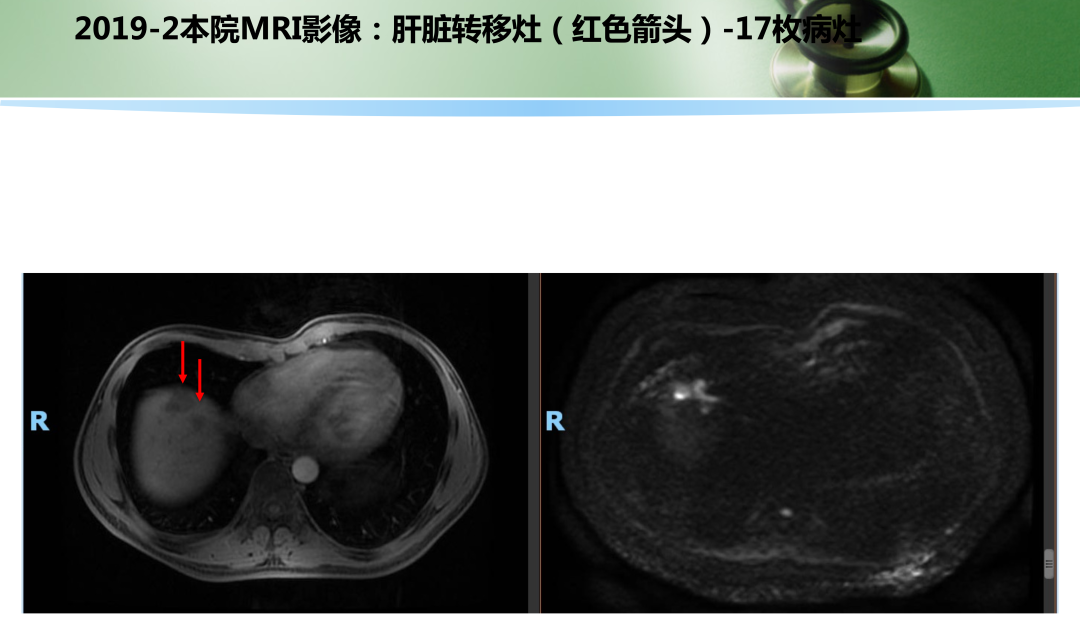
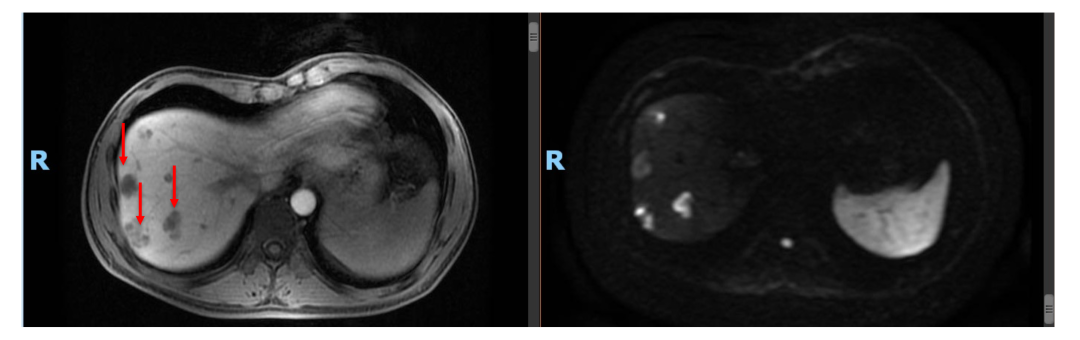
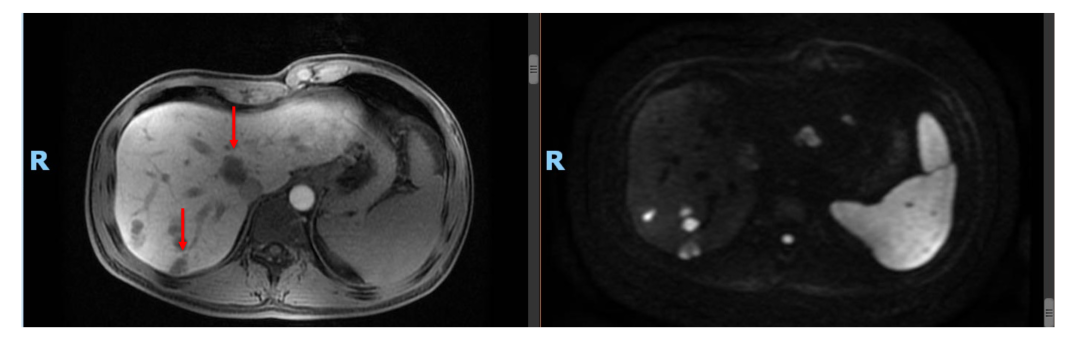
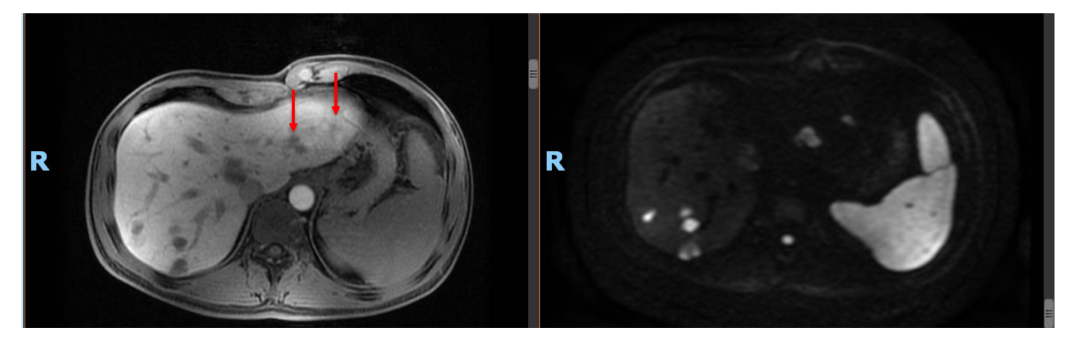
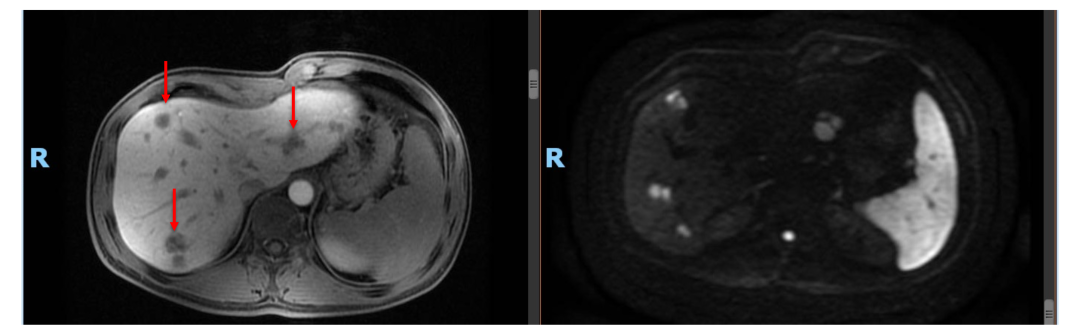
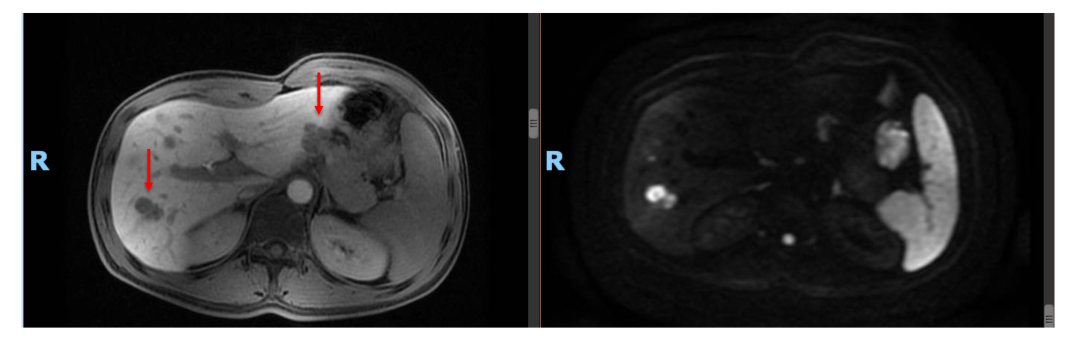
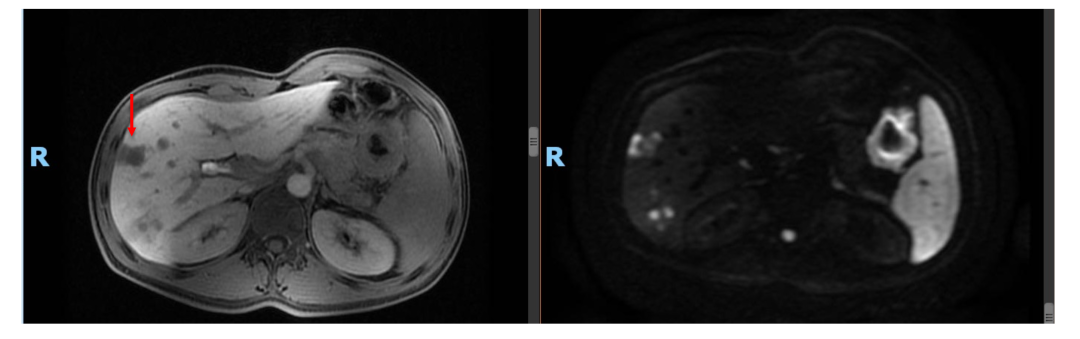
• 诊断: 横结肠癌肝转移
• 可切除性评价:肝转移不可切除
• CRS 4分:同时,多发,N+,CEA>200 ng/ml
• 基因状态:Kras突变, Nras、BRAF野生型
• 微卫星状态:MSI-H
•治疗反应:一线化疗后进展,二线治疗后稳定
• MDT讨论意见:
1)目前,原发灶存在不全肠梗阻导致间断腹痛症状,但未完全梗阻,另外无急性出血、穿孔等急性症状,肝转移评价不可切除,肿瘤负荷重,建议行转化治疗;
2)患者二线治疗已11周期,接近于最大获益,继续该方案转化治疗后手术的可能性小。患者年轻、微卫星不稳定,建议调整为免疫治疗。
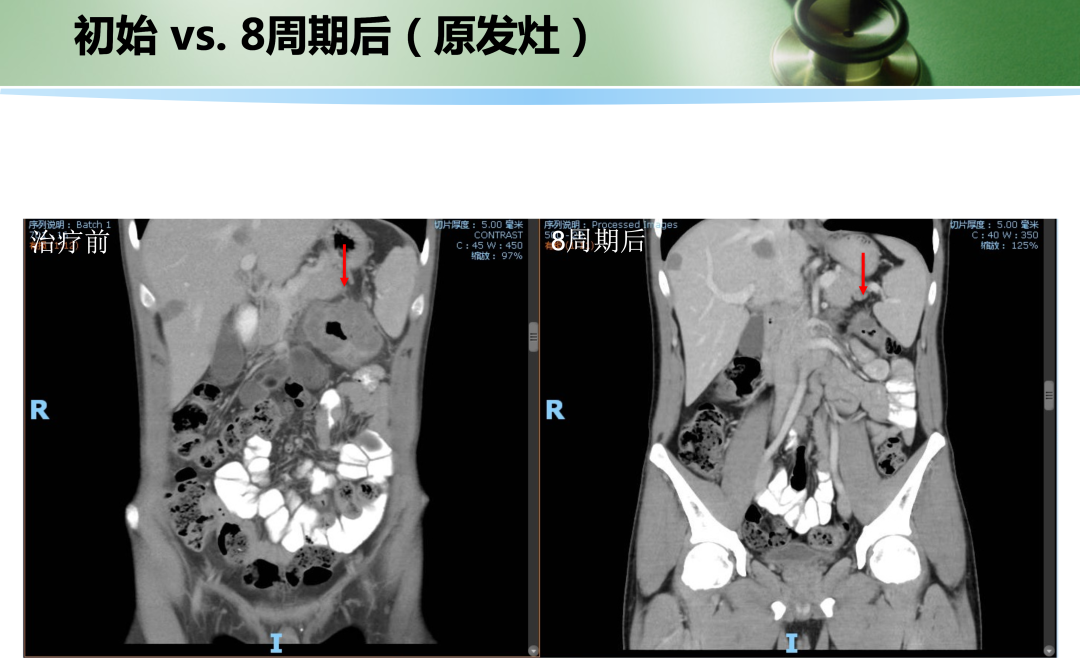
•治疗:于2019年2月至2019年4月开始抗PD-1(纳武利尤单抗)治疗,q2w,治疗4周期后,腹痛症状明显减轻,复查原发灶肠壁增厚减轻明显,肝内病灶稳定,仍不可切除。肿瘤标志物显著下降:CEA 25.6 ng/ml,CA199 244.3 U/ml。
• 2019年4月至2020年6月继续抗PD-1治疗,q2w ,治疗4周期(C5-8)。复查原发灶肠壁增厚继续减轻,肝内病灶稳定,仍不可切除。肿瘤标志物已降至正常:CEA 2.2 ng/ml,CA199 13.8 U/ml。
• 2019年6月和2019年8月继续抗PD-1治疗,q2w , 治疗4周期(C9-12),总计12周期。复查原发灶肠壁增厚同前相仿,肝内病灶直径同上次评效。肿瘤标志物继续在正常范围内:CEA 2.2 ng/ml,CA199 25.3 U/ml。
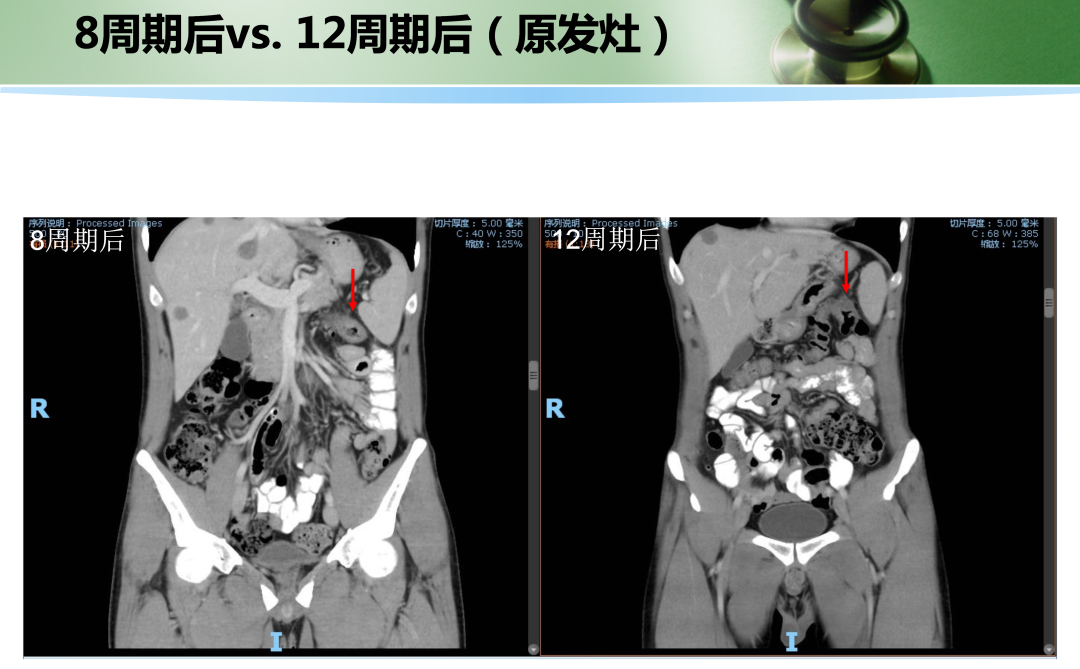
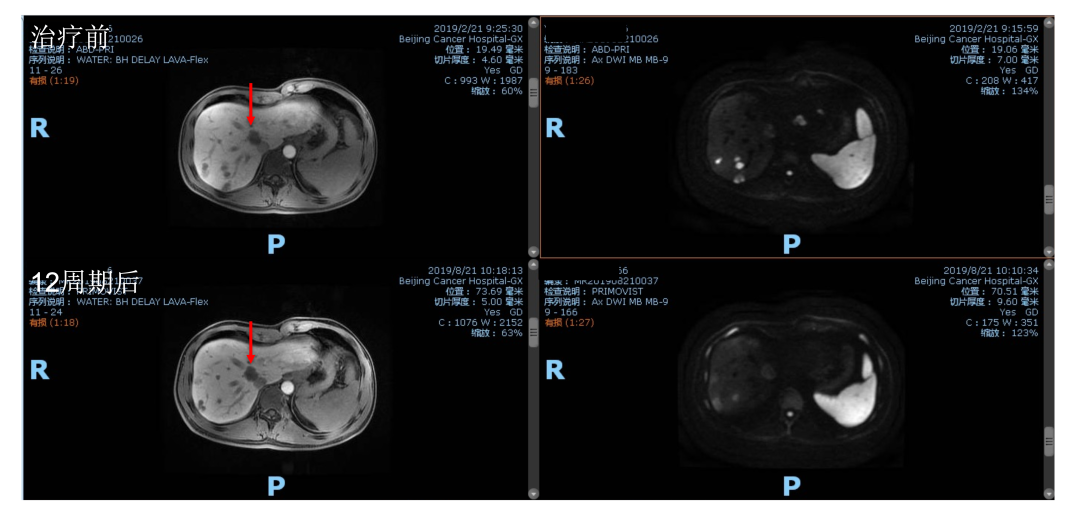
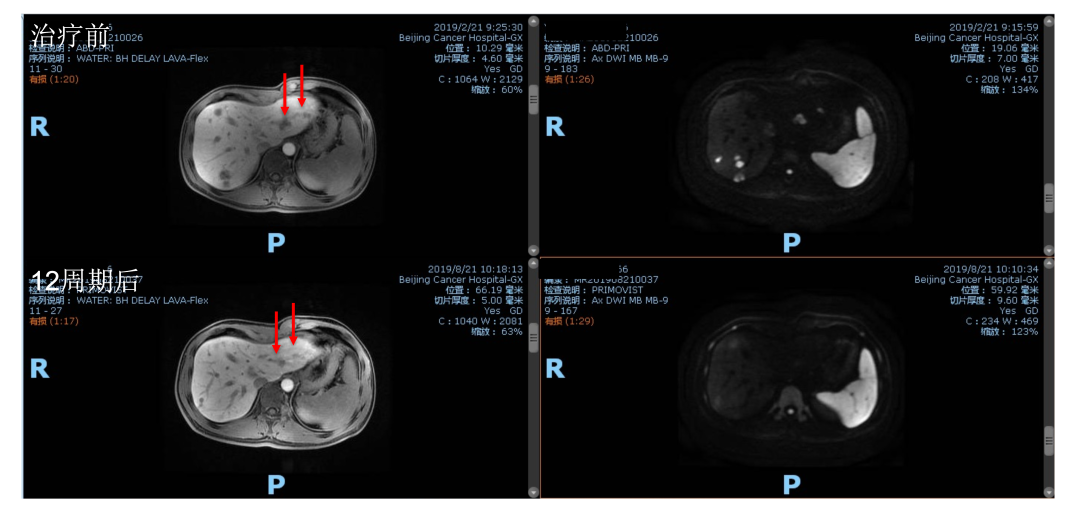
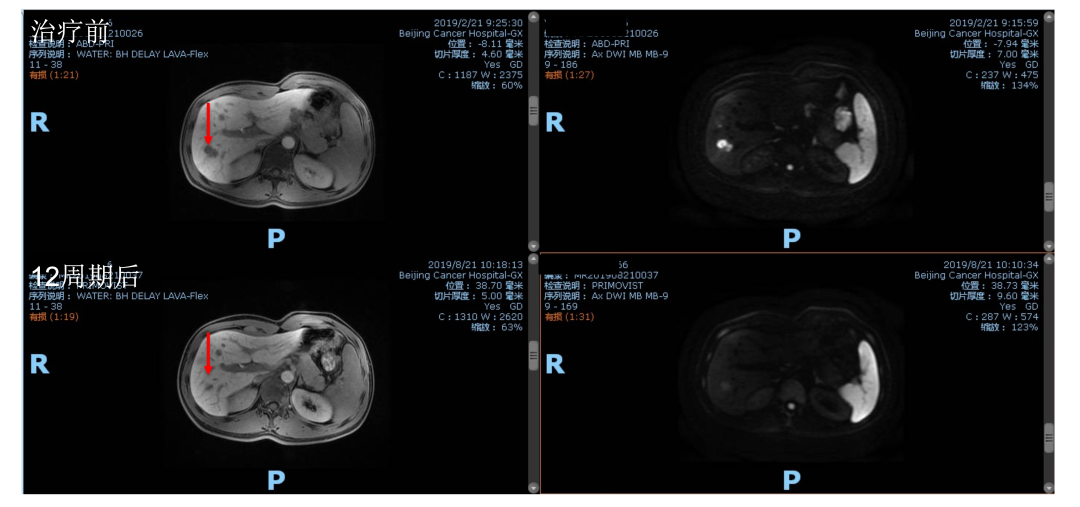
此时,肝转移仍然不可切除。
下一步该如何治疗,是此刻考验医生的难题:是继续免疫治疗?还是联合肝动脉灌注化疗?还是其他治疗方案?
• MDT讨论意见:
1.原发灶依然存在症状,不管是否为pCR也有手术指征;且免疫治疗12周期后不再继续缩小;
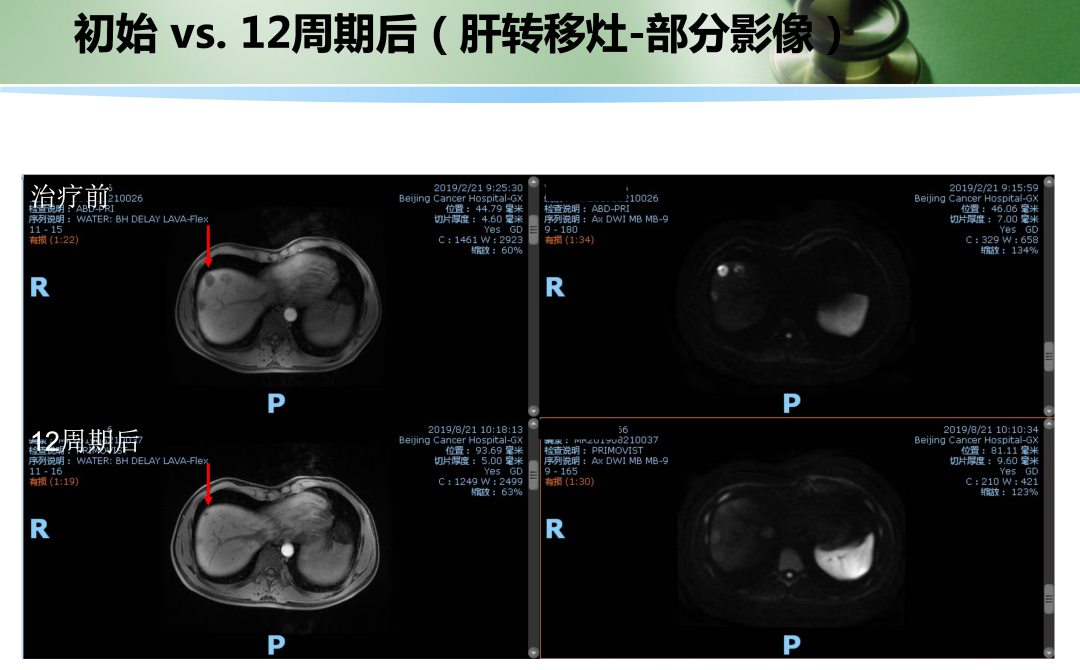
2.肝转移灶依然不可切除,且肿瘤不再缩小,MRI显示部分病灶仍存在活性信号,是否pCR不明确,建议切除活检,明确原发灶及肝转移免疫治疗后的肿瘤细胞残留状态。
3.根据病理结果,决定后续肝转移灶的处理策略。
• 治疗:于2019年9月20日行根治性左半结肠切除加肝S4病灶切除活检术。
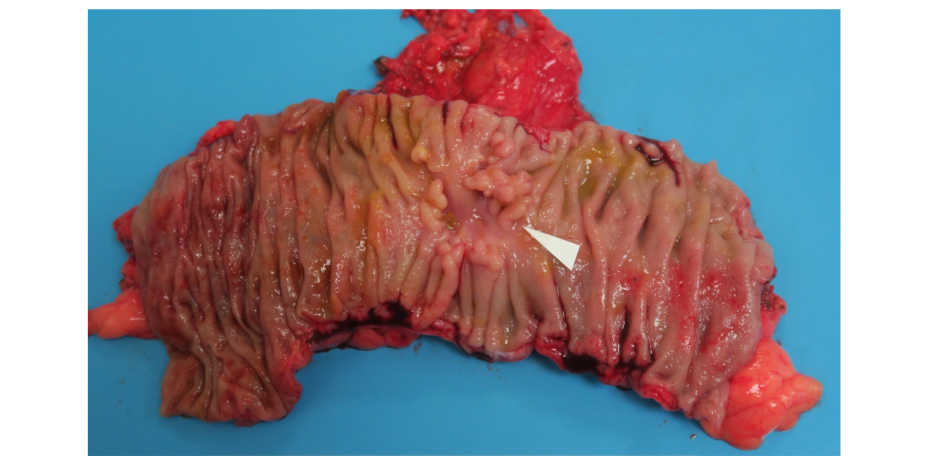

• 术后于2019年10月24日继续抗PD-1治疗, q2w,治疗4周期(C13-16)。复查肝内病灶SD。
2019年12月23日 因经济原因,调整为信迪利单抗,200 mg,q3w。2020年2月复查肝内病灶SD,CEA,CA199正常,继续当地用药。2020年5月复查肝内病灶SD,CEA,CA199正常。拒绝停药,继续当地用药。
• 2020年8月复查肝内病灶SD,CEA,CA199正常。肝S8病灶穿刺活检:见大片坏死及钙化,未见明确肿瘤细胞。拒绝停药,继续当地用药。
• 2020年11月复查肝内病灶SD(DWI高信号均消失),CEA, CA199正常。ctDNA: 未见明确有害突变。患者予停药(术后免疫治疗共进行约1年)。
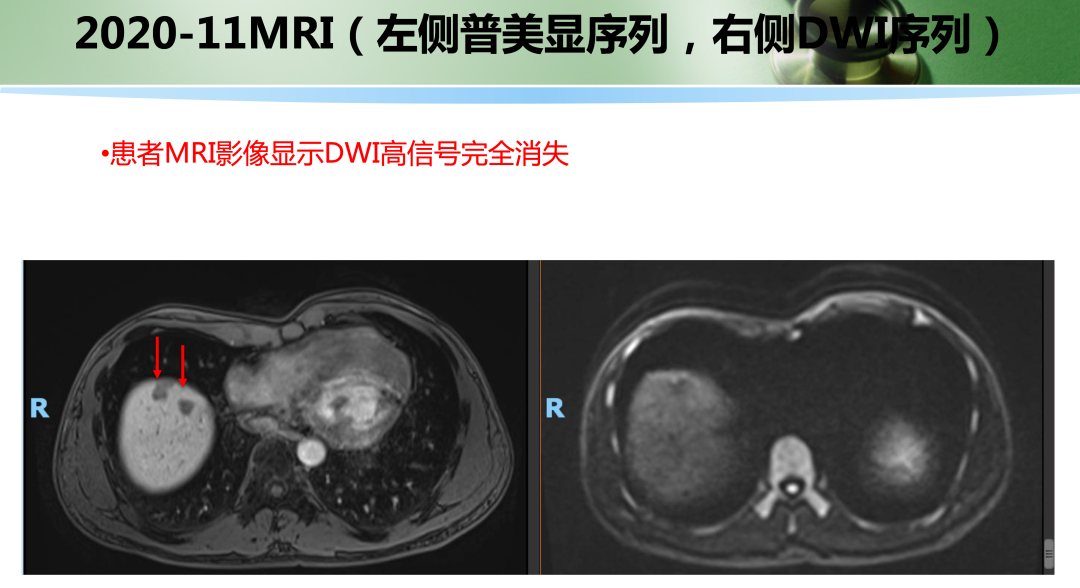
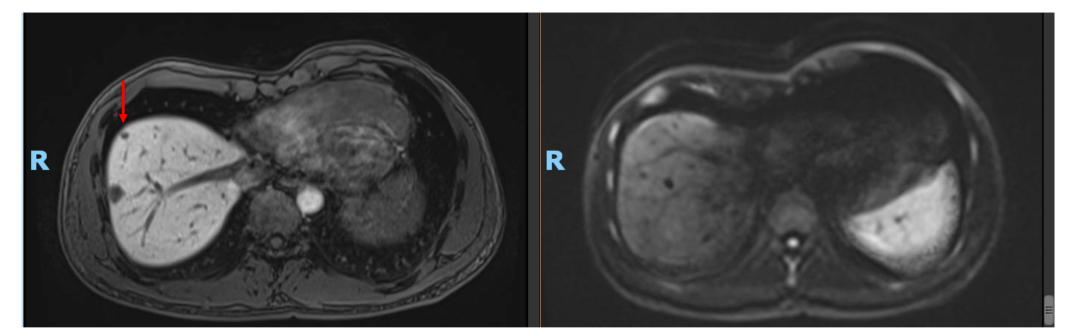
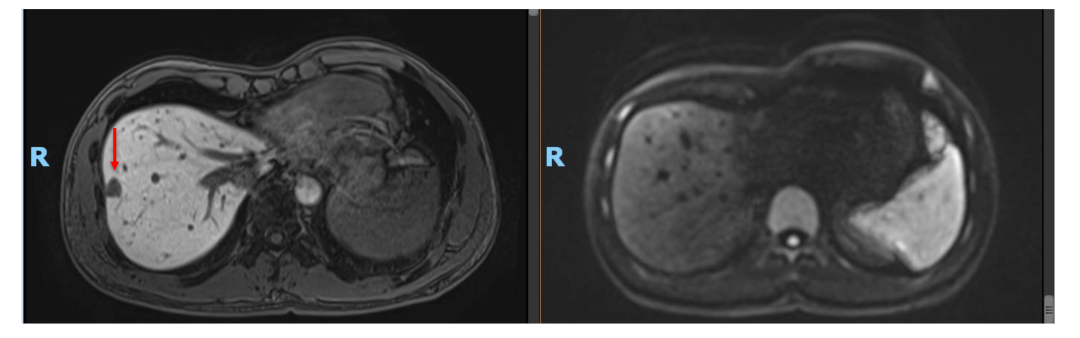
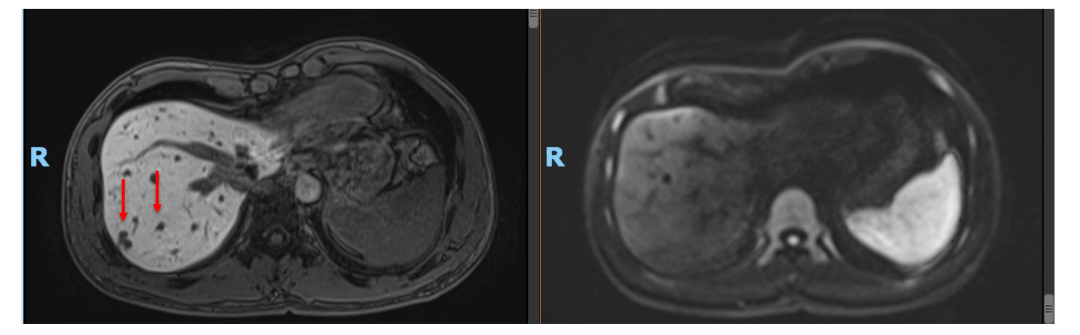
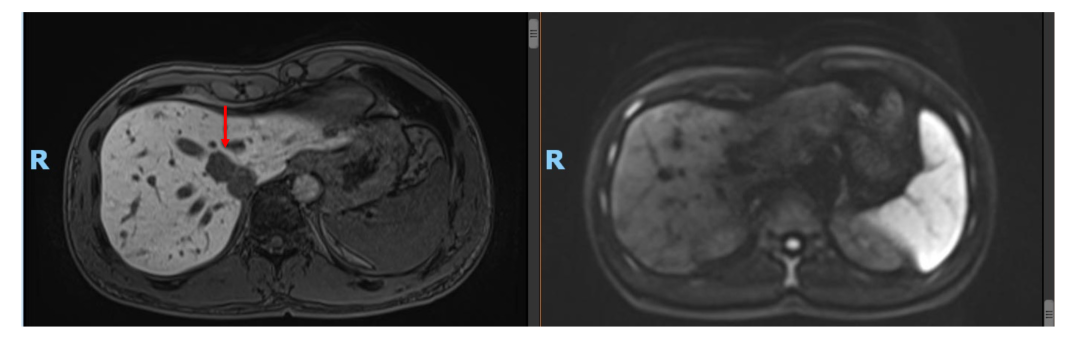
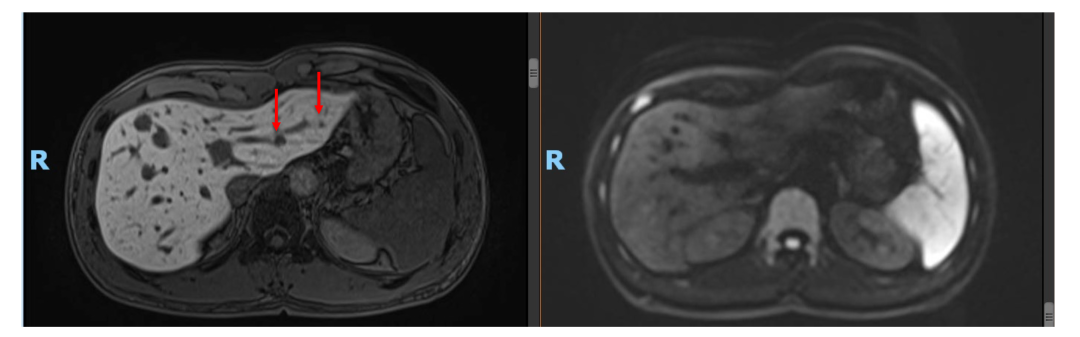
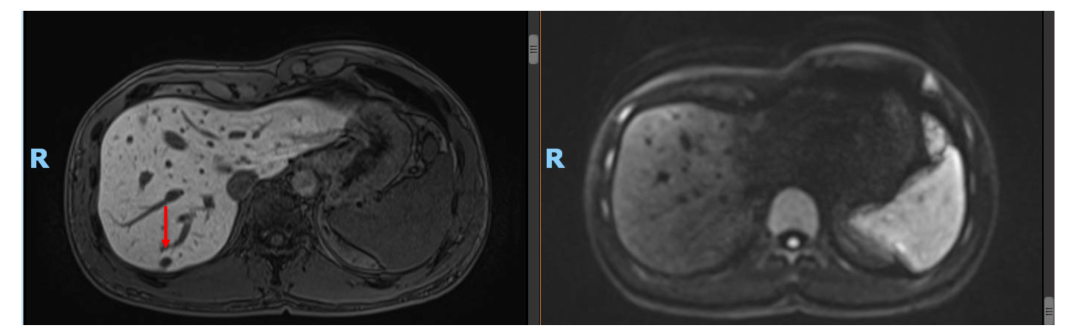
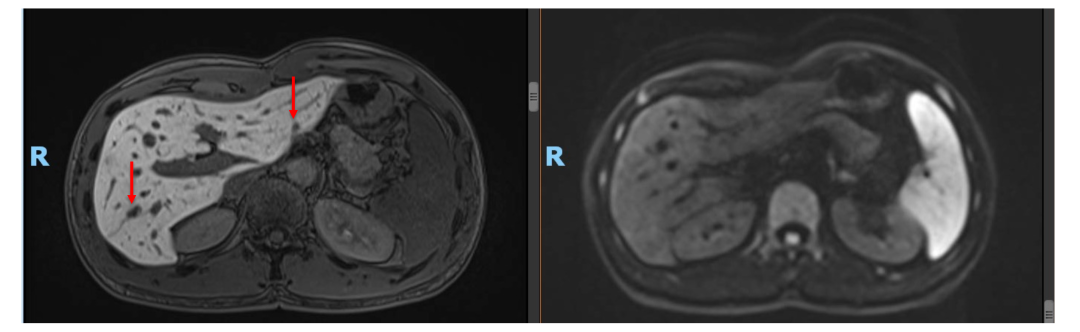
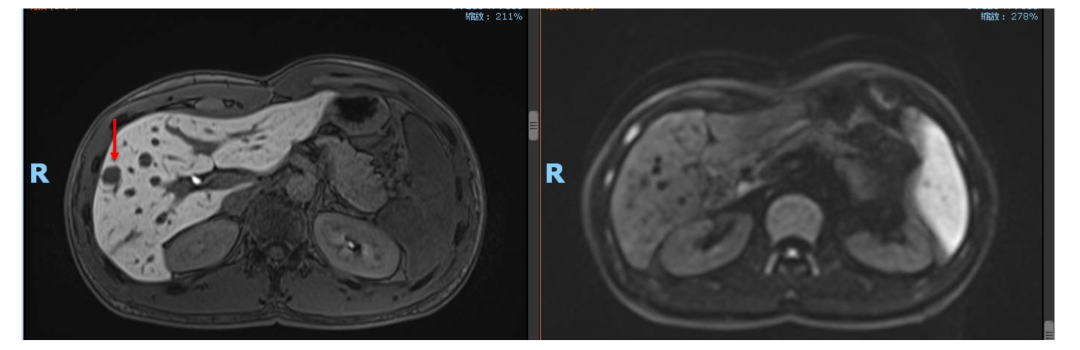
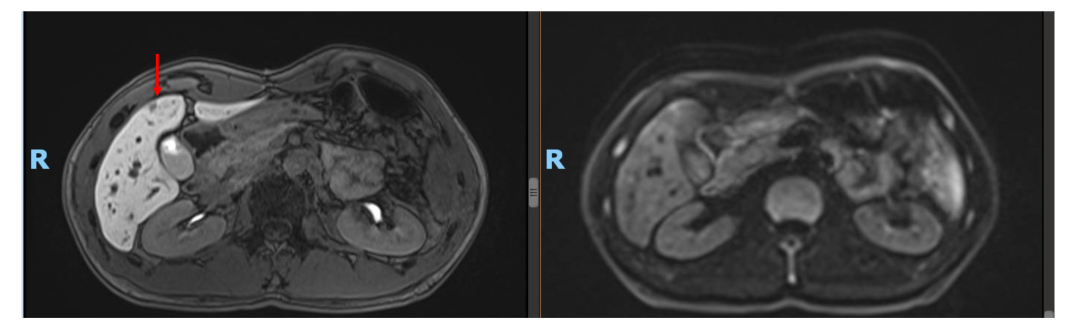
• 2021年4月复查,仍未见肿瘤活性征象,患者已正常工作及生活!
治疗体会
1)本患者MSI-H,代表着一类特殊类型的患者。在2018年开始治疗时, KENOTE-177研究结果并未发表,业界对于此类患者的一线治疗选择并未达成共识,一线究竟是选择常规化疗是否联合靶向还是免疫治疗尚存在争议。
当然事实可以看到本例患者在当地治疗时,对于一线常规化疗并不敏感。在当时的时代背景下,随着研究以及认识的更新,为其选择了免疫治疗,在今天看来选择是正确的。未来,对于MSI-H的亚组人群,免疫治疗会越来越多地被提入前线应用。
2)患者原发灶及肝转移灶反应并不完全一致,可能与肿瘤的微环境相关,如果可能,尽量以最小的代价将肠癌和肝转移两个矛盾化解为一个矛盾。
3)MSI-H的患者是选择单药抗PD-1还是联合CTLA-4或者联合化疗,未来会有更多结果发表以指导临床实践。
4)除了学术以外,患者复查时那种重获新生的喜悦也感染到了我,那种长舒一口气的感觉似乎也能感同身受。也衷心祝福这个年轻人后面的路越走越顺。
北京大学肿瘤医院肝胆外一 平台发布
查看更多