查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





为进一步提高罕见病诊疗规范化水平,保障医疗质量安全,国家卫生健康委组织专家对《第二批罕见病目录》中86个病种分别制定了诊疗指南。小编将重点梳理消化系统相关罕见病的临床诊疗指南,以期为临床医师的诊疗实践提供参考与指导。本期为大家带来原发性硬化性胆管炎诊治指南。


原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)是一类以肝内外胆管弥漫性炎症和纤维化(纤维-闭塞性胆管病)为特征的自身免疫性肝病,患者常合并炎症性肠病(以右半结肠炎最为常见)。PSC的诊断需结合胆汁淤积的临床和生化学表现,累及肝内外胆管的硬化性胆管炎影像学表现,合并炎症性肠病,纤维-闭塞性胆管病的组织学表现,以及排除其他病因引起的硬化性胆管炎,进行综合诊断。目前公认的PSC由三种类型,即经典的大胆管型PSC,PSC/自身免疫性肝炎重叠综合征(PSC/AIH overlap syndrome),以及小胆管型PSC(small duct PSC)。并发症包括胆道纤维化持续进展导致肝硬化,肝衰竭及胆管细胞癌。尽管近年来对其发病机制取得一定进展,开发出若干危险分层工具,但始终未找到能有效改善其预后的药物治疗方案,目前临床治疗主要包括经验性口服使用小~中等剂量的熊去氧胆酸,对有胆管显性狭窄者可行球囊扩张术或暂时性胆道支架植入以缓解胆道狭窄,但多数患者因胆道进行性毁损而进展至终末期肝病,最终需要进行肝移植手术。
目前研究认为PSC的主要发病机制是:在具有遗传易感性的个体,由于胆管细胞暴露于毒物或微生物(如肠道菌群及其代谢物通过逸漏的肠道迁移至肝脏),引起持续的免疫介导的胆管上皮损伤,最终导致胆管细胞衰老、胆汁淤积甚至进展性肝纤维化。PSC患者的一级亲属患病风险较健康人群增加11倍,目前已报道的23个高危基因位点。多项关于PSC的全基因组关联分析(genome-wide association analyses,GWAS)报道HLA-DR3(DRB1*03)、HLA-B8(HLA-B*08)以及DRB1*13(DR6)是该疾病的易感位点;此外,非HLA基因包括白介素IL-21和G蛋白偶联胆汁酸受体1(GPBAR1)TGR5也被证实参与PSC的疾病进展,TGR5基因的一个外显子区域单核苷酸多态性与PSC和溃疡性结肠炎显著相关。
PSC的发病率和患病率存在地域分布差异性,近来随着认识的提高及在IBD及胆汁淤积等患者MRCP筛查的开展,其发病率有逐年增加的趋势。目前报道的最高发病率来自北欧(芬兰和挪威分别是1.58/10万和1.3/10万)和北美(明尼苏达为1.47/10万);而最低的发病率为地中海盆地(意大利为0.1/10万)。欧洲的患病率在3.85/10万(英国)和31.7/10万(芬兰)之间。而北美的明尼苏达患病率为23.99/10万。新加坡在1989—1998年的流行病学资料显示其患病率为1.33/10万,而新西兰在2016年报道的患病率为13.17/10万(2008—2016年)。多数文献报道的PSC中位或平均确诊年龄为40~59岁,男性相对好发,其占比在51%~71.4%之间。PSC患者与IBD共病率达20.0%(新加坡)~88.1%(冰岛)。
目前关于我国PSC的流行病学、临床特征、危险因素和预后等资料的报道较少,笔者团队在2017年报道的本中心PSC和PSC/AIH重叠综合征患者的平均确诊年龄分别为42.3岁和40.7岁,PSC患者合并IBD的比例为19.8%。
PSC患者临床表现多样,多起病隐匿,15%~55%的患者诊断时无症状,而出现慢性胆汁淤积者大多数已有胆道狭窄或肝硬化。常见症状包括乏力、腹痛及皮肤瘙痒,其他可能出现的症状及体征包括体重减轻、黄疸和肝脾大等。黄疸多呈波动性或反复发作,有时可伴有中低热或高热及寒战。当PSC胆道出现显性狭窄时,患者可出现发热伴右上腹痛及肝生化异常,提示胆道感染的发生,严重者可能出现败血症。PSC的并发症包括门静脉高压、脂溶性维生素缺乏症、代谢性骨病等,还可伴有与其他自身免疫性疾病,如甲状腺炎、系统性红斑狼疮、风湿性关节炎及干燥综合征等。PSC患者发生肝胆系统及肠道恶性肿瘤的风险增加,因此临床随访时需监测并定期进行肿瘤筛查。
PSC患者的生化异常主要表现为胆汁淤积性改变,血清碱性磷酸酶升高是最常见的异常生化指标,常伴有γ-谷氨酰转移酶(GGT)的升高。但是,AKP升高的程度在病程中经常波动,甚至有时可以在正常范围。部分患者可见到转氨酶的2~3的升高,如果转氨酶高于该范围,则应考虑急性胆道梗阻或合并自身免疫性肝炎(AIH)的重叠综合征的可能性。血清胆红素水平在病程早期通常正常,在存在明显胆道狭窄或胆道纤维化进展时逐渐升高。病程进展至肝硬化、门静脉高压阶段可见到血清白蛋白水平降低、凝血功能异常(如PT、PTA或INR)及血小板减少异常。
PSC可检测出多种自身抗体,包括抗核抗体(ANA)、抗平滑肌抗体(SMA)、抗心磷脂抗体等,一般为低滴度阳性且缺乏特异性。而抗中性粒细胞胞浆抗体(包括pANCA和cANCA)对本病相对具有特异性,但与病情严重程度无关。部分患者可出现高γ-球蛋白血症,可表现为免疫球蛋白IgG或IgM水平轻-中度升高。值得注意的是,约9%~36%的PSC患者可出现血清IgG4轻度升高。但当血清IgG4≧135mg/dL时,应与IgG4相关硬化性胆管炎(IgG4-SC)鉴别。
典型的PSC影像学表现为肝内外胆管多灶性、短节段性、环形狭窄,间以肝内胆管扩张,胆管壁僵直、呈铅管样,因而呈串珠样或枯树枝样改变。高质量的MRCP显示胆道系统梗阻的准确性与ERCP相当,目前已成为诊断PSC的首选影像学检查方法。对于MRCP显影不理想的大胆管病变,或有症状的患者,怀疑机械性梗阻(结石、狭窄、肿瘤等)或高度疑诊胆管细胞癌时,需要ERCP协助确诊,同时还可对狭窄胆管细胞刷检或活检取样,对机械性梗阻进行治疗性干预。
肝活检对于诊断PSC并非必需。通常在怀疑为小胆管型PSC或者考虑合并AIH的重叠综合征可能时,建议患者完善肝活检术。PSC患者的组织学表现多为非特异性的,部分原因可能是受限于患者累及胆道树的异质性和穿刺标本的随机性。典型PSC的组织学表现包括胆管周围炎症伴纤维化,如“洋葱皮样”胆管周围纤维化;小胆管增生;胆管缺失等。约有5%的PSC患者为小胆管型PSC,病变仅累及肝内小胆管,此部分患者胆道成像早期无明显异常发现,肝活检对于诊断胆道影像正常的小胆管型PSC是必需的。PSC/AIH重叠综合征的肝脏组织学可见自身免疫性肝炎的组织学表现,典型表现包括界面性肝炎、淋巴-浆细胞浸润、肝细胞呈玫瑰花环样排列,以及淋巴细胞进入肝细胞的“穿入现象”等。
目前尚无国际上公认的PSC诊断标准,由于缺乏特异性的血清学及影像学诊断标志物,PSC诊断需结合患者临床表现、生化、影像学、组织学检查等多种证据,并排除继发性的胆道损伤因素进行综合诊断。根据2021年中华医学会肝病学分会发布的《原发性硬化性胆管炎诊断及治疗指南》,大胆管型PSC诊断标准为:
胆管影像学检查具备PSC典型特征。
以下标准至少满足一条:①胆汁淤积的临床表现及生化学改变(成人AKP升高、儿童GGT升高);②合并IBD的临床或组织学证据;③典型PSC肝脏组织学改变;(3)排除其他病因引起的继发性硬化性胆管炎。对于胆道成像无PSC典型表现的,如果满足以上标准第2条的2条以上或仅有PSC典型胆道影像学特征可疑诊PSC。
小胆管型PSC诊断标准为:
近期胆道影像学无明显异常改变。
典型PSC肝脏组织病理学改变。
排除其他因素所致胆汁淤积。如果患者胆道影像学无异常,肝脏组织学具有PSC特点但不典型时,若患者同时存在IBD临床或组织学证据以及胆汁淤积的生化改变时,也可诊断小胆管型PSC。
由于国际上目前并无制定关于PSC/AIH重叠综合征的指南规范,临床实践中广泛采用的是多数欧洲和美国研究中心报道的PSC/AIH诊断标准,即符合前述PSC诊断标准的同时,满足国际自身免疫性肝炎小组(IAIHG)的AIH诊断的简化标准。
是指一组由明确的病因引起,临床表现与影像学表现类似硬化性胆管炎的疾病。常见病因包括胆总管结石、胆道手术创伤、反复发作的化脓性胆管炎,肝胆恶性肿瘤(胆管细胞癌、肝细胞癌累及胆管、壶腹部癌、胆总管旁淋巴结转移压迫),胰腺疾病(胰腺癌、胰腺囊肿和慢性胰腺炎),缺血性胆道病,以及化疗、靶向治疗或免疫治疗等药物所致的胆管病等。详见表68-1。
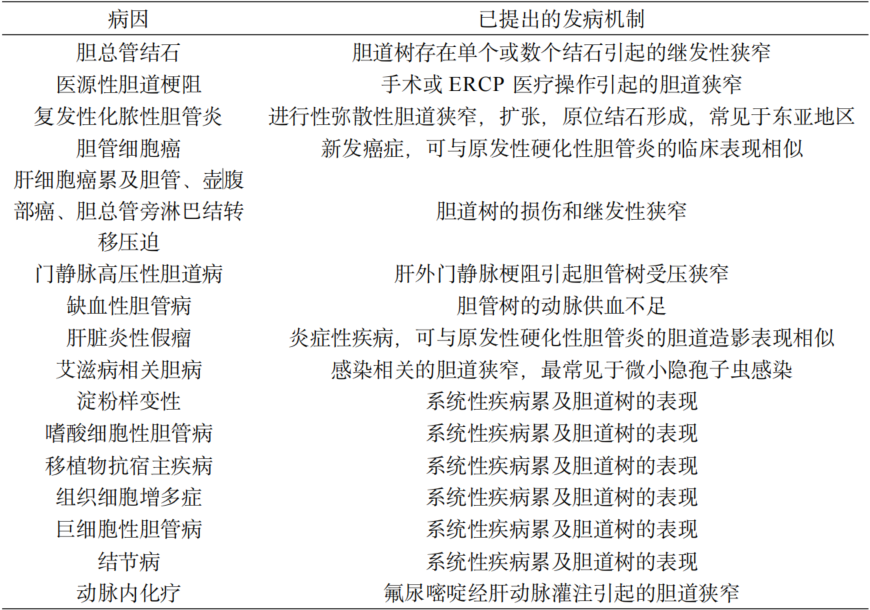
表 68-1 继发性硬化性胆管炎的病因总结
与PSC胆道影像学表现相似,鉴别困难。IgG4-SC属于IgG4相关性疾病(IgG4-RD)这一全身性自身免疫病累及胆管的表现,患者可能合并其他器官受累的表现,如自身免疫性胰腺炎(AIP)、下颌下腺炎、肾脏病变、腹膜后纤维化等,可伴有血清IgG4的明显升高,典型的组织学表现包括淋巴浆细胞浸润,IgG4阳性浆细胞浸润:IgG4阳性细胞占IgG阳性细胞比例大于40%或者每高倍镜视野下大于10个IgG4阳性浆细胞,伴显著纤维化,典型者可表现为席纹状纤维化、闭塞性静脉炎等表现。多数IgG4-SC患者对糖皮质激素治疗应答良好且具有更好的临床预后。
当PSC影像学表现为胆道狭窄甚至中断时,患者临床表现为胆汁淤积甚至胆道梗阻,与胆管细胞癌鉴别困难。腹部CT或MRI增强、PET-MRI检查对CCA的鉴别诊断有一定帮助,胆道镜、ERCP等内镜技术下细胞学刷检和病理检查,对CCA的特异度非常高,但灵敏度却低于30%。尽管PSC的多数胆道狭窄为良性的,但PSC患者继发CCA的风险增高,因此对于每个PSC和显性狭窄的患者都应注意排查CCA的可能性。
PBC、药物性肝损伤、AIH、慢性病毒性肝炎、酒精性肝病也可引起胆汁淤积性肝损伤,表现为AKP、GGT的升高,伴或不伴有胆红素水平的升高。询问既往史、完善免疫球蛋白、自身免疫性肝病抗体、病毒学标志物等相关检查可进行鉴别。对于有些非典型PSC,血清AKP仅轻度升高,或者是小胆管型PSC,需与上述疾病进行鉴别。
目前为止,国际PSC诊疗指南仍未明确推荐药物治疗方案。目前有多种药物试用于PSC患者,包括熊去氧胆酸(ursodeoxycholic acid,UDCA)、抗生素、免疫抑制剂,以及调脂药、益生菌等。内镜治疗对改善患者胆道狭窄和胆汁淤积症状有一定帮助,但并不改变患者的远期临床预后。肝移植手术仍是终末期PSC患者唯一有效的治疗方式。
(1)熊去氧胆酸(UDCA):熊去氧胆酸是目前PSC的治疗研究最广泛的药物,常规用量与其他胆汁淤积性肝病的治疗剂量相当[13~15mg/(kg·d)];有研究显示过高剂量的UDCA并无临床益处,甚至可能有害。
(2)UDCA联合胆汁酸衍生物等治疗:鉴于UDCA治疗PSC的局限性,其他胆汁酸衍生药物的治疗效果也得到广泛关注。临床前研究提示norUDCA有望成为PSC治疗的候选药物,但仍需来自人体的研究证据以及多中心的Ⅱ期临床试验进一步验证。FXR激动剂因其可降低肝内胆汁酸浓度用于胆汁淤积性肝病,更为重要的是,由于肠道菌群在PSC发病机制中的重要作用,FXR可诱导FGF19的生成,抑制胆汁酸的合成、减少肠道细菌的过度生长以及肠道渗透性,介导肠道中的抗炎作用,因此FXR激动剂的应用可能在PSC治疗中具有益处。FXR的配体——奥贝胆酸(OCA)已被用于PBC的治疗,但其对于PSC患者的治疗疗效仍须进一步地研究探索。
(3)免疫抑制剂:硫唑嘌呤和糖皮质激素可用于PSC/AIH重叠综合征的患者。其他免疫抑制剂包括吗替麦考酚酯(MMF)、他克莫司、环孢素、甲泼尼龙、布地奈德以及生物制剂依那西普、英夫利西单抗等在单纯型PSC(指不合并AIH的PSC患者,包括大小胆管型两种亚型)的应用都有研究报道,但结果均不尽如人意。
(4)抗生素:多项研究指出,口服万古霉素对有助于部分PSC患者的临床症状和生化改善,特别是对于儿科患者,但尚未经随机临床试验证实。一项初步研究显示,米诺环素治疗一年,PSC患者碱性磷酸酶和Mayo风险评分均有显著下降。UDCA联合甲硝唑治疗PSC患者可改善患者血清生化、Mayo风险评分,但对疾病进展并无显著影响。一项开放标签前瞻性临床研究表明,给予PSC患者口服利福昔明12周后,并未观察到患者血清生化和临床症状改善等显著益处。
欧洲肝病学会2017年指南推荐,经MRCP确诊的PS患者,存在显著胆管狭窄时,进行内镜下治疗,同时行导管取样(毛刷细胞学分析、胆道内活检术),其临床症状有望缓解(指南推荐级别:强推荐,低质量证据级别)。值得注意的是,不推荐在支架置入前常规应用胆道括约肌切开术,否则会增加术后反复胆道感染的风险。目前推荐短时间的支架置入,有研究显示,短期留置(1~2周)和标准留置(8~12周)对患者的获益相当。
EASL推荐对符合下述条件的患者可以反复进行球囊扩张术:(1)胆道显著狭窄是引起患者瘙痒、胆管炎反复发作或者胆汁淤积症状明显加重的病因;(2)患者对已行球囊扩张术应答良好(指南推荐级别:弱推荐,极低质量证据级别)
肝移植是终末期PSC患者的唯一有效治疗方案,但对于PSC推荐最佳的肝移植时机难度较大。随着手术技巧和术后管理水平的提高,肝移植术后早期死亡率显著下降,但有关术后胆道狭窄和PSC复发以及再移植的报道增多。
一项针对1990年至2006年间德国多中心的回顾性研究指出,共有335例PSC患者进行肝移植,患者及移植物的1年、5年、10年生存率分别是90.7%、84.8%和79.4%,79.1%、69%和62.4%。其中,术后胆道狭窄发生于36.1%的患者,平均发病时间为移植后3.9年;PSC复发见于20.3%的患者,平均发病时间为4.6年。多项研究指出,患者接受肝移植时的年龄较轻和移植后活动性溃疡性结肠炎的存在,是PSC复发的危险因素。
治疗过程中需定期监测患者胆汁淤积、瘙痒症状及胆道影像学变化,应注意监测这类患者肝胆系统及肠道肿瘤的合并风险。对确诊PSC的患者,即使无腹泻、便血等肠道症状,也建议进行肠镜检查以排查有无合并炎症性肠病的可能。对于诊断PSC/AIH重叠综合征的患者,给予糖皮质激素及其他免疫抑制剂使用时,需关注药物相关的感染风险、骨质疏松、消化道出血等风险。
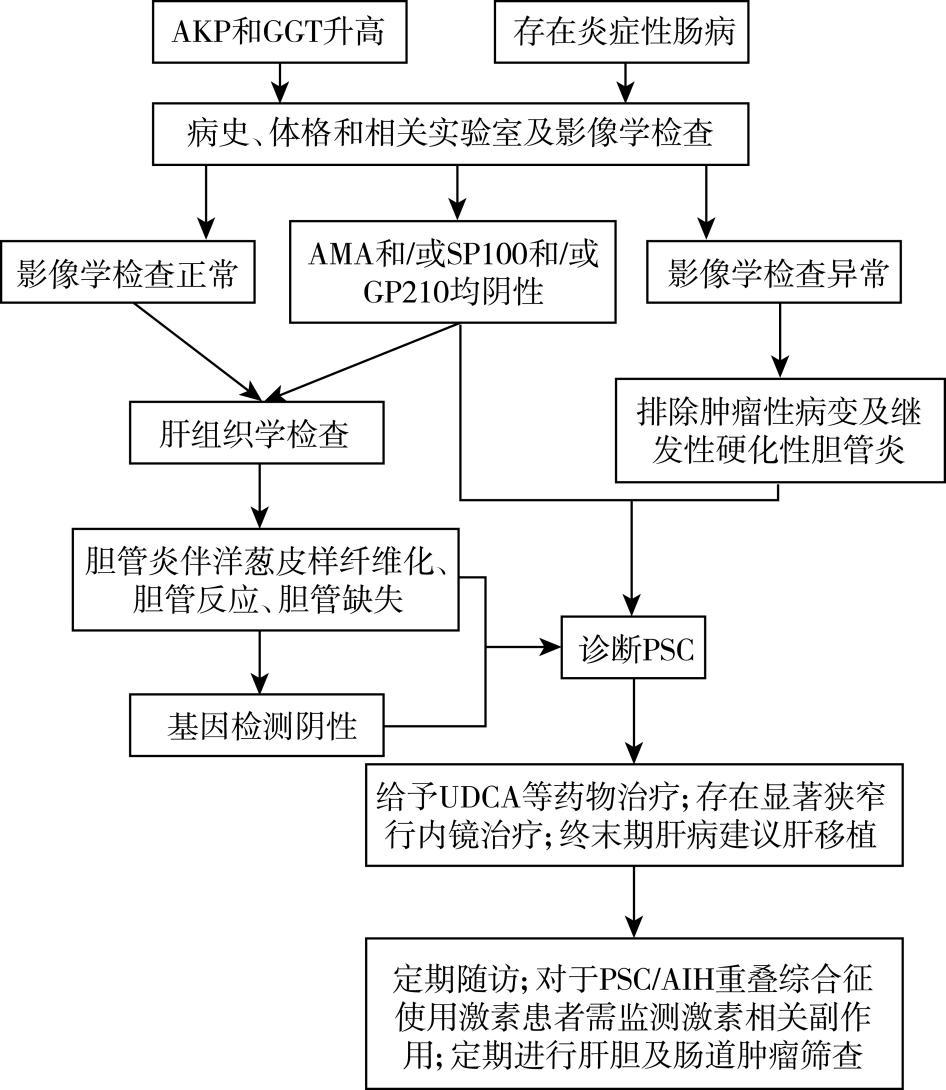
图 68-1 原发性硬化性胆管炎诊疗流程
[1] 中华医学会肝病学分会,中华医学会消化病学分会,中华医学会感染病学分会.原发性硬化性胆管炎诊断和治疗共识(2015).肝脏,2015,20(12):983-990.
[2] 中华医学会肝病学分会.原发性硬化性胆管炎诊断及治疗指南(2021).临床肝胆病杂志,2022,38(1):50-61.
[3] Trivedi PJ, Bowlus CL, Yimam KK, e t a l. Epidemiology na tura l history, and outcome s of prima ry s cle rosing cholangitis: a systema tic review of popula tion-ba s ed studie s. Clin Ga stroente rol Hepa tol,2022,20(8):1687-1700.
[4] Lian M, Li B, Xiao X, e t a l. Compa ra tive clinica l cha ra cte ristics and na tura l history of thre e va riants of s cle rosing cholangitis: IgG4-re la ted SC, PSC/AIH and PSC a lone . Autoimmun Rev, 2017,16(8):875-882.
[5] Trivedi PJ, Hirs chfie ld GM. Review a rticle : ove rlap syndrome s and autoimmune live r dis e a s e . Aliment Pha rma col The r,2012,36:517-533.
[6] La za ridis KN, LaRusso NF. Prima ry s cle rosing cholangitis. N Engl J Med, 2016, 375:2501-2502.
[7] Hov JR, Ka rls en TH. The microbiota and the gut-live r axis in prima ry s cle rosing cholangitis. Na t Rev Ga stroente rol Hepa tol,2023,20(3):135-154.
[8] Schramm C, Ea ton J, Ringe KI, e t a l. Re commenda tions on the us e of magne tic re sonance imaging in PSC-A position sta tement from the Inte rna tiona l PSC Study Group. Hepa tology,2017,66(5):1675-1688.
[9] Sa rka r S, Bowlus CL. Prima ry s cle rosing cholangitis: multiple phenotype s, multiple approa che s. Clin Live r Di,2016,20(1):67-77.
[10] Ve ste rhus M, Ka rls en TH. Eme rging the rapie s in prima ry s cle rosing cholangitis: pa thophysiologica l ba sis and clinica l opportunitie s. J Ga stroente rol , 2020 , 55(6):588-614.
[11] We ismülle r TJ, Trivedi PJ, Be rgquist A, e t a l. Pa tient age , s ex, and inflamma tory bowe l dis e a s e phenotype a ssocia te with cours e of prima ry s cle rosing cholangitis. Ga stroente rology,2017,152(8):1975-1984.
[12] Dyson JK, Beue rs U, Jone s DEJ, e t a l. Prima ry s cle rosing cholangitis. Lance t,2018, 391(10139):2547-2559.
[13] Arizumi T, Ta zuma S, Is ayama H, e t a l. Ursodeoxycholic a cid is a ssocia ted with improved long-te rm outcome in pa tients with prima ry s cle rosing cholangitis. J Ga stroente rol,2022,57(11):902-912.
[14] Aabakken L, Ka rls en TH, Albe rt J, e t a l. Role of endos copy in prima ry s cle rosing cholangitis: Europe an Socie ty of Ga strointe stina l Endos copy (ESGE) and Europe an Associa tion for the Study of the Live r (EASL) clinica l guide line . Endos copy , 2017 , 49(6):588-608.
[15] Bowlus CL, Arrivé L, Be rgquist A, e t a l. AASLD pra ctice guidance on prima ry s cle rosing cholangitis and cholangioca rcinoma . Hepa tology,2023,77(2):659-702.
[16] Assis DN, Bowlus CL. Re cent advance s in the management of prima ry s cle rosing cholangitis. Clin Ga stroente rol Hepa tol,2023,21(8):2065-2075.
来源:国家卫生健康委官网
查看更多