查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





前言
肝内胆管癌(ICC)起源于肝内胆管上皮细胞,其发病率在原发性肝癌中仅次于肝细胞癌,占比约10%~15%1。肝内胆管癌具备较强侵袭性,患者初次就诊时往往已是晚期,因此其预后不佳。近年来,以PD-(L)1和CTLA-4抑制剂为代表的免疫治疗在胆道恶性肿瘤领域取得突破,展现出生存获益2,3。双重免疫检查点抑制剂联合方案也显示出积极疗效4,5,为肝内胆管癌患者提供新的治疗选择。本文报告一例IIIB期新发肝内胆管癌伴肝内多发转移的患者,经多学科团队(MDT)评估无法手术,接受艾帕洛利托沃瑞利单抗(艾托组合抗体,PD-1/CTLA-4组合抗体)单药治疗3个周期后,评估显示达到完全缓解(CR)。
本报特别邀请山东第一医科大学附属省立医院吴亚光教授分享此病例并点评。
病例分享

患者为男性,61岁,右上腹痛半月余,既往检查发现丙肝未治疗,无慢性疾病病史,无家族性肿瘤病史。

2025年4月16日,外院CT检查符合肝左叶胆管细胞癌并左叶胆管扩张MR表现,肝内强化结节转移可能,肝门及腹膜后多发肿大淋巴结考虑转移。4月17日肝穿刺活检示:(左肝)送检肝组织内查见腺癌。
上腹部MR平扫+动态增强+MRCP:肝左叶见类圆形稍长T1稍长T2信号肿物,范围约7.2x5.4x5.1cm;肝内多发异常强化结节,考虑转移;肝门、腹腔、腹膜后、右侧心膈角区、右侧脚后见多发增大淋巴结,较大者短径约1.1cm。影像学符合恶性肿瘤MRI表现,倾向肝内胆管细胞癌,IIIB期。
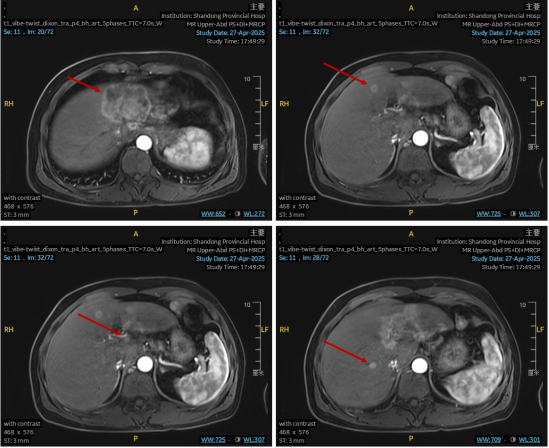
•医学影像科主任意见为肝脏左叶胆管恶性肿瘤,肝内多发转移瘤,肝门、腹膜后淋巴结肿大。
•重症医学科、麻醉科主任意见为患者无手术指征。
•肿瘤内科主任意见为患者属于肿瘤进展期,无法达到根治性切除,可采用免疫联合化疗。
综上所述,肝胆外科主任意见为患者肝胆存在转移灶,无手术指征,可采用免疫联合化疗治疗方案。
射频消融:2025年4月30日,行肝左内叶实性占位超声引导下射频消融。
双免治疗:2025年5月1日,行双免治疗。给予艾托组合抗体200mg,静脉输注,每三周为一周期。分别于2025年5月22日完成第二周期、2025年6月12日完成第三周期、2025年7月3日完成第四周期、2025年7月22日完成第五周期给药。
影像学复查:2025年6月30日,上腹部MR平扫+动态增强显示:肝内胆管癌原发灶未见确切显示,肝内高强化结节未见确切显示,前片所示腹腔、腹膜后及扫及右侧心膈角区、右侧膈脚后多发增大淋巴结,现部分较前缩小,较大者短径约为0.6cm,评估为完全缓解(CR)。
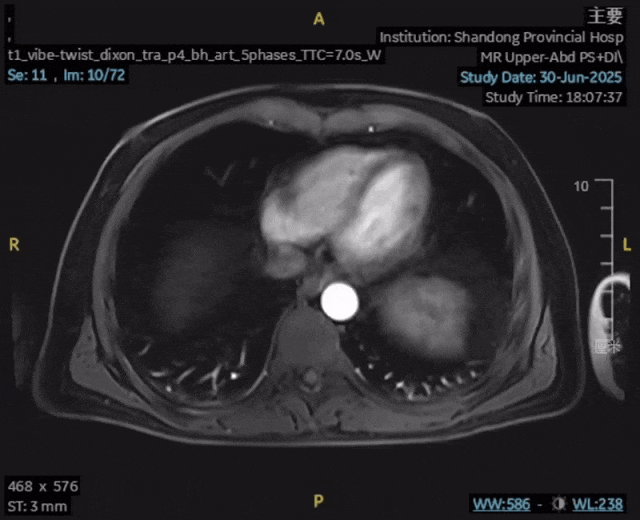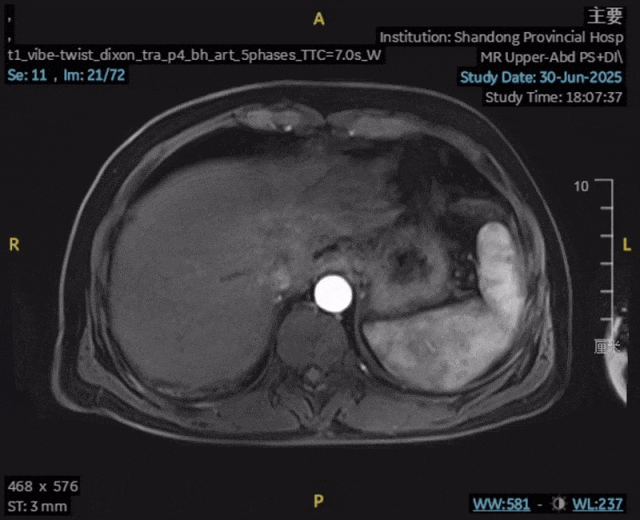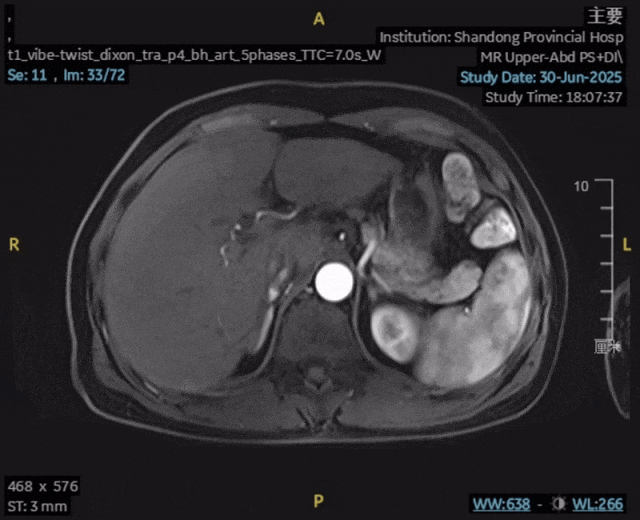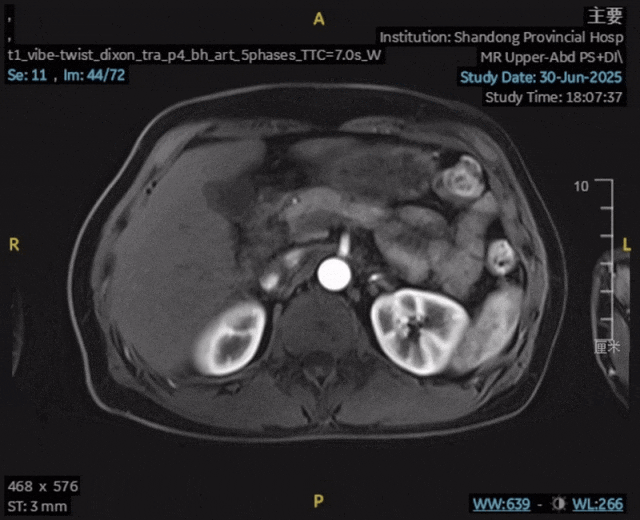
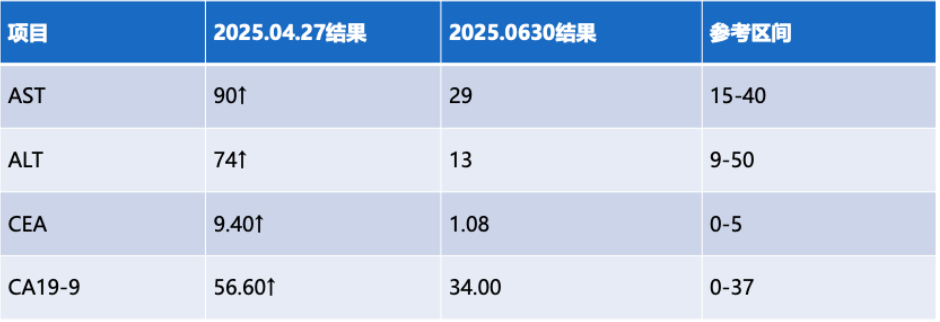
检验指标:肿瘤标志物和肝功能均恢复至正常范围。
专家点评

吴亚光 教授
山东第一医科大学附属省立医院
肝胆外科 主任医师
肝内胆管癌(ICC)作为一种源自肝内胆管上皮细胞的恶性肿瘤,其发病率在原发性肝癌中仅次于肝细胞癌,占比约10%-15%。由于ICC特殊的解剖位置和侵袭性较强的生物学特性,多数患者在确诊时已处于中晚期,导致仅有20%-30%的患者能够获得手术切除的机会,而这也是目前唯一可能根治ICC的手段。手术切除后,患者的5年总生存(OS)率也仅徘徊在20%-40%之间,术后复发率却高达56.5%-88.4%。因此,对于无法手术的ICC患者,如何通过有效的局部治疗和系统治疗控制肿瘤生长、延长生存期,成为临床治疗的关键挑战。
在传统治疗手段中,化疗是中晚期ICC的常用策略之一。以吉西他滨联合顺铂(GC)的化疗方案,曾凭借III期ABC-02研究的结果,作为一线首选方案长达12年。该研究显示,相较于单药吉西他滨,GC方案将患者的无进展生存期(PFS)延长至8.0个月,总生存期(OS)延长至11.7个月,肿瘤控制率提升至81.4%。但化疗存在明显局限性,不仅疗效有限,而且患者常需承受较大的副作用,如GC方案中性粒细胞减少症的发生率较高。此外,靶向治疗在ICC中的应用也面临诸多问题,即使部分患者存在靶点阳性,使用靶向药物数月后也容易产生耐药,且药物治疗时机的选择尚无定论,一线使用还是化疗进展后二线使用,目前仍缺乏明确的临床指导。
近年来,免疫治疗的兴起为ICC的治疗格局带来了新的变革,逐渐成为重要的治疗组成部分。免疫检查点分子CTLA-4和PD-L1在肿瘤免疫逃逸机制中发挥着关键作用。一项针对290例ICC患者的生物标志物研究发现,肿瘤浸润淋巴细胞中CTLA-4表达显著升高,并且PD-L1高表达和/或CTLA-4高表达的肿瘤浸润淋巴细胞可作为预测ICC患者总生存期和复发风险的重要指标。这一发现为免疫治疗靶向CTLA-4和PD-L1提供了坚实的理论依据。
多项小样本临床研究进一步证实了双靶点免疫治疗的可行性。例如,IMMUCHEC研究评估了度伐利尤单抗(D)和曲美木单抗(T)联合吉西他滨(Gem)或吉西他滨和顺铂(Cis)对比吉西他滨和顺铂在初治胆管癌和胆囊癌患者中的治疗效果。虽然该研究未达到改善客观缓解率(ORR)的主要终点,但GC联合度伐利尤单抗和单剂量曲美木单抗治疗在中位OS上呈现出延长趋势。BilT-015研究也表明,PD-L1联合CTLA-4单抗在ICC患者中展现出积极疗效。这些研究共同预示着,针对PD-1/PD-L1和CTLA-4通路的联合治疗,有望通过协同作用增强抗肿瘤免疫应答,为ICC患者带来新的生机。
回到本病例,患者确诊为ⅢB期肝内胆管癌,伴有肝内多发转移和淋巴结转移。经多学科协作(MDT)团队全面且深入的讨论与评估,鉴于肿瘤的广泛播散和患者的身体状况,明确其已不具备手术治疗的条件。基于患者的具体病情特点和当前的临床研究证据,治疗团队精心制定了“局部治疗联合双靶点免疫治疗”的个体化治疗方案。首先采用射频消融治疗对局部病灶进行控制,随后给予艾托组合抗体进行系统治疗,给药方案设定为200mg每三周一次。
经过3个周期的治疗,患者取得了令人瞩目的临床疗效。依据mRECIST标准进行影像学评估,患者达到了完全缓解(CR),不仅原发肿瘤病灶完全消失,肝内转移灶和肿大的淋巴结也实现了“三重缓解”。与此同时,肿瘤标志物CEA和CA19-9水平大幅下降至正常范围,肝功能指标(如ALT、AST、胆红素等)也恢复正常,且在整个治疗过程中,患者并未出现明显的不良反应,如免疫相关肺炎、结肠炎等常见的免疫治疗不良反应。这一显著的治疗效果充分表明,对于经MDT评估为不可切除的ICC患者,在局部治疗的基础上联合PD-1/CTLA-4双靶点免疫治疗,有可能在部分患者中实现快速且深度的病情缓解,为中晚期ICC患者带来显著的临床获益。
本病例中使用的艾托组合抗体,作为全球首个获批上市的由MabPair平台设计生产的双功能组合抗体,具有独特的分子设计和显著的临床优势。它能够在免疫应答的启动阶段,通过抑制CTLA-4通路,有效促进T细胞的活化和增殖;在免疫应答的效应阶段,通过阻断PD-1通路,增强T细胞对肿瘤细胞的识别和杀伤能力,从而实现双重调节机制,产生强大的协同抗肿瘤效应。与传统的单靶点药物或简单联合用药相比,艾托组合抗体在设计上更加注重安全性与疗效的平衡。通过对分子结构的优化,显著降低了CTLA-4相关的毒性暴露,如常见的严重胃肠道反应、皮肤毒性等;同时,确保了PD-1抑制的充分活性,在提高治疗效果的同时,极大地改善了患者的耐受性。
当然,单个病例的成功并不能直接推广至所有ICC患者,该治疗方案的长期疗效和安全性仍需要更多大规模临床数据的验证。目前,医疗团队已制定详细计划,对该患者展开长期随访,密切监测肿瘤复发情况、药物不良反应以及患者的生存质量,以全面评估长期治疗获益。与此同时,相关临床研究也在积极推进,旨在积累更多关于艾托组合抗体在肝内胆管癌治疗中的循证医学证据,包括不同分期患者的疗效差异、与其他治疗手段(如化疗、靶向治疗)的联合应用效果等。
展望未来,随着对ICC发病机制和肿瘤微环境研究的不断深入,以及免疫治疗药物研发的持续创新,双靶点免疫治疗联合局部治疗有望成为不可切除ICC患者的重要治疗策略。MDT模式的广泛推广,将进一步优化治疗方案的个体化制定,确保每一位患者都能获得最适宜的治疗。我们有充分的理由相信,在多学科协作和创新药物的共同推动下,ICC的治疗格局将不断优化,为更多患者带来长期生存的希望,显著改善ICC患者的预后和生活质量。
专家简历

医学博士 硕士研究生导师
在肝胆领域共发表论文10余篇,其中SCI收录2篇,中华系列杂志4篇,主编专著1部;对肝癌、肝血管瘤、肝内外胆管结石、胆道疾病、肝门部胆管癌、阻塞性黄疸、胰腺肿瘤、门脉高压症上消化道出血等疾病诊治有着丰富的临床经验,尤其是巨大肝肿瘤,复杂胰腺胆道等
近年来主要开展肝脏,胰腺肿瘤的腹腔镜微创治疗
参考文献
1.Zhang H, Yang T, Wu M, Shen F. Intrahepatic cholangiocarcinoma: Epidemiology, risk factors, diagnosis and surgical management. Cancer Letters. 2016;379(2):198-205. doi:10.1016/j.canlet.2015.09.008
2. Oh DY, Ruth He A, Qin S, et al. Durvalumab plus Gemcitabine and Cisplatin in Advanced Biliary Tract Cancer. NEJM Evidence. 2022;1(8):EVIDoa2200015. doi:10.1056/EVIDoa2200015
3. Kelley RK, Ueno M, Yoo C, et al. Pembrolizumab in combination with gemcitabine and cisplatin compared with gemcitabine and cisplatin alone for patients with advanced biliary tract cancer (KEYNOTE-966): a randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet. 2023;401(10391):1853-1865. doi:10.1016/S0140-6736(23)00727-4
4. Vogel A, Boeck S, Waidmann O, et al. 52MO A randomized phase II trial of durvalumab and tremelIMUmab with gemcitabine or gemcitabine and cisplatin compared to gemcitabine and cisplatin in treatment-naïve patients with CHolangio- and gallbladdEr Carcinoma (IMMUCHEC). Annals of Oncology. 2022;33:S563. doi:10.1016/j.annonc.2022.07.080
5. Sahai V, Griffith KA, Beg MS, et al. A randomized phase 2 trial of nivolumab, gemcitabine, and cisplatin or nivolumab and ipilimumab in previously untreated advanced biliary cancer: BilT-01. Cancer. 2022;128(19):3523-3530. doi:10.1002/cncr.34394
6.Dimitrios M, Manisha P, Charles K, et al. IAdvances in the treatment of intrahepatic cholangiocarcinoma: An overview of the current and future therapeutic landscape for clinicians. CA Cancer J Clin. 2023;73(2):198-222. doi: 10.3322/caac.21759
7.Ramy ED, Timothy PM, Aslam E. Intrahepatic Cholangiocarcinoma. Surg Oncol Clin N Am. 2019;28(4):587-599. doi: 10.1016/j.soc.2019.06.002
8. Guo XJ, Lu JC, Zeng HY, et al. CTLA-4 Synergizes With PD1/PD-L1 in the Inhibitory Tumor Microenvironment of Intrahepatic Cholangiocarcinoma. Front Immunol. 2021;12. doi:10.3389/fimmu.2021.705378
审校 | 山东第一医科大学附属省立医院 吴亚光教授
查看更多