查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





自身免疫性胰岛素受体病(autoimmune insulin receptopathy, AIR),又称B型胰岛素抵抗(type B insulin resistance,TBIR)。是由于胰岛素受体自身抗体(insulin receptor auto-antibodies,IRAs)导致的一种罕见病。AIR好发于非洲裔美国女性,主要临床表现为高血糖、黑棘皮征、自身免疫性疾病等,少数患者病程中会出现低血糖。
由于AIR非常罕见,目前确切的患病率不详。对该病的描述大多数来自个案报道或病例系列报道,最大的纵向队列来自美国国立卫生研究所(National Institutes of Health, NIH),该纵向队列对24名患者进行了为期28年的跟踪研究。在该队列中,83%的患者为女性,88%的患者为非洲裔美国人。发病年龄12~78岁,但多在30~50岁发病,平均发病年龄为40岁。
AIR病因目前尚不明确。多数人认为是由于自身免疫紊乱导致了IRAs的产生而致病。IRAs能与受体复合物的多个抗原位点结合,当其呈单价与受体结合时,表现为竞争性抑制胰岛素与受体的结合,从而导致严重胰岛素抵抗;当其呈二价与受体结合时,可发挥激活受体的作用,从而导致低血糖。IRAs与受体进行何种形式的结合与IRAs的浓度有关。AIR造成胰岛素抵抗的机制可能为:IRAs竞争性抑制胰岛素与受体结合,降低胰岛素与受体的结合速率;改变受体构象影响受体活性;使受体降解加速,受体数量下调;引起胰岛素错误地结合胰岛素受体等。AIR导致低血糖的发生机制可能为:IRAs与胰岛素受体结合,发挥类似于胰岛素的作用,激活酪氨酸激酶;伴随的其他自身免疫性疾病导致胰岛素受体数量增加;胰岛素受体出现适应性增殖等。
高血糖是AIR最常见的临床表现。但在没有干预的情况下患者可以自发缓解而维持血糖水平正常。AIR是自身免疫性低血糖的主要原因之一,约25%的患者在病程中会出现自发性低血糖。约50%的患者存在黑棘皮征。此外,多囊卵巢、高雄激素血症表现在该类患者中也不少见。AIR患者常伴发其他的自身免疫性疾病,其中以系统性红斑狼疮最为常见,约占50%。此外,还有原发性胆汁性肝硬化、皮肌炎、硬皮病等。AIR还可以表现为霍奇金淋巴瘤、多发性骨髓瘤等的副肿瘤综合征表现。
1.胰岛素水平:对于糖耐量正常的非肥胖个体,空腹胰岛素水平超过150 pmol/L或口服葡萄糖耐量试验中峰值胰岛素水平超过1500 pmol/L提示该病。
2.甘油三酯:AIR患者甘油三酯水平正常或偏低。
3.脂联素:AIR患者脂联素水平升高。
4.IRAs:IRAs对诊断具有重要价值。如IRAs阳性可确诊AIR,但临床上尚无法进行IRA检测,仅可在某些特定的实验室进行检测。
5.抗核抗体谱:如怀疑合并系统性红斑狼疮、皮肌炎等,完善抗核抗体谱检查有助于诊断其他自身免疫性疾病。
目前尚无特异性临床特征可用于诊断该病。患有黑棘皮病和可疑自身免疫性疾病的患者,空腹胰岛素浓度显著升高,需考虑AIR。每日外源性胰岛素用量>3 U/kg的非肥胖患者也需怀疑AIR。如检测到IRAs可确诊。确诊为AIR的患者需评估是否存在其他自身免疫性疾病。反过来,如发现其他自身免疫性疾病也有助于确认AIR诊断。
AIR需与一系列可致严重胰岛素抵抗的疾病进行鉴别,包括A型胰岛素抵抗、矮妖精貌综合征、Rabson-Mendenhall综合征、脂肪萎缩性糖尿病等。对于临床表现为低血糖症的患者,尚需与胰岛素瘤进行鉴别。
1.A型胰岛素抵抗:
A型胰岛素抵抗的临床定义为严重的遗传性胰岛素抵抗,但无生长缺陷或脂肪营养不良。其最常见的特点为:青春期前起病的胰岛素抵抗和黑棘皮征,女性中还存在卵巢分泌雄激素过多的表现。A型胰岛素抵抗是由于胰岛素受体基因出现杂合突变或纯合突变,呈常染色体显性遗传或隐性遗传模式,导致胰岛素与受体结合障碍。但尚有临床上考虑A型胰岛素抵抗综合征而未发现胰岛素受体基因突变的患者,这些患者可能存在尚未明确的下游细胞内信号通路分子的突变。
2.矮妖精貌综合征:
这是一种以宫内生长受限、空腹低血糖和餐后高血糖为特征的综合征。该综合征与严重胰岛素抵抗相关,患儿在口服葡萄糖耐量试验中可出现明显的高胰岛素血症,与匹配的正常婴儿相比高出100倍。大多数患者在1岁内死亡。
3.Rabson-Mendenhall综合征:
这是一种包括严重的胰岛素抵抗和黑棘皮征的临床综合征。胰岛素抵抗的程度介于矮妖精貌综合征和A型胰岛素抵抗之间。此外,患者还可能存在身材矮小、腹部隆起、牙列和指甲异常以及松果体增生的表现。该综合征可能与胰岛素受体合成减少导致胰岛素与受体结合减少有关。蛋白水解酶切割相关位点突变导致胰岛素受体前体水解切割异常,可能是胰岛素受体合成减少的原因。
4.脂肪萎缩性糖尿病:
多种形式的脂肪营养不良与胰岛素抵抗和糖尿病有关。其中家族性部分脂肪萎缩与LMNA基因突变相关,严重的全身性脂肪萎缩与Seipin和AGPAT2基因突变有关。但这些突变导致胰岛素抵抗和糖尿病的机制尚不清楚。
5.胰岛素瘤:
胰岛素瘤是成人高胰岛素性低血糖症最常见的原因。典型患者表现为Whipple三联征:低血糖的临床表现,同步测定血糖水平低,摄入葡萄糖后症状缓解。影像学上发现胰腺占位可进一步协助诊断,GLP-1受体显像在诊断困难的患者中具有重要价值。
目前尚未建立B型胰岛素抵抗综合征的标准化治疗方案。AIR的治疗主要针对两个方面:一是胰岛素抵抗及糖代谢异常;二是严重低血糖。治疗目标包括改善糖代谢异常以及解除自身免疫反应。
1.胰岛素抵抗及糖代谢异常的治疗:
治疗的目的是将血糖控制在接近正常水平。为将血糖控制在目标范围,通常需要使用大剂量胰岛素治疗,可高达5100U/d,甚至高达30000U/d。此外,口服降糖药也可以考虑在该类患者中使用。目前已有使用磺脲类、二甲双胍、噻唑烷二酮类降糖药物的报道,但结论不一致。
2.免疫调节治疗:
免疫调节治疗主要针对AIR导致的自身免疫状态。但因缺乏大型的随机双盲试验,免疫调节药物的选择依赖于其他自身免疫性疾病的经验。血浆分离、血浆置换、输注人免疫球蛋白在个案中均有报道,但结论不一致。吗替麦考酚酯、环磷酰胺、硫唑嘌呤和各种糖皮质激素制剂作为单药或联合治疗也并没有得出一致有效的结论。糖皮质激素具有抑制已经产生的浆细胞的活性,从而减少自身抗体产生的作用。为了维持血糖正常,常需要使用大剂量的糖皮质激素(如泼尼松20~150mg/d),但最佳治疗疗程尚不明确。患者的低血糖常在使用大剂量糖皮质激素24小时内缓解。环磷酰胺可以同时抑制B细胞和T细胞功能,从而减少自身抗体的产生。对于无法耐受环磷酰胺的患者,也可考虑选用环孢素。利妥昔单抗是一种单克隆抗体,专门针对B细胞表面表达的CD20+分子,可以阻止新的IRAs产生。目前已有数十篇个案报道提示利妥昔单抗治疗AIR安全有效。美国NIH建议每个月一次的大剂量激素冲击联合环磷酰胺以及利妥昔单抗进行治疗。
一旦患者在无需外源性胰岛素的情况下血糖仍能维持正常,并且血清胰岛素水平正常,提示患者进入缓解期。这一阶段低血糖的风险很高,甚至致死。对于AIR导致的低血糖,首先要进行生活方式的调整,包括规律进餐,夜间加餐。此外,进入缓解期后应加用硫唑嘌呤作为免疫抑制维持治疗。但目前尚不明确免疫抑制维持治疗是否为预防复发的必要措施,对于应该维持治疗多久也尚无定论。
不给予任何干预的情况下,AIR患者可能出现自发缓解,包括血糖基本接近正常、空腹胰岛素水平正常、IRAs消失。在美国NIH的队列中,33%的患者出现了自发缓解。
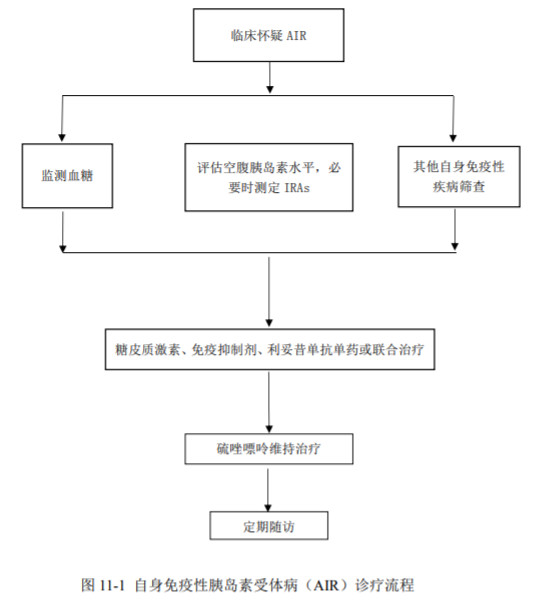
诊疗流程(图11-1)
参考文献(略)
来源:国家卫健委《罕见病诊疗指南(2019年版)》
查看更多