查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





HER2基因异常NSCLC患者的生存预后显著较差,且目前抗HER2药物疗效欠佳,临床中仍有众多未被满足的治疗需求。本期我们将分享1例右肺腺癌Ⅳ期(cT2bN2M1,ERBB2-扩增)患者,给予2周期维迪西妥单抗联合抗血管生成治疗后获得部分缓解(PR),目前持续随访中。让我们跟随江苏省人民医院肿瘤科张梅玲教授的分享及卢凯华教授的点评,深入解读这一引人深思的病例。
张教授病例分享

副主任医师、副教授
江苏省人民医院肿瘤科
专业方向:肺癌精准诊断和个体化治疗
江苏省医师学会精准医疗专委会精准分子治疗学组秘书
江苏省免疫学会肿瘤诊疗多学科协作学组委员
第一作者发表SCI论文10余篇,最高影响因子12.98分
主持国家自然科学基金项目1项、江苏省自然基金项目1项、CSCO课题2项
基本情况
患者男性,71岁。2020年8月因“反复咳嗽咳痰伴头痛10天”至我院就诊。
辅助检查
癌胚抗原(CEA):33.69ng/ml。
2020.08.03 胸部增强CT:右肺上叶占位,肺CA可能,周围阻塞性炎症,检查结果如下:
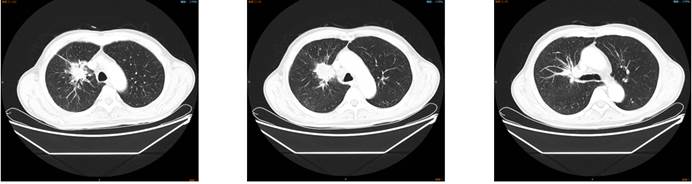
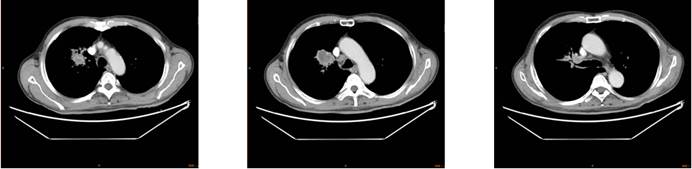
2020.08.05 PET-CT:右肺上叶近肺门软组织肿块,FDG代谢增高,远端伴小片状致密影,考虑右上肺癌伴远端阻塞性炎症;多发淋巴结(纵隔、右肺门)、脑内多发结节、T11椎体,FDG代谢增高,考虑多发转移可能,检查结果如下:

2020.08.05头颅MR3T:颅内多发类圆形强化灶,考虑脑内多发转移瘤,检查结果如下:
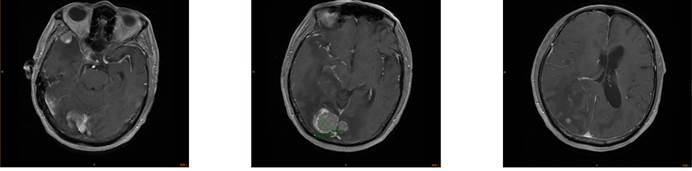
2020.08.05行CT引导下右肺穿刺活检术,病理结果显示:(肺穿刺)腺癌。

诊断
右肺腺癌Ⅳ期(cT2bN2M1);ECOG:2分。
诊疗经过
2020.08.08、09.04化疗第1-2周期。ECOG 1分。
基因检测结果:ERBB2-扩增。

头颅MRI平扫(2020.09.28):颅内多发结节-肿块样异常信号,考虑脑内多发转移瘤,较前部分缩小,部分病灶周围水肿灶较前减轻;胸部CT平扫(2020.09.25):右肺上叶占位,肺CA可能,病灶较前2020.08.01稍减小,周围阻塞性炎症。
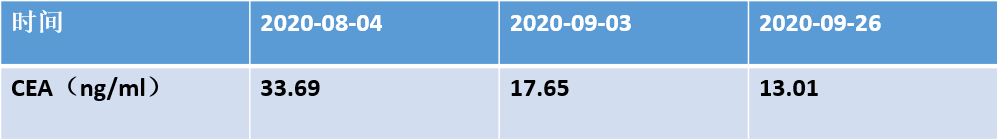
影像学检查结果如下,评估:SD(缩小)。
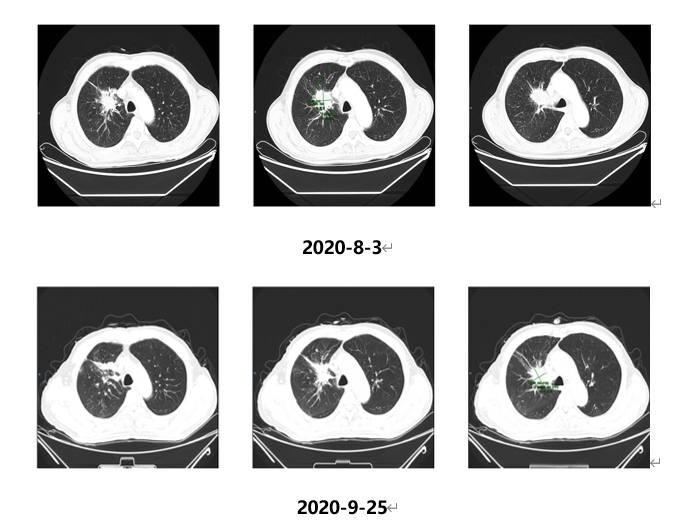

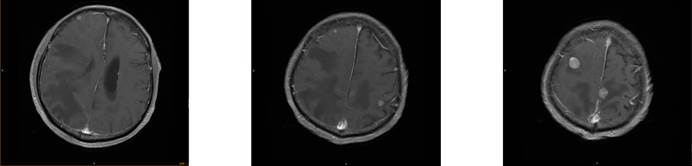
2020.09.28、10.20化疗第3-4周期;出院后1周再次出现头痛;头颅MRI(2020.10.26)示:颅内多发异常信号,考虑脑内多发转移瘤,病灶较2020.09.28进展,建议头颅MR增强检查,结果如下:
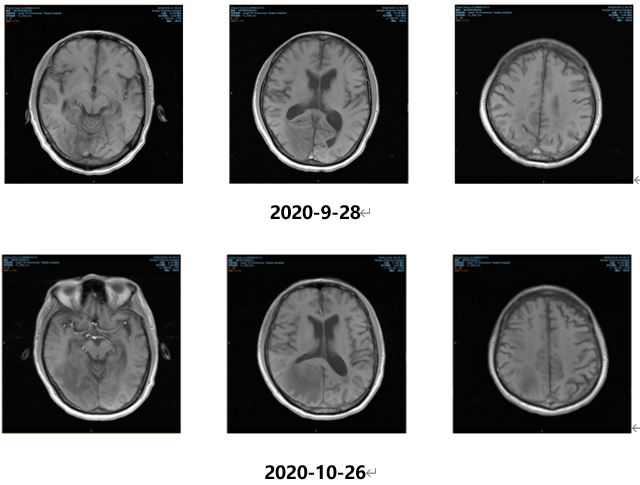
2020.11.09开始行全脑放疗,计划DT:PGTVm 54Gy/2.7Gy/20F,PTV 40Gy/20F;胸部CT平扫(2020.11.25):右肺上叶占位,肺CA可能,病灶较前2020.09.25相仿;头颅MRI(2020.12.15):右侧枕叶强化结节,右侧额叶、左侧顶叶内侧面小强化结节影,均考虑脑内转移瘤,较2020-10-26水肿明显好转;2020.12.16化疗第5周期。影像学检查结果如下:
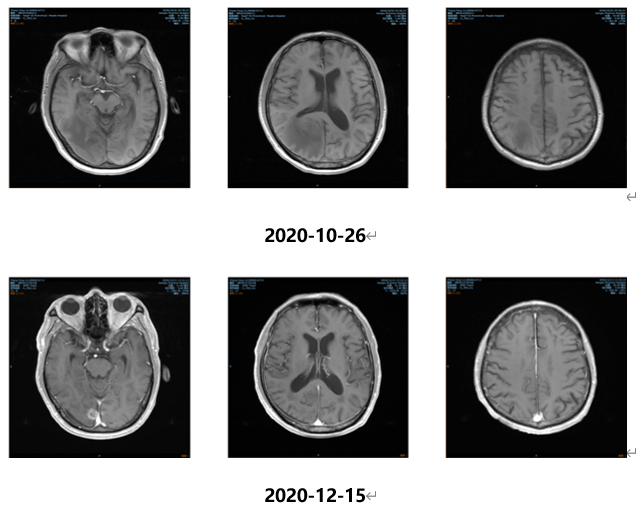
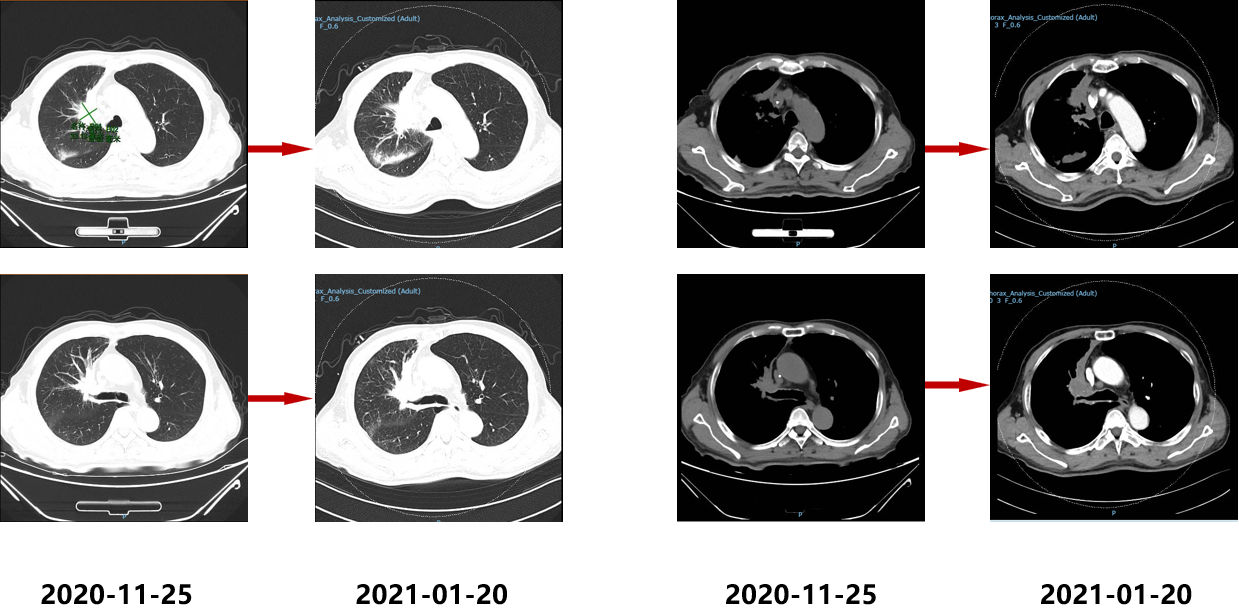
2021.01口服吡咯替尼(400mg qd)治疗;2021.03于放疗科行肺部原发病灶放射治疗;影像学检查结果如下:
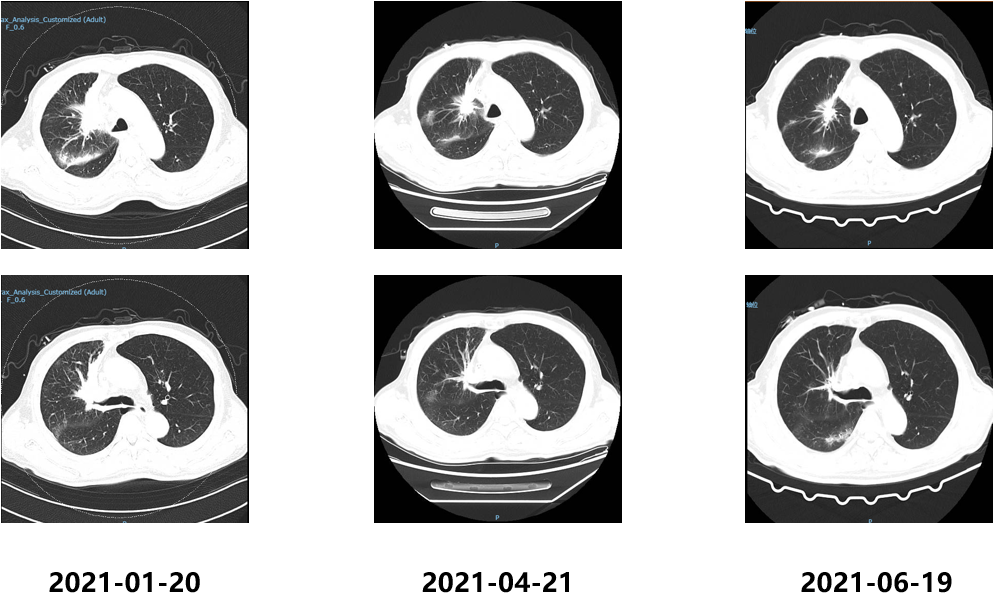
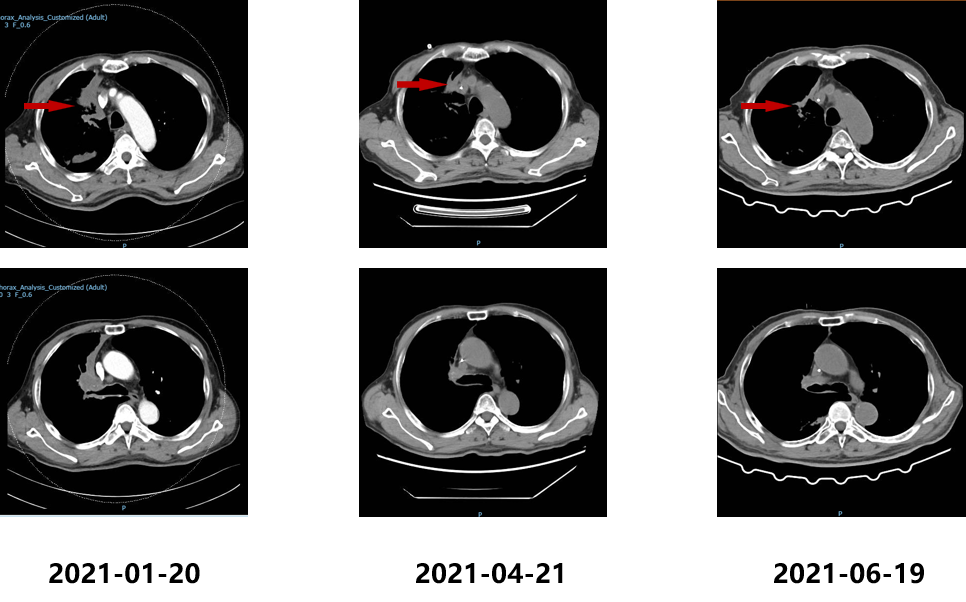

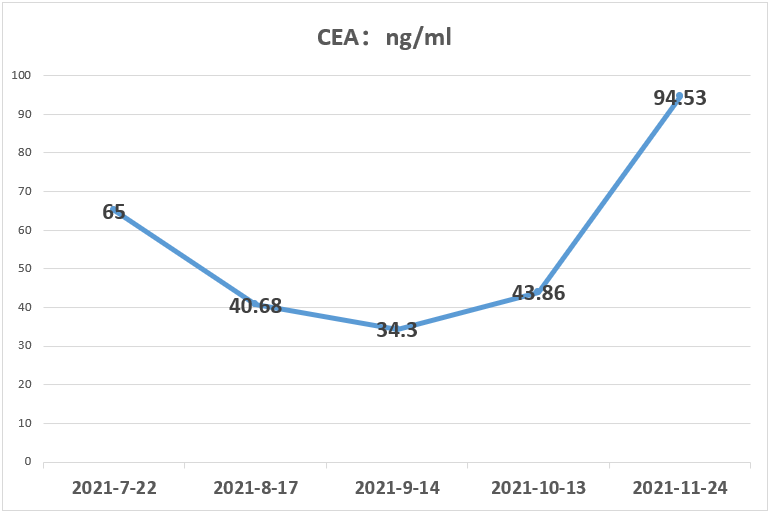
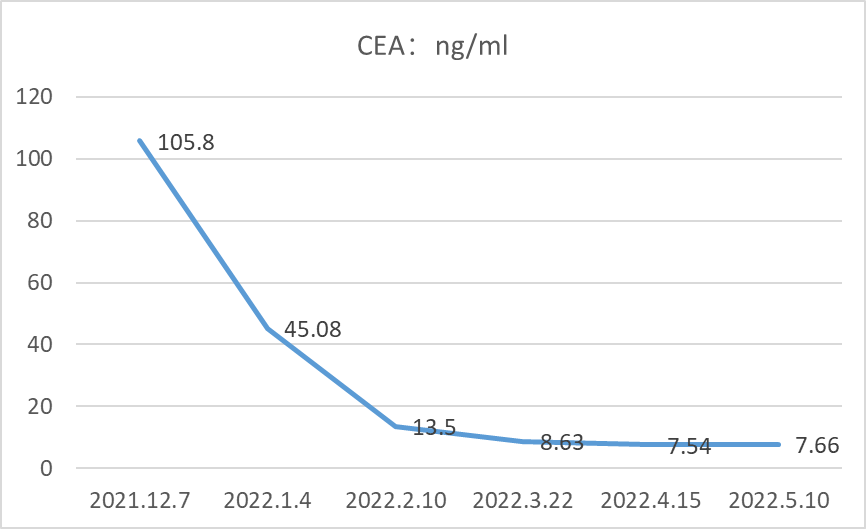
2021.07.01行伽玛刀治疗,靶区数量位置:左侧顶叶、左侧顶枕叶、左侧枕叶、右侧颞叶共6处病灶,边缘剂量15+15+15+15+16+16Gy 中心剂量:30+30+30+30+32+32Gy等剂量曲线使用。患者于2021.7.24、2021.08.20、2021.09.16、2021.10.20予“信迪利单抗 200mg d1”治疗4周期,同时口服吡咯替尼,期间复查评估SD。CEA变化结果如下:
影像学检查结果如下:
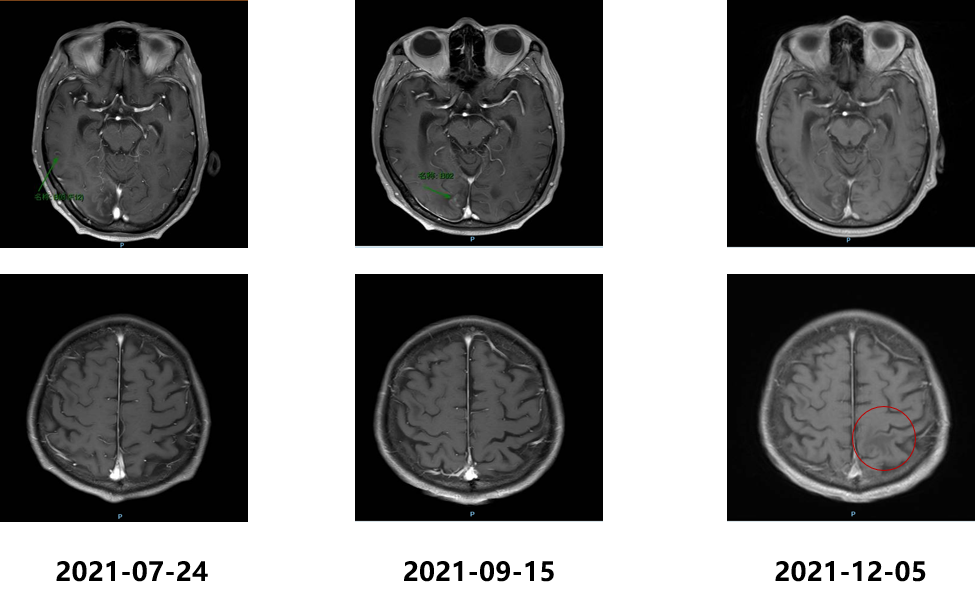

2021.12.08、2022.01.08予“维迪西妥单抗120mg d1,d14 q28d”治疗2周期,联合安罗替尼(12mg po,d1-14,q21d)治疗;影像学检查结果如下,2周期评估PR。

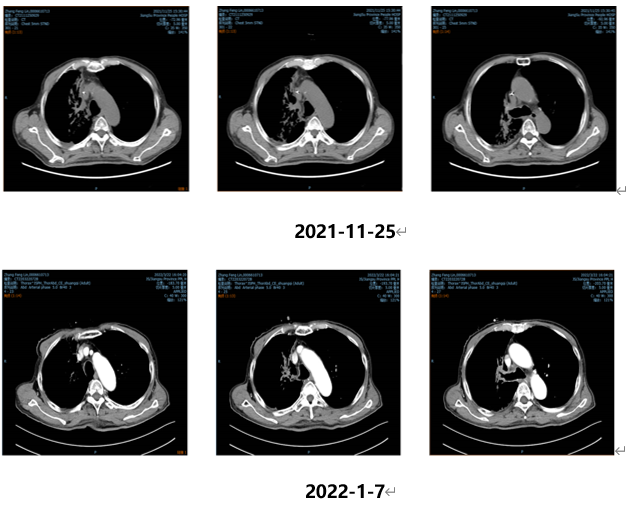
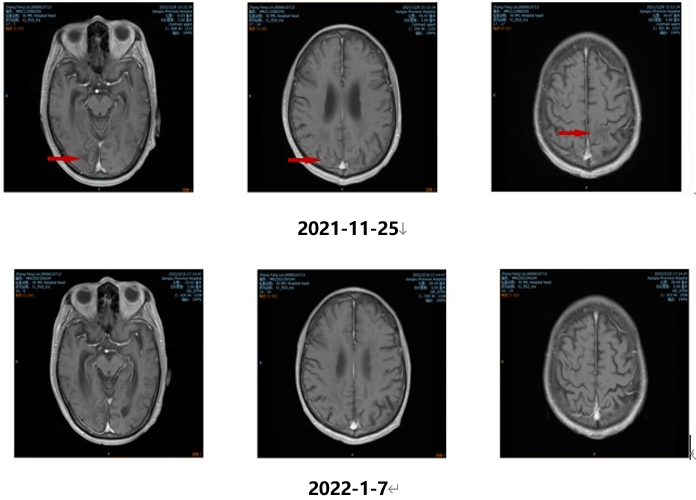
2022.02.11、2022.03.21予“维迪西妥单抗120mg d1,d14 q28d”治疗第3、4周期,联合安罗替尼(12mg po,d1-14,q21d)治疗。目前持续随访中,CEA变化结果如下:
卢教授病例点评

江苏省人民医院肿瘤中心副主任
医学博士、主任医师、教授、博士生导师
卢医生肺爱之家创始人
国际肺癌联盟会员、美国临床肿瘤学会会员
江苏省医师协会临床精准医疗专委会精准分子治疗学组组长
江苏省医师协会临床精准治疗专委会秘书
南京市医学会科普分会副主任委员
中国抗癌协会肿瘤标志专业委员会肺小结节分子标志物协作组常委
中国医药卫生文化协会全民健康素养促进分会常委
中华中医药学会血液肿瘤分会常委
中国老年肿瘤学会委员
江苏省医学会肿瘤分会肺癌学组委员
江苏省免疫学会生物治疗委员会委员
中华慈善总会肺癌注册医生
中国癌症基金会审核专家
国家自然科学基金评审专家、江苏省六大高峰人才
专业方向:肺癌的疑难诊断与个体化治疗及全程管理
2010年获得政府奖学金赴美国德州大学M.D.安德森肿瘤中心深造
NSCLC患者抗HER2治疗疗效差强人意,ADC药物问世有望突破治疗瓶颈
HER2基因异常NSCLC患者往往预后较差,生存期较一般患者更短[1],目前尚无针对NSCLC患者HER2靶点的靶向药物获批。纵观众多抗HER2在研药物,如阿法替尼、吡咯替尼、曲妥珠单抗、帕妥珠单抗、T-DM1及DS-8201等,多集中在HER2基因异常≥二线治疗,且疗效均不理想[2]。由此可见,HER2突变NSCLC治疗临床中仍有巨大的需求未被满足。
抗体药物偶联物(ADC)类药物兼具小分子药物强大的杀伤力和单抗高度的靶向性[3],且相比二代抗HER2 ADC药物,DS-8201和RC48等新一代抗HER2 ADC类药物不仅具有经典靶向和细胞毒性作用,还因其细胞毒素分子通透性强而具有旁路杀伤作用,可发挥更强大的杀伤肿瘤效应[4]。DESTINY-Lung01研究显示[5],DS-8201治疗经治HER2突变晚期NSCLC有持久的抗肿瘤活性。DS-8201-A-J101 Ib期研究表明,T-DXd治疗HER2低表达晚期乳腺癌中位无进展生存期(mPFS) 达11.1个月,中位缓解持续时间(mDOR) 为10.4个月[6]。可见,ADC等新型抗HER2治疗药物,有望为患者带来进一步获益。
我国自主研发的新一代ADC类药物——维迪西妥单抗,联合治疗为患者带来获益曙光
合理的ADC联合治疗可增强ADC活性,目前探索的联合策略主要有“+免疫疗法”及“+抗血管生成药物/TKI”。同时抑制HER2和VEGF蛋白表达对降低HER2和VEGF表达水平有协同效应[7],临床前研究表明,T-DM1联合来那替尼治疗的缩瘤效果较T-DM1单药更持久[8]。新一代ADC药物维迪西妥单抗联合TKI有望实现更佳疗效!
本例患者ERBB2扩增,经化疗和免疫治疗后,给予2周期维迪西妥单抗联合安罗替尼治疗后,取得了PR,为患者带来了更多新的生存机会。目前患者持续随访中,PFS已超过18个月,期待这一方案能继续为HER2基因异常NSCLC患者带来获益。
继往开来,不断探索
目前,一项评估维迪西妥单抗对HER2过表达或突变的晚期NSCLC患者疗效和安全性的Ib期研究正在开展中[9],期待结果公布,可为HER2基因异常NSCLC患者带来更多治疗选择。本患者通过维迪西妥单抗联合抗血管生成治疗获得较好疗效,也增强了临床在联合治疗方面的信心,希望随着未来更多联合方案的探索,可更好造福于HER2基因异常NSCLC患者人群。
参考文献:
[1] Offin M, et al. Frequency and outcomes of brain metastases in patients with HER2-mutant lung cancers. Cancer. 2019 Dec 15;125(24):4380-4387.
[2] Yu X, et al. HER2-Altered Non-Small Cell Lung Cancer: Biology, Clinicopathologic Features, and Emerging Therapies. Front Oncol. 2022 Mar 29;12:860313.
[3] Hafeez U, et al. Antibody-Drug Conjugates for Cancer Therapy. Molecules. 2020 Oct 16;25(20):4764.
[4] Rinnerthaler G, et al. HER2 Directed Antibody-Drug-Conjugates beyond T-DM1 in Breast Cancer. Int J Mol Sci. 2019 Mar 5;20(5):1115.
[5] Li BT, et al. Trastuzumab Deruxtecan in HER2-Mutant Non-Small-Cell Lung Cancer. N Engl J Med. 2022 Jan 20;386(3):241-251.
[6] Modi S, et al. Antitumor Activity and Safety of Trastuzumab Deruxtecan in Patients With HER2-Low-Expressing Advanced Breast Cancer: Results From a Phase Ib Study. J Clin Oncol. 2020 Jun 10;38(17):1887-1896.
[7] Tai W, et al. Inhibition of breast cancer cell growth and invasiveness by dual silencing of HER-2 and VEGF. Mol Pharm. 2010 Apr 5;7(2):543-56.
[8] Li BT, et al. HER2-Mediated Internalization of Cytotoxic Agents in ERBB2 Amplified or Mutant Lung Cancers. Cancer Discov. 2020 May;10(5):674-687.
[9]ClinicalTrials.NCT04311034
查看更多