查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





沈 锋 教授
主任医师、博士生导师
东方肝胆外科医院副院长
东方肝胆外科医院肝胆外科主任
国际肝胆胰协会(IHPBA)理事
亚太肝胆胰协会(A-PHPBA)秘书长
亚太肝脏外科发展委员会(APHAB)主席团副主席
中华医学会肝脏外科学组副组长
中国抗癌协会肝癌专委会副主委
中国医师协会临床精准医疗专业委员会副主委
中国临床肿瘤学会(CSCO)胆道肿瘤专家委员会候任主委
肝癌专家委员会副主委、全军肝胆外科专业委员会主委
《黄家驷外科学》第八版副主编
全军科技领军人才,上海市科技精英,上海市领军人才
获国之名医·卓越建树称号
发表SCI论著220余篇
以第一完成人获国家科技进步二等奖
上海市科技进步一等奖(两项)
肝癌围术期治疗进展
手术切除是肝癌患者获得长期生存的最主要途径,复旦大学肝癌研究所数据显示,2008~2015年间接受根治性切除的肝癌患者,术后5年生存率已达64%,较既往显著提高,这与肝癌早诊早治、围术期治疗,以及复发后治疗的进步等多种因素有关。本文主要就肝癌围术期治疗进展进行盘点。
1. 术后辅助治疗研究进展
对肝癌患者,单纯手术治疗的长期预后并不理想,5年复发率高达70%。肝癌术后有效的辅助治疗对降低复发风险、延长患者生存有重要意义。但术后辅助治疗存在治疗时间较长、患者依从性较差、对毒性耐受度低等困境。既往关于索拉非尼辅助治疗的STORM研究就以失败告终。
今年肝癌辅助治疗取得了一定进展,2021年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)发布了一项术后辅助研究,32例根治性切除后伴高复发风险肝细胞癌(HCC)患者按1:1随机接受PD-1单抗SHR-1210联合阿帕替尼或两次标准肝动脉化疗(HAI)治疗。数据截点时,SHR-1210-阿帕替尼组和HAI组的中位无复发生存期(RFS)分别为未达到 vs 10.5个月,SHR-1210-阿帕替尼组和HAI组治疗期间的平均生活质量(QoL)评分分别为48.8分和49.2分[1]。SHR-1210联合阿帕替尼耐受性良好,可能为肝癌辅助治疗提供一种比HAI更有前途的新选择。
2021年欧洲肿瘤内科学会(ESMO)公布的一项术后辅助研究壁报显示,45例中国肝癌的分期方案(CNLC)II期和III期HCC患者切除术后采用卡瑞利珠单抗联合阿帕替尼辅助治疗,中位RFS达11.7个月,中位总生存期(OS)未达到。研究显示CNLC II期和III期HCC患者切除术后,卡瑞利珠+阿帕替尼治疗的耐受性良好,但其有效性和安全性还需要在更大样本量的前瞻性、随机对照试验中验证[2]。2021年ASCO公布的一项单中心、单臂Ⅱ期临床试验,旨在评估卡瑞利珠单抗联合阿帕替尼用于可切除HCC围手术期治疗的有效性与安全性,结果显示卡瑞利珠单抗联合阿帕替尼用于围手术期治疗的主要病理缓解率(MPR)为29.4%,且安全性可管理。CXCL10、CXCL11和MS4A4A可能对卡瑞利珠单抗联合阿帕替尼治疗HCC的病理缓解产生影响,该研究尚需进一步观察以明确[3]。
此外,2021年ASCO一项术后辅助治疗研究显示,对于55例肿瘤特征评估有中/高复发风险,切除或射频消融后无残留病变的HCC患者接受纳武利尤单抗治疗,1、2、3年RFS率分别为:76.7%、58.0%、46.9%,中位RFS达26.0个月。未观察到新的安全问题。WNT/β-catenin相关基因拷贝数增加、WNT/β-catenin通路激活、存在Foxp3+细胞及CD8+TILs数量少可预测手术切除(SR)或射频消融(RFA)后纳武利尤单抗辅助治疗的肝癌复发[4]。
更值得关注的是,2021年ESMO更新了由复旦大学附属华山医院钦伦秀教授牵头发起的LANCE研究数据,该研究评估了仑伐替尼联合肝动脉化疗栓塞术(TACE)vs 单独TACE作为HCC切除术后高复发风险患者辅助治疗的疗效和安全性。研究结果显示,仑伐替尼+TACE组中位无病生存期(DFS)为17.0个月(95%CI 12.0-24.0),显著优于TACE组(9.0个月,95%CI 7.0-14.0,P=0.0228;HR 0.6,95%CI 0.4-1.0)。联合组中最常见的3或4级不良事件(发生率≥5%)为高血压(19.6%)、腹泻(15.2%)、牙龈出血(13.0%)等,没有预期外的安全性信号[5]。这项研究预计2022年初可完成所有患者的随访,期待该研究的最终结果。
正在开展的Ⅲ期IMbrave050研究将探索阿替利珠单抗+贝伐珠单抗(T+A)在HCC辅助治疗中的安全性和疗效。度伐利尤单抗单药或联合贝伐珠单抗用于根治性肝切除或者消融后高危复发患者辅助治疗的Ⅲ期、随机、双盲、安慰剂对照、多中心研究,以及卡瑞利珠单抗联合阿帕替尼用于HCC根治性手术或消融后伴高复发风险人群辅助治疗的随机对照、开放、多中心III期临床研究也正在开展。此外帕博利珠单抗对比安慰剂作为HCC手术切除或局部消融后辅助治疗的安全性和疗效的III期研究,2021年6月已完成入组。期待这些研究结果为肝癌的术后辅助治疗提供新证据。
2. 新辅助治疗研究进展
肝癌的新辅助治疗目的是术前提前干预,早期治疗微转移灶,降低可切除肝癌术后复发率,改善患者的长期预后。新辅助治疗的可行性已在其他实体器官恶性肿瘤中得到证实,例如非小细胞肺癌、黑色素瘤、结直肠癌、乳腺癌和膀胱癌等。在肝癌的肝移植治疗中,新辅助治疗的应用既能使患者在等待供肝的漫长过程中减少因超出移植标准而失去移植的机会,又能使部分患者的肿瘤降期,进而获得移植的机会,从而扩大移植患者的比例。尽管肝癌根治性切除的新辅助治疗尚缺乏足够的研究支持,但鉴于初诊肝癌手术切除率低、根治性治疗后复发率高的特点,有必要采取新的策略来提高肝癌治疗的疗效,新辅助治疗可能会给肝癌的诊治带来新的期望。
今年各大国际会议公布了数项肝癌新辅助治疗的研究进展,其中2021年ASCO GI发表了一项新辅助治疗边缘可切除或局部晚期HCC研究[6],结果显示纳入15例患者中,卡博替尼联合纳武利尤单抗治疗,12例患者达到切缘-阴性切除;在12例接受了切除术的患者中,5例患者达到主要/完全病理学缓解。所有患者围手术期未发现新辅助治疗明显的不良事件。2021年7月29日,该研究发表在Nature Cancer上[7],本研究首次将靶向治疗与免疫检查点抑制剂联合应用于HCC的新辅助治疗,也是首个靶免联合方案新辅助治疗HCC的前瞻性研究,但有必要对新辅助系统治疗进行更大规模的随机对照研究,以确定这种方法能否改善HCC的预后。
2021 ASCO报道的一项研究旨在评估肝切除术前新辅助HAIC治疗对超米兰标准的BCLC A/B期HCC患者生存的影响,研究纳入208例患者按1:1随机分配到新辅助HAIC(FOLFOX方案)(NT group)组或直接手术(OP group)组。该研究的中期分析显示,NT组客观缓解率(ORR)为63.6%,疾病控制率(DCR)为96.0%,其中病理完全缓解(CR)达10.1%,治疗组99例患者中有88例(88.9%)进行肝切除术,相较OP组,NT组中位OS及无进展生存期(PFS)明显提升,并降低了术后微血管侵犯(MVI)的发生率,且未导致严重的副反应。因此可认为HAIC新辅助治疗是高效且安全的。试验显示肝切除术前FOLFOX新辅助动脉灌注化疗可为不满足米兰标准但可切除BCLC A/B期肝癌患者带来生存益处,使得手术效果超米兰标准[8]。
沈锋教授点评:
对于肝癌患者而言,靶向药物、免疫治疗药物的搭配为患者围术期治疗带来了更多选择。
并非所有患者均能从新辅助治疗中获益,大量的临床研究数据已经证明早期患者仅接受单纯手术治疗就已经能够获得较长的无病生存期和总生存期。部分患者在新辅助治疗期间可能会出现疾病进展,最终导致错失手术机会。因此,有必要严格筛选适合新辅助治疗的人群以及把握新辅助治疗后合适的手术窗。虽然新辅助治疗仍然面临诸多挑战,但是其发展仍不可阻挡,我们应该在这些挑战的激励下积极开展更多、更广泛的临床研究以促进肝癌新辅助治疗的优化,使更多的肝癌患者实现生存获益。新辅助药物的最佳选择——靶向?免疫?化疗(TACE/HAIC)还是联合?夹心疗法是否更好?目前已在肺癌领域开展多项研究(KEYNOTE-671),肝癌领域仍需进一步探索。
对于靶向联合TACE的辅助治疗,LANCE研究的更新数据给患者带来希望,期待进一步OS数据的更新,也期待未来免疫治疗药物帕博利珠单抗辅助治疗的KEYNOTE-937研究带来更多惊喜。
胆道恶性肿瘤系统治疗进展
胆道系统恶性肿瘤(BTC)分为胆管癌(CCA)和胆囊癌(GBC)[9],CCA按发生部位分为肝内胆管癌(ICC)和肝外胆管癌(ECC),ECC以胆囊管与肝总管汇合点为界分为肝门部胆管癌(PCC)和远端胆管癌(DCC)[10,11]。晚期BTC治疗以化疗为主,靶向及免疫等治疗方式近来也取得喜人进展。
1. 化疗进展汇总
化疗是晚期不可切除/转移性BTC的主要治疗方案。ABC-02研究[12]表明,吉西他滨联合顺铂(GC方案)相比吉西他滨单药治疗,中位OS分别为11.7个月和8.1个月,美国国立综合癌症网络(NCCN)指南推荐BTC一线治疗优选GC方案。一项Ⅱ期临床研究[13]结果显示,白蛋白结合紫杉醇联合GC一线治疗晚期BTC患者,ORR达45%,DCR达84%,PFS达11.8个月,OS达19.2个月。这一成果可为BTC患者一线化疗提供更多选择,但仍有待III期研究进一步验证。今年公布的ABC-06研究[14]显示,BTC患者GC治疗进展后,可从FOLFOX方案(奥沙利铂+亚叶酸钙+氟尿嘧啶)治疗获益,FOLFOX成为晚期CCA患者二线治疗的标准方案。
目前,对于BTC患者化疗,仍缺乏基于ICC、PCC、DCC进行患者分层的研究,针对ABC-01、ABC-02及ABC-03的事后分析提示,ICC患者相比非ICC患者OS更长,但PCC和DCC由于患者人数较少,尚不足以得出结论[15]。
2. 靶向治疗进展汇总
近年来,BTC靶向治疗得到快速发展,成纤维细胞生长因子受体(FGFR)家族基因作为胆系肿瘤的明星靶点,自培米替尼(pemigatinib)经美国食品和药物管理局(FDA)宣布获批用于FGFR2基因融合/重排的经治晚期胆管癌患者以来,同类药物相关研究也陆续进入人们视线。
FIGHT-202[16]是一项多中心Ⅱ期临床研究,旨在探索培米替尼用于既往经过≥1线治疗后疾病进展的局部晚期或转移性CCA患者的疗效和安全性,主要研究终点为FGFR2融合或重排CCA队列的ORR。2021 ASCO最新报道结果显示,FGFR2融合或重排队列的ORR达37.0%,中位缓解持续时间(DOR)为8.1个月;中位PFS为7.0个月,中位OS为17.5个月。基于FIGHT-202初期研究结果,开展了一项中国桥接试验[17],以评估培米替尼在FIGHT-202研究中的结果是否可推广到既往经治的中国CCA患者,研究终点为FGFR2融合或重排CCA患者的ORR。结果表明,30例疗效可评估受试者中,ORR达50%,DCR为100%;中位PFS为6.3个月。
FIDES-01研究[18]是一项Ⅱ期研究,旨在评估derazantinibin在携带FGFR2融合的既往经治的局部晚期或转移性肝内胆管癌患者中的安全性和抗肿瘤活性,2021 ESMO报道了队列1(FGFR2融合)最新结果,ORR为21.4%,DCR为75.7%,中位PFS为8.0个月,中位OS为15.9个月;且不良事件发生率低,易管理。
FOENIX-CCA2[19]是一项II期研究,旨在评估futibatinib用于既往经治的FGFR2基因融合/重排ICC患者的疗效及安全性,2021 ASCO报道显示,所有入组患者ORR达41.7%,中位DOR为9.7个月;中位PFS为9.0个月,中位OS为21.7个月。
ClarIDHy[20]是一项III期研究,评估ivosidenib对比安慰剂用于不可切除或转移性异柠檬酸脱氢酶(IDH1)突变CCA患者的疗效,2021 ASCO公布最终OS数据,ivosidenib对比安慰剂组中位OS分别为10.3个月和7.5个月,提示ivosidenib可为晚期IDH1突变CCA患者带来临床获益。
众多靶向药物取得的不错进展,使CCA患者治疗有了更多新的选择。未来,随着更多新靶点不断研发,将会更好造福于BTC患者。
3. 免疫治疗进展汇总
免疫治疗时代的到来为广大肿瘤患者点燃了希望之光,BTC也不例外。2021年ASCO和ESMO相继报道了多项免疫检查点抑制剂在一、二线治疗BTC中的新进展。
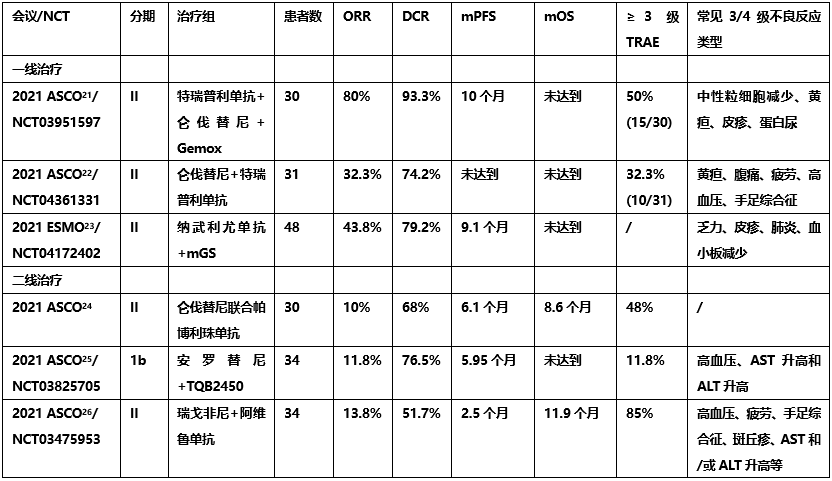
一线治疗方面,一项II期研究(NCT03951597)[21],旨在评估特瑞普利单抗联合仑伐替尼+Gemox化疗(奥沙利铂和吉西他滨)一线治疗局部晚期/转移性ICC患者的疗效和安全性,主要研究终点为ORR。结果显示,特瑞普利单抗联合仑伐替尼+Gemox化疗具有较好疗效,且安全性可耐受,ORR达80%,DCR达93.3%,中位PFS为10.0个月,中位DOR为9.8个月,中位OS未达到,12个月OS率为73.3%。另一项Ⅱ期研究(NCT04361331)[22]评估了特瑞普利单抗联合仑伐替尼用于晚期ICC一线治疗的疗效,主要研究终点为ORR。结果表明,中位随访时间6.9个月时,ORR为32.3%,DCR为74.2%,中位DOR、PFS、OS尚未达到,6个月OS率为87.1%。这一联合方案为无法耐受吉西他滨化疗的晚期ICC患者提供了新的治疗方法。TCOG T1219试验[23]是一项评估纳武利尤单抗联合吉西他滨和TS-1(改良GS,mGS)一线治疗晚期胆管癌的Il期研究,主要研究终点为两次连续影像学检查确定的ORR。研究结果显示,ORR为43.8%,中位PFS为9.1个月,中位OS未达到。考虑到PD-L1表达、基因谱及粪便微生物群对疗效的影响,进一步事后分析仍在进行。
二线治疗方面,一项Ⅱ期LEAP-005研究[24],评估了帕博利珠单抗联合仑伐替尼用于既往接受过一线治疗晚期实体瘤患者的疗效,主要终点为ORR及安全性/耐受性。2021 ASCO报道本研究BTC队列结果显示,ORR为10%,DCR为68%;6个月PFS率为57%,6个月OS率为66%。另外一项Ib期研究(NCT03825705)[25]探索了不同剂量安罗替尼联合TQB2450注射液二线治疗晚期BTC和一线治疗HCC的疗效和安全性,主要终点为最大耐受剂量(MTD)和ORR。2021 ASCO报道了BTC队列初步研究结果,ORR为11.8%,DCR为76.5%,中位PFS为6.0个月,中位OS未达到。REGOMUNE[26]是一项Ⅱ期研究,评估瑞戈非尼联合阿维鲁单抗用于既往经治的晚期或转移性BTC患者的疗效,主要终点为6个月的ORR。结果显示,ORR为13.8%,DCR为51.7%,中位PFS为2.5个月,中位OS为11.9个月。生物标志物分析表明,PD-L1和/或IDO1高表达的BTC患者更可能从瑞戈非尼联合阿维鲁单抗治疗中获益,未来可针对潜在高获益人群进行此联合治疗方案的进一步探索研究。
目前报道的BTC免疫治疗仍主要集中于II期临床研究(表1),但已初步显示免疫联合化疗或靶向治疗可为晚期BTC患者带来显著获益,尤其是对于一线无法耐受化疗或既往化疗进展的患者,免疫治疗带来了更多延长生存的机会。诚然,相关结果也有待未来更大规模III期研究进一步验证。
表1. 2021BTC免疫联合模式的进展汇总
沈锋教授点评:
近年来,靶向、免疫等新型治疗方式的问世及精准医疗技术的发展,为晚期BTC患者带来了新希望。
对于有FGFR、IDH1等基因突变的患者,既往治疗失败后,使用靶向治疗ORR可达21.4%~50%,OS可达10.3~21.7个月。未来,期望胆管癌患者也如肺癌一样,可基于靶点基因突变情况选择精准治疗方案。
免疫治疗方面,联合模式疗效值得期待。从目前已有进展不难看出,免疫+靶向+化疗或免疫+靶向治疗的联合模式可为胆管癌患者带来显著获益。对于化疗可耐受人群,一线免疫+靶向+化疗联合治疗ORR可达80%;对于化疗不耐受人群,一线去化疗的免疫+靶向联合模式也可实现30%左右的ORR;此外,二线免疫+靶向治疗ORR也可达10%~13.8%。临床中,可根据患者身体耐受情况,在一线、二线治疗中,针对性选择免疫联合治疗方案,实现患者最大化获益。
虽然基于一些研究的分析提示,ICC患者相比非ICC患者OS更长,但由于PCC和DCC等患者人数较少,目前仍无法得出可指导性结论。未来,仍有必要荟萃人数较少的PCC和DCC等人群数据进行针对性分析,以期更好指导临床治疗。
最后,晚期BTC患者由于肿瘤及治疗反应等因素,健康相关生活质量(HRQoL)显著降低,BTC患者的治疗应兼顾疗效和生活质量,更好实现远期获益。
参考文献
[1] ASCO GI 2021. Abstract #285.
[2] Xin-Rong Yang,et al. Adjuvant Camrelizumab combined with apatinib treatment after resection of hepatocellular carcinoma in CNLC II and III stage: A single-center prospective phase II trial. 2021 ESMO #944P.
[3] 2021 ASCO Abstract #4082.
[4] 2021 ASCO Abstract #4070.
[5] Jin-Hong Chen, et al. Adjuvant Lenvatinib in combination with TACE for HCC patients with high risk of postoperativerelapse (LANCE): updated results from a multi-center prospective cohort study. 2021 ESMO #945P.
[6] ASCO GI 2021. Abstract #335.
[7] Won Jin Ho et al. Neoadjuvant cabozantinib and nivolumab convert locally advanced hepatocellular carcinoma into resectable disease with enhanced antitumor immunity. Nature Cancer, 2021, doi:10.1038/s43018-021-00234-4.
[8] 2021 ASCO Abstract #4008.
[9] 《CSCO胆道系统肿瘤诊断治疗专家共识(2019年版)》
[10] Valle JW, ESMO Guidelines Committee. Biliary cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2016 Sep;27(suppl 5):v28-v37.
[11] 中国实用外科杂志 2014年1月第34卷,第1期:1-5.
[12] Valle, J. et al. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N. Engl. J. Med. 362, 1273–1281 (2010).
[13] Shroff RT, et al. Gemcitabine, Cisplatin, and nab-Paclitaxel for the Treatment of Advanced Biliary Tract Cancers: A Phase 2 Clinical Trial. JAMA Oncol. 2019 Jun 1;5(6):824-830.
[14] Lamarca, A. et al. Second- line FOLFOX chemotherapy versus active symptom control for advanced biliary tract cancer (ABC-06): a phase 3, open- label, randomised, controlled trial. Lancet Oncol. 22, 690–701 (2021).
[15] Brindley PJ, et al. Cholangiocarcinoma. Nat Rev Dis Primers. 2021 Sep 9;7(1):65.
[16] ASCO 2021. Abstract 4086.
[17] G-M.Shi, et al. Efficacy and safety of Pemigatinib in Chinese patients with unresectable, advanced, recurrent, or metastatic intrahepatic cholangiocarcinoma with FGFR2 fusion or rearrangement that failed prior systemic therapy. 2021 ESMO #50P.
[18] Michele Droz dit Busset, et al. Derazantinib for patients with intrahepatic cholangiocarcinoma harboring FGFR2 fusions/rearrangements: primary results from the Phase 2 study FIDES-01. 2021 ESMO #47P.
[19] L.Goyal, et al. AACR 2021. CT010.
[20] Ghassan K. et al.2021 ASCO Annual Meeting,Abstract #:4069.
[21] ASCO 2021. Abstract 4094.
[22] 2021 ASCO #4099.
[23] Nai-Jung Chiang, et al. TCOG T1219 trial: A Phase II Study of Nivolumab in Combination with Gemcitabine and TS-1 as the First-line Treatment in Patients with Advanced Biliary Tract Cancer. 2021 ESMO #49P.
[24] 2021 ASCO Abstract #4080.
[25] 2021 ASCO Poster-4075.
[26] S Cousin, et al. 2021 ASCO. Poster #4096.
审批号:MI-LEN-0188-CN
免责声明:
本资讯由默沙东医学团队编辑提供,旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
查看更多