查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:郑州市中心医院 李琳 刘喜灿 卜淑芳

病例汇报
简介:视神经脊髓炎谱系疾病(NMOSD)是一种自身免疫性神经疾病,以视神经炎和长节段横贯性脊髓炎发作为特征。NMOSD患者脑磁共振成像(MRI)通常显示大脑半球、室管膜周围区域、极后区和皮质脊髓束的病变,然而,不种形式的变化也已有报告。
伴有皮质下梗死和白质脑病的常染色体显性遗传性脑动脉病(CADASIL)是由NOTCH3基因突变引起的。其特点是偏头痛、情绪障碍、反复卒中和痴呆。T2WI和FLAIR上的局灶性腔隙性梗死和弥漫性高信号与复发性卒中相关,颞极高信号被认为是CADASIL的影像学标志。外囊和胼胝体受累也是特征性发现。我们报告两例NMOSD患者,其MRI表现与CADASIL影像学特征相似。
一位49岁的女性患者出现右眼视敏度下降和右眼疼痛。眼睛向右移动使疼痛加重。15年前,她曾出现发作样暂时性头痛和左眼视敏度下降,这两种情况均未经治疗而有所改善。46岁时,她的视敏度下降,静脉注射甲泼尼龙治疗后视力没有改善。在她最近一次就诊的前一个月,她患有枕部和颞部自发性剧烈疼痛。疼痛之前没有先兆。考虑到长期疼痛和视力障碍的进展,患者住进我们医院。
她没有相关的家族史。我们记录患者有情绪障碍、Basedow病(毒性弥漫性甲状腺肿,同Graves病)和哮喘病史。她之前的治疗包括奎硫平、阿普唑仑、奥氮平和布洛唑仑。入院时,她的认知功能受到年龄的轻微干扰,她的MMSE评分为26。双眼视力和临界闪烁融合频率降低,左眼可见相对性传入瞳孔障碍。眼科医生诊断为视神经炎,我们观察到四肢深部肌腱反射减弱。其他颅神经,如控制咀嚼、躯干和四肢肌肉力量、感觉、步态和姿势及均正常,并出现双侧屈肌-足底反射。她没有抓握或叩击性肌强直。血液检查显示没有明显异常,包括肌酸激酶水平。甲状腺功能、血管紧张素转换酶、溶菌酶和可溶性白细胞介素-2受体水平均在正常范围内。
HIV、梅毒、抗核、抗髓鞘少突胶质细胞糖蛋白、抗SSA、抗SSB、抗甲状腺过氧化物酶(TPO)和抗脑衰反应介体蛋白-5(CRMP5)抗体的血清学试验均为阴性。抗水通道蛋白-4(AQP4)和抗甲状腺球蛋白抗体试验均为阳性。脑脊液检查显示轻度细胞增多(7个细胞/μl),蛋白质(50 mg/dl)和IgG水平(1038 mg/dl)升高,IgG指数升高(0.84)。未检测到寡克隆条带。在T2WI和FLAIR图像上,脑MRI显示左侧小脑中脚、双侧外嚢、颞极和大脑半球出现高信号病变(图1A-C)。
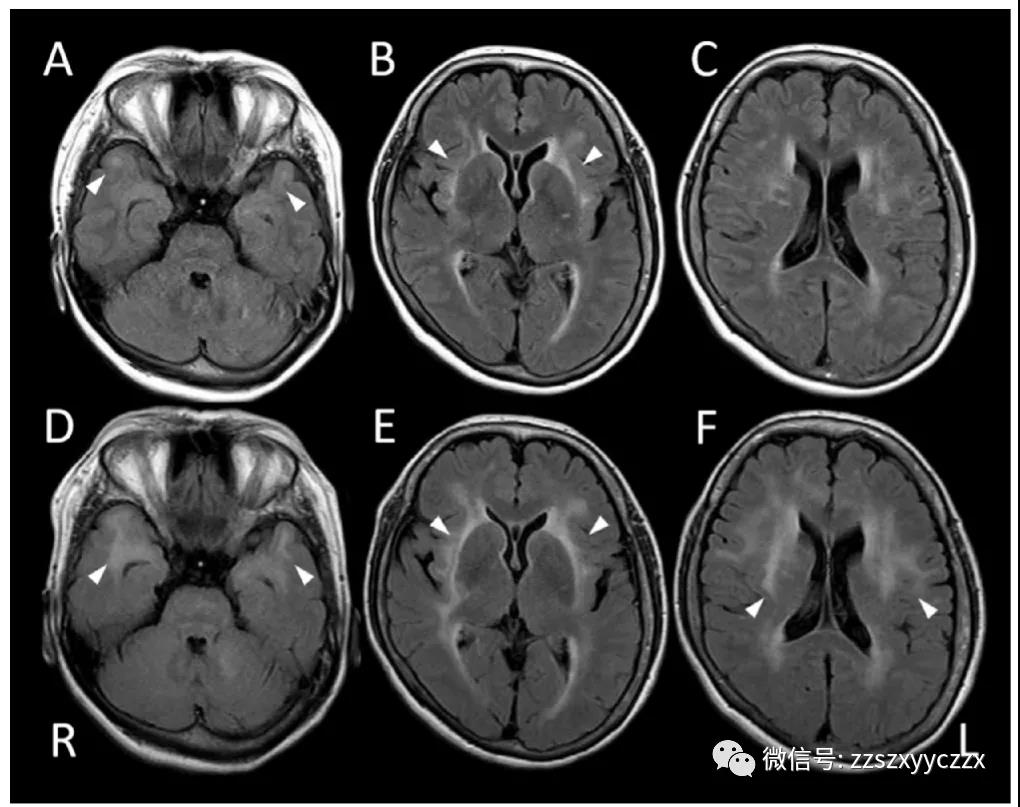
图1 病例1的脑磁共振成像结果。入院时轴向液体衰减倒置恢复(FLAIR)图像(A-C)。高强度累及双侧颞极(A)和外囊(B)。入院后5个月(D-F)。异常区域扩大(D,E),双侧大脑半球出现异常(F)。
室管膜周围区、极后区和脊髓均正常。FLAIR图像上未看到腔隙性梗死,T2*加权成像上未看到微出血,视神经无明显变化。这些影像学表现提示CADASIL,因此我们对NOTCH3基因进行测序。然而,并没有显示出任何突变。根据NMOSD的国际共识诊断标准做出了NMOSD诊断。开始静脉注射甲泼尼龙治疗,从而改善右眼的视力。患者拒绝接受口服泼尼松龙和所有其他免疫抑制剂的后续治疗。入院6个月后进行的随访MRI显示病变扩大(图1 D-F),然而患者没有经历临床事件进展。她接受了泼尼松龙治疗,在过去的两年里,这种情况在临床和影像学上都没有改变。
病例二:
一位54岁的女性主诉有5天的右眼视力下降史。她没有经历任何头痛或抑郁症,也没有相关的既往史或家族史。她的意识和认知功能都正常。右眼视敏度和临界闪烁融合频率均下降。控制咀嚼、躯干和四肢肌肉力量、感觉、步态和姿势的其他颅神经均正常,并出现双侧屈肌-足底反射。她没有抓握或叩击性肌强直。
血液检测未见明显异常,包括肌酸激酶水平。甲状腺功能和可溶性白细胞介素-2受体水平在正常范围。梅毒、抗核、抗中性粒细胞胞浆、抗甲状腺球蛋白、抗TPO和抗CRMP5抗体的血清学检测均为阴性。抗AQP4、抗SSA和抗SSB抗体检测均为阳性。脑脊液检查无异常,包括未检测到寡克隆带。脑磁共振成像显示T2WI和FLAIR图像上脑白质有多个小的非特异性病变(图2 A-C)。在给予钆剂后,右侧视神经在T1序列上出现强化。脊柱磁共振成像显示没有异常。
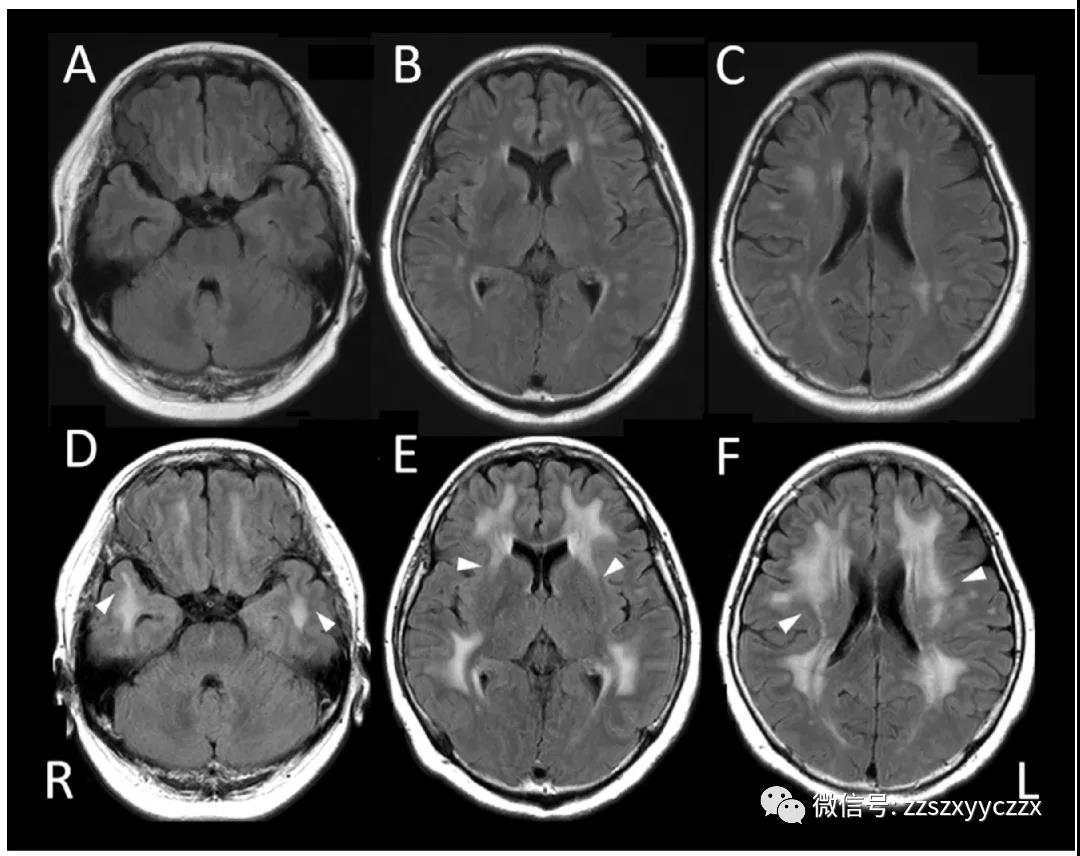
图2 病例2的脑磁共振成像(MRI)表现。入院时轴向流体衰减反转恢复(FLAIR)图像(A-C)。观察到非特异性白质异常。入院后5年(D-F)。FLAIR图像显示双侧颞极(D)、外囊前部(E)和双侧大脑半球(F)的高信号。
根据国际共识的NMOSD诊断标准作出NMOSD诊断。我们开始静脉注射甲泼尼龙治疗,随后口服泼尼松和硫唑嘌呤。5年后,尽管患者临床上没有再进一步发作,但后续磁共振成像表明情况正在逐渐恶化。我们在T2WI和FLAIR图像上注意到颞极和脑白质的对称性高强度区域。左外囊也受影响。(图2D-F)。FLAIR图像上无腔隙性梗死,T2*加权图像上也无微出血,NOTCH3基因测序没有显示任何突变。
讨论
这两例NMOSD均表现出双侧颞极和外囊的对称性白质MRI异常。这些区域的MRI高信号被证明是CADASIL的影像学标志。视神经炎的发展在CADASIL中是不典型的,但已有报道。我们的一名患者还经历了偏头痛、情绪障碍和轻度认知障碍,所有这些在CADASIL患者中都很常见。
对于CADASIL的最终诊断,有必要检测NOTCH3基因突变。致病性突变位于外显子2-24中,该外显子编码NOTCH3蛋白中的34个EGF样重复序列(EGFr)。这些突变中的大多数是错义突变,导致特定EGFr中半胱氨酸残基的数量不均匀,该EGFr通常包含六个半胱氨酸残基。然而,对NOTCH3外显子2-24的直接测序分析在我们的患者中没有检测到致病性突变。
此外,强直性肌营养不良1型(MD1)和神经梅毒被认为是鉴别诊断,据报道,它们在颞叶表现出对称性白质异常。然而,患者在整个病情过程中没有肌强直、肌无力和血清肌酸激酶水平升高。他们的梅毒血清学检测也呈阴性。
因此,我们认为它们的对称性白质异常是由NMOSD引起的,并注意到仅一例报告了双侧颞极和外囊的对称性受累。免疫抑制治疗对于预防NMOSD患者的复发是有效的。应该注意的是,尽管没有复发,但在我们的两个病例中,对称性磁共振影像异常逐渐扩大。在案例1中,随后口服泼尼松治疗阻止了病变进一步扩大。在病例2中,口服泼尼松龙和硫唑嘌呤治疗未能防止影像学进一步恶化。影像学变化的长期特征以前没有报道过。
可能有必要进行强化免疫调节治疗来改善这些磁共振异常;需要进一步的研究来评估是否有益。这项研究的局限性是没有分析NOTCH3以外的基因。最近对NOTCH3阴性患者的综合遗传分析已经确定HTRA1、COL4A1和CTSA是常染色体显性脑小血管疾病的致病基因。在这两个案例中,我们排除了最常见的遗传性脑小血管疾病,CADASIL。为了排除其他罕见的脑小血管疾病,需要进一步强化基因检测。
总之,NMOSD患者的磁共振成像可能与CADASIL相似,即颞极、外囊和大脑半球的对称高信号。NMOSD作为CADASIL的鉴别诊断,应考虑检测抗AQP4抗体。
来源:郑州市中心医院卒中中心
查看更多