查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





间皮瘤是一种罕见的高度侵袭性肿瘤,通常起源于肺(胸膜)、心包、腹部和睾丸的浆膜外层等。恶性胸膜间皮瘤(malignantpleuralmesothelioma,MPM)是其中最常见的类型,约占81%。MPM患者在初诊时多为晚期,诊治困难,疗效欠佳,中位总生存时间仅1年,5年生存率仅10%,治愈病例罕见。MPM的主要致病因素为石棉暴露,常于暴露后20~50年后发病,减少石棉使用在一定程度上降低了MPM发病率,但发展中国家的MPM发病率和死亡率仍在上升,该疾病确切的发病机制仍不清楚。MPM的临床表现通常为非特异性和隐匿性,组织学类型多样,诊断和鉴别诊断是临床诊治的难点。目前针对MPM尚缺乏有效的治疗手段,但随着肿瘤学研究的进步,MPM的诊断和治疗在近年来都有突破性的进展。
世界卫生组织(WHO)发布的数据显示,2020年全球间皮瘤新发病例数为30870例,占全球新发恶性肿瘤的0.2%,死亡病例数为26278例,占全球恶性肿瘤死亡病例数的0.3%。此前,因欧美发达国家工业化程度高,间皮瘤的发生率显著高于发展中国家,但近年来中国等发展中国家的发病率和死亡率呈现逐渐上升的趋势。根据《2019年中国肿瘤登记年报》报道,2016年中国间皮瘤的新发病例数为583例,其中MPM新发病例数为330例,发病率约0.86/100万,男性高于女性,城市高于农村,发病率趋势无明显变化;MPM死亡215例,死亡率约0.56/100万。我国MPM的发病率和死亡率在40岁以上人群显著增长,至80岁及以上达到高峰。
MPM是由环境、生物和遗传因素共同作用引起的肿瘤。接触石棉纤维是MPM最主要的致病因素,据统计约80%的病例与之相关。从石棉暴露到MPM发病的潜伏期约20~50年,发病高峰期在接触后45年。一个国家的石棉消费量与MPM的发病率存在明显的相关性。我国从20世纪80~90年代开始大量消费石棉,估计我国新发病例数将会在2020年后迅速上升。石棉纤维类型极广,在工业上应用最多的有温石棉、青石棉和铁石棉3种,皆有致癌性。尽管石棉作为MPM的诱因已被广泛证实,但其导致MPM发生发展的确切机制尚不清楚。相关研究显示,石棉矿物纤维引起的肺损伤、组织修复和局部慢性炎症,以及诱发间皮细胞DNA损伤和染色体异常,可能是导致MPM的内在机制。
除石棉暴露外,其他因素作用也可增加MPM的发生风险。其他矿物纤维,如毛沸石,也可诱导致病。另外,间皮瘤的全面基因组和转录组测序研究揭示了MPM患者之间广泛的基因组异质性,在超过10%的患者中报道了种系变异的存在。MPM的基因突变有其特点,主要表现为抑癌基因的失活突变,包括编码BRCA1相关蛋白1(BRCAassociatedprotein1,BAP1)的基因、编码merlin蛋白的NF2基因和CDKN2A基因、SETD2基因等。BAP1是一种家族遗传突变,部分无石棉接触史的MPM患者存在BAP1基因突变,且BAP1功能的丧失已被证实与间皮瘤的原位癌样表型相关,这对于MPM的早期诊断及探索其预防干预措施具有重要意义。另外,研究还发现有MPM家族史且有石棉相关职业史的个体,患MPM的风险比无家族史和无石棉接触史的人群增加了24倍,这提示MPM的遗传途径值得进一步研究。慢性炎症、碳纳米管、猿猴病毒40感染也可能与MPM发病风险增加相关,但仍需进一步证实。电离辐射也可能导致间皮瘤发生,如MPM是部分接受过斗篷式放射野照射治疗的霍奇金淋巴瘤患者中常罹患的第二原发癌。
MPM通常起病隐匿,大多数患者在病程早期可无明显症状,确诊时的临床表现也缺乏特异性,易与其他肺部疾病相混淆。最典型的症状主要包括由胸腔积液或肺部肿瘤占位引起的胸闷、呼吸困难,以及由于肿瘤直接侵袭胸膜或纵隔引起的胸痛。疲劳、食欲减退、咳嗽、体重减轻、失眠、盗汗等症状也较为常见,并且可随着疾病发展而进行性加重。通常来说,MPM的临床症状较其他肿瘤更为严重,病灶局限时患者即可出现明显胸痛、气短。此外,MPM较少出现远处转移和远处转移引起的相关症状,中枢神经系统转移亦不常见,副肿瘤综合征罕见。
电子计算机断层扫描(electronic computed tomography,CT)检查是目前MPM首选的影像学检查手段,CT影像上通常可见胸膜腔内孤立性、球形或半球形的肿块,或表现为局限或弥漫性的不规则结节状的胸膜增厚,可呈驼峰样隆起,伴或不伴有胸腔积液。CT可用于评估原发肿瘤的范围、区域侵袭、淋巴结转移及胸膜外播散情况,在疗效评价和治疗随访中也是重要的辅助检查方法,同时CT引导下的胸膜病变穿刺活检可有助于明确病理诊断。值得注意的是,目前尚无证据表明对高危人群(有石棉暴露史的人群)采用CT筛查可以降低MPM死亡率,因此并不常规推荐采用CT筛查MPM。超声检查可以进一步支持CT影像的检查结果,必要时还可以行超声引导下的穿刺活检。磁共振成像(magnetic resonance imaging,MRI)在判定胸壁、纵隔、膈肌及腹腔脏器等是否受侵方面较其他影像学方法具有更高灵敏度。正电子发射计算机断层扫描(positron emission tomography/computed tomography,PET-CT)主要用于手术患者的分期评估,能更好地显示胸内外淋巴结转移和远处转移,对MPM分期较胸部CT、MRI更加精确,也有助于评估治疗反应和监测复发。另外,对于考虑手术的患者,使用无创性检查进行精准临床分期比较困难时,建议采用支气管超声内镜、胸腔镜或纵隔镜进行取样探查,以助于明确诊断和分期。
病理学检查是诊断MPM的金标准。活检组织或脱落细胞包埋蜡块的免疫组织化学检查是关键。支持诊断MPM的主要标志物包括Calretinin、CK5/6、WT1和D2-40等,支持诊断肺腺癌的主要标志物包括TTF-1、NapsinA、癌胚抗原(carcinoembryonicantigen,CEA)、BerEP4、MOC31和Claudin4等;应至少选择2个MPM标志物和2个肺腺癌标志物进行检测,并由具有MPM诊断经验的病理学医师进行诊断。建议增加免疫组化BAP1检测以鉴别良性间皮增生和间皮瘤。
如前所述,MPM常见的变异基因包括BAP1、CDKN2A、NF2和SETD2等,突变基因的检测有助于判断良恶性、明确诊断。例如,BAP1核表达缺失是MPM最常见的突变基因,45%~100%的MPM可检测到BAP1基因突变,已成为一种重要的诊断工具,推荐对于无石棉暴露史、年龄较小和既往肿瘤史的患者进行BAP1基因检测。FISH检测CDKN2A的缺失可用于鉴别良恶性间皮增生,灵敏度为41.2%~100%,阳性预测值为100%。
物基于血清和胸膜液的生物标志物研究显示,可溶性间皮素相关肽和骨桥蛋白水平等可能与MPM相关,但目前尚无证据表明它们可用于诊断MPM或监测治疗效果。
结合患者的症状、相关职业接触史及影像学检查,对于临床高度怀疑MPM的患者,应积极获取活检组织样本用于病理诊断。用于诊断的样本类型多样,包括手术标本、CT引导下/超声引导下粗针活检标本、胸腔镜引导下胸腔活检标本、细针穿刺细胞标本和胸腔积液脱落细胞标本。胸膜活检术通常通过胸腔镜检查或CT或超声引导下经皮穿刺活检进行,是主要的样本获取方法。病理学检查是诊断MPM的“金标准”。根据2021年WHO胸膜肿瘤分类标准,MPM组织学亚型主要包括上皮样型、肉瘤样型、双相(混合)型,其中上皮样型最常见,诊断双相型MPM要求上皮样和肉瘤样成分均>10%。2021版WHO胸膜间皮瘤病理分类标准见表47-1。MPM的临床分期目前主要参照美国癌症联合委员会第八版分期(表47-2a,b)。
表47-12021版WHO胸膜间皮瘤病理分类标准
表47-2a恶性胸膜间皮瘤TNM分期(2017AJCC第八版)
表47-2b恶性胸膜间皮瘤TNM分期(2017AJCC第八版)


常见的需要与MPM鉴别诊断的疾病包括:
因胸膜亦为其他恶性肿瘤常见转移部位,故需与其他恶性肿瘤包括肺腺癌、肺肉瘤样癌累及胸膜、肉瘤样肾细胞癌、梭形细胞肉瘤、纤维肉瘤、骨肉瘤、软骨肉瘤、脂肪肉瘤、恶性黑色素瘤等进行鉴别。全面的影像学检查、病史及相关接触史具有提示作用,可帮助发现原发病灶,但往往难以确诊。鉴别的主要依据仍依赖于基于免疫组化检查的病理学诊断。
其他良性胸膜病变包括反应性间皮增生、机化性胸膜炎、简单性间皮增生、非典型间皮增生等。良性胸膜病变鉴别诊断难度大、病理诊断一致性差。应谨慎诊断。在具有充足的病理标本的情况下,需与临床、影像学及病理形态相结合。简单性增生可见于任何刺激浆膜的情形,包括胸腹水、气胸、内膜异位、卵巢肿瘤、盆腔炎等。若非典型增生间皮下结缔组织内无炎症反应,或显示致密纤维化时,需考虑恶性可能性。BAP1、EZH2、MTAP的IHC可鉴别诊断良性间皮增生和间皮瘤。
当高度怀疑MPM诊断时,应尽快由具有MPM诊治经验的多学科团队进行评估,进行诊断、分期、风险评估和方案制订。治疗策略应综合考虑分期、组织学、年龄、PS评分、合并症和患者基础疾病状态等因素,治疗决策应在多学科团队的框架内进行,以确保患者接受最合适的治疗(图47-1)。目前主要的治疗手段包括手术、放疗和全身系统治疗(化疗和免疫治疗)。对于Ⅰ~ⅢA期的非肉瘤样MPM患者,如果病变局限且患者能够承受手术,手术切除是可选择的治疗方法。手术类型可能包括胸膜剥离术或胸膜切除术。对于无法手术的患者,全身治疗是主要的治疗手段,可以缓解症状并延长生存时间。目前MPM仍缺乏有效治疗手段,总体预后较差,治疗的总体目标为延长患者生命、改善患者生活质量。
MPM的手术切除方式主要有:
(1)部分胸膜切除术、胸膜切除术或剥脱术、扩大胸膜切除或剥脱术,彻底切除受累胸膜及所有肿瘤组织;
(2`)胸膜外全肺切除术,大范围切除受累胸膜、肺、同侧膈肌和心包。手术的目标旨在切除肉眼可见或可触及的肿瘤,但在实际情况下往往难以达到R0切除。MARS(mesothelioma and radical surgery)研究最早评估了胸膜外全肺切除术在MPM患者中的疗效和安全性。这是一项小样本研究,24例患者接受胸膜外全肺切除,26例患者接受了非手术治疗。两组的中位生存时间分别为14.4个月和19.5个月,与非手术相比,胸膜外全肺切除并未改善患者的总体生存。生活质量方面,两组也未见明显差异。MARS-2研究为一项Ⅲ期、多中心、随机对照试验,进一步比较了扩大胸膜切除术联合化疗组(铂类和培美曲塞)和单独化疗组在可切除MPM患者中的疗效与安全性。共计335例患者入组该研究,其中169例接受手术联合化疗,166例接受单独化疗。在中位随访22.4个月后,手术组的中位生存期为19.3个月,单独化疗组的为24.8个月。由于死亡危险非成比例,研究者在两个时间框架中提出主要结果:随机分配到42个月和超过42个月。在前42个月内,手术组的患者与单独化疗组的患者风险比为1.28(95%CI,1.02~1.60;P=0.032),手术联合化疗组的死亡风险反而增加了28%;而42个月后两组的OS无显著性差异(HR=0.48;95%CI,0.18~1.29;P=0.15)。此外,两组患者的无进展生存期也无显著性差异(HR=0.90;95%CI,0.72~1.11;P=0.33)。手术组患者发生严重不良事件(CTCAE≥3级)的风险也高于单独化疗组患者,发生率比为3.6(P<0.001)。此外,接受手术的患者在生活质量方面也差于单独化疗组。MARS2研究结果提示在可切除MPM患者中,扩大胸膜切除术联合化疗存在更高的死亡风险、更严重的并发症以及更差的生活质量,并未改善患者的生存以及生活质量。因此,目前手术在MPM患者中的作用更加具有争议。
放疗可作为姑息治疗手段缓解MPM胸壁浸润导致的疼痛。对于有疼痛的患者,可以考虑姑息性放疗,但目前尚缺乏高质量循证医学证据支持放疗用于控制疼痛。姑息性放疗通常以1~10次分割的短期疗程进行。一项前瞻性、多中心、单臂研究探索了20Gy/5Fx对疼痛的控制,结果显示在治疗完成后5周后放疗可有效控制疼痛。也有研究探索了放疗作为多学科治疗模式的一部分中的作用,如术后辅助放疗,以预防胸膜手术后沿手术路径的复发、降低局部失败率和提高总生存期。Ⅲ期SAMRT研究显示预防性放疗与延期放疗的手术部位复发率无差异(9%和16%,OR=0.51,95%CI,0.19~1.32),同时预防性放疗也没有改善患者生活质量。另一项单臂、Ⅱ期SMART研究则探索了在接受半侧胸腔调强胸膜放疗(1周内接受25Gy/5Fx放疗至整个同侧半胸,同时向高危区域增加5Gy放疗)后胸膜外全肺切除的临床可行性。共计96名患者接受了SMART治疗。结果显示,47例(49%)患者围手术期30天发生3~4级事件,1例患者围手术期30天死亡(5级事件:肺炎)。中位随访46.8个月后,中位总生存期为24.4个月,中位无病生存期为18.0个月,5年累积远端复发率为63.3%。最常见的首次复发部位是对侧胸部(46%)和腹腔(44%)。目前无论是常规放疗还是半侧胸腔调强胸膜放疗尚未成为目前标准治疗。
肿瘤电场疗法是一种低强度的交替电场,它可以影响细胞有丝分裂过程中特定细胞成分的运动,扰乱有丝分裂。MPM患者发生远处转移概率较低,病灶往往局限于胸膜腔,成为肿瘤电场治疗的潜在干预人群。STELLAR是一项前瞻性、单臂、Ⅱ期试验,旨在评估肿瘤电场治疗联合培美曲塞/铂类一线治疗不可切除的MPM患者的疗效与安全性。最终,80名患者入组研究。中位随访时间为12.5个月后,中位总生存期为18.2个月。最常见的3级或更严重的不良事件是贫血、中性粒细胞减少和血小板减少。皮肤反应是唯一与肿瘤电场治疗相关的不良事件,66%为1~2级,且接受局部皮质类固醇治疗或短暂中断治疗后皮肤反应均消退。目前FDA已批准NovoTTF-100L肿瘤电场治疗用于和培美曲塞、铂基化疗联用,一线治疗无法切除MPM患者。
1)一线治疗:MPM的一线化疗方案首选培美曲塞联合顺铂或培美曲塞联合顺铂及贝伐珠单抗。在Ⅲ期随机对照研究中,与顺铂单药相比,培美曲塞联合顺铂显著延长了不可手术MPM患者的总生存期(12.1个月和9.3个月,P=0.02)。IFCT-GFPC-0701MAPS研究则进一步评估了在培美曲塞/顺铂基础上联合贝伐珠单抗是否可以进一步改善不可手术MPM患者的总生存期。结果显示:与单独使用培美曲塞联合顺铂相比,培美曲塞/顺铂联合贝伐珠单抗进一步延长了患者的总生存期(18.8个月和16.1个月,HR=0.77,P=0.0167)。这两项研究奠定了以培美曲塞/顺铂为基础的含铂双药和三药方案在不可手术MPM患者中的一线地位。但是目前,贝伐珠单抗尚未被NMPA批准用于不可手术MPM患者。对于不可耐受顺铂治疗的患者,亦可采用卡铂方案。
2)二线治疗:可考虑培美曲塞/铂类再挑战治疗。在临床实践中,长春瑞滨和吉西他滨也是可选择方案,但无证据显示其相对于安慰剂可改善患者生存。在近期一项随机Ⅱ期试验(RAMES)中,吉西他滨联合雷莫芦单抗与吉西他滨联合安慰剂相比,可延长患者总体生存(13.8个月和7.5个月,HR=0.71,P=0.028)。
1)一线治疗:CheckMate743奠定了免疫治疗在不可手术MPM患者中一线治疗地位。CheckMate743是一项多中心、随机对照、开放标签的Ⅲ期研究,旨在比较一线使用纳武利尤单抗联合伊匹木单抗与培美曲塞联合铂类的疗效与安全性。研究共计入组605例患者,其中303例患者接受免疫治疗,302例患者接受化疗。结果显示,与化疗相比,一线免疫治疗显著延长了患者的总体生存时间(18.1个月和14.1个月,HR=0.74,P=0.002),降低了26%的死亡风险。亚组分析进一步发现,一线免疫治疗对肉瘤样MPM亚型的患者生存改善更多(18.1个月8.8个月,HR=0.46)。在不良反应方面,免疫治疗组3~4级治疗相关不良事件发生率为30%,而化疗组则为32%。近期更新的3年生存随访时间显示,免疫组和化疗组的3年生存期分别为23%和15%,3年无进展生存率为14%对1%。而3年后,应答者有持续的应答的比例则为28%对0%,提示一线免疫治疗可为部分不可手术MPM患者带来长期生存获益。目前纳武利尤单抗联合伊匹木单抗的双免联合方案已经被NMPA批准用于初治的不可切除的非上皮样MPM成人患者。此外,德瓦鲁单抗联合化疗在一项单臂、Ⅱ期研究中也显示了非常有前景的抗肿瘤活性,目前多项Ⅲ期研究也正在探索免疫治疗联合化疗一线治疗不可切除MPM患者的疗效(NCT03762018、NCT04334759)。
2)二线治疗:CONFIRM研究是一项多中心、安慰剂对照、双盲的随机对照研究,比较了纳武利尤单抗和安慰剂在复发的间皮瘤患者中的疗效与安全性(95%为MPM)。332例患者以2∶1的比例随机分配至纳武利尤单抗组(221例)和安慰剂组(111例)。研究结果显示,纳武利尤单抗较安慰剂显著延长了患者总生存时间(10.2个月和6.9个月,HR=0.69,P=0.009)。同时,纳武利尤单抗还延长了患者的无进展生存时间(3.0个月和1.8个月,HR=0.67,P=0.012)。在安全性方面,纳武利尤单抗组的严重不良事件发生率为41%,而化疗组为44%。此外,还有多项Ⅱ期研究也探索了其他免疫治疗药物在复发不可手术MPM患者中的疗效,包括纳武利尤单抗联合伊匹木单抗、帕博利珠单抗等,也显示了一定疗效。
3)其他免疫治疗:溶瘤病毒为肿瘤患者提供了另一种基于免疫的方法。通过肿瘤内注射,可在肿瘤细胞中特异性复制,导致直接裂解,并将肿瘤微环境从免疫抑制状态改变为炎症状态,从而促进抗肿瘤T细胞反应。ONCOS-102是一种表达粒细胞-巨噬细胞集落刺激因子的溶瘤腺病毒,可使肿瘤微环境进入免疫刺激状态。在一项Ⅱ期、随机对照研究中,ONCOS-102联合化疗组显示了良好的安全性和初步的抗肿瘤活性,初治患者中两组的中位总生存时间分别为20.3个月和13.5个月。此外,Ⅲ期研究INFINITE正在评估胸膜内给药腺病毒递送干扰素α-2b(rAd-IFN)联合塞来昔布和吉西他滨治疗MPM患者的有效性和安全性。
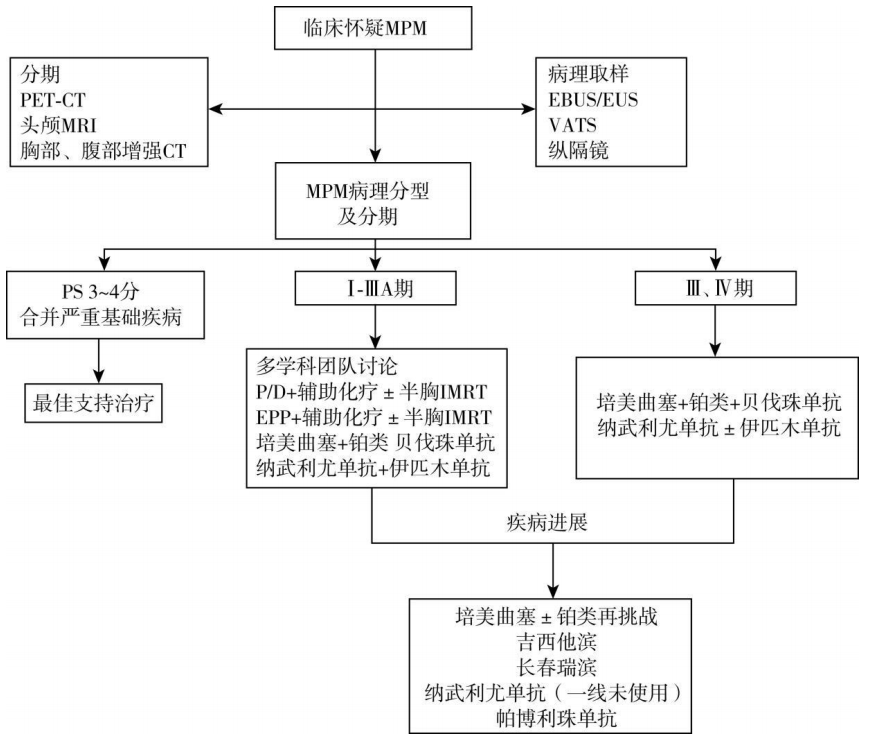
图47-1胸膜间皮瘤诊疗流程
[1]TsaoAS,PassHI,RimnerA,etal.Neweraformalignantpleuralmesothelioma:updatesontherapeuticoptions.JournalofClinicalOncology,2022,40:681-692.[2]JanesSM,AlrifaiD,FennellDA.Perspectivesonthetreatmentofmalignantpleuralmesothelioma.TheNewEnglandJournalofMedicine,2021,385:1207-1218.[3]赫捷,魏文强.2019中国肿瘤登记年.北京:人民卫生出版社,2020:2016-2017.[4]中国医师协会肿瘤多学科诊疗专业委员会.中国恶性胸膜间皮瘤临床诊疗指南(2021版)[.中华肿瘤杂志,2021,43(4):383-394.[5]KindlerHL,IsmailaN,ArmatoSG,etal.Treatmentofmalignantpleuralmesothelioma:AmericanSocietyofClinicalOncologyclinicalpracticeguideline.JournalofClinicalOncology,2018,36:1343-1373.[6]Galateau-SalleF,ChurgA,RoggliV,etal.The2015WorldHealthOrganizationclassificationoftumorsofthepleura:advancessincethe2004classification.Journalofthoraciconcology,2016,11:142-154.[7]TreasureT,Lang-LazdunskiL,WallerD,etal.Extra-pleuralpneumonectomyversusnoextra-pleuralpneumonectomyforpatientswithmalignantpleuralmesothelioma:clinicaloutcomesoftheMesotheliomaandRadicalSurgery(MARS)randomisedfeasibilitystudy.TheLancetOncology,2011,12:763-772.[8]LimE,DarlisonL,EdwardsJ,etal.MesotheliomaandRadicalSurgery2(MARS2):protocolforamulticentrerandomisedtrialcomparing(extended)pleurectomydecorticationversusno(extended)pleurectomydecorticationforpatientswithmalignantpleuralmesothelioma.BMJOpen,2020,10:e038892.[9]LimE,WallerD,LauK,etal.Extendedpleurectomydecorticationandchemotherapyversuschemotherapyaloneforpleuralmesothelioma(MARS2):aphase3randomisedcontrolledtrial.LancetRespirMed.2024Jun;12(6):457-466.[10]RimnerA,ZaudererMG,GomezDR,etal.Phaseiistudyofhemithoracicintensity-modulatedpleuralradiationtherapy(imprint)aspartoflung-sparingmultimodalitytherapyinpatientswithmalignantpleuralmesothelioma.JClinOncol,2016,34(23):2761-2768.[11]ShaikhF,ZaudererMG,vonReibnitzD,etal.Improvedoutcomeswithmodernlung-sparingtrimodalitytherapyinpatientswithmalignantpleuralmesothelioma.JournalofThoracicOncology,2017,12:993-1000.[12]CliveAO,TaylorH,DobsonL,etal.Prophylacticradiotherapyforthepreventionofprocedure-tractmetastasesaftersurgicalandlarge-borepleuralproceduresinmalignantpleuralmesothelioma(SMART):amulticentre,open-label,phase3,randomisedcontrolledtrial.TheLancetOncology,2016,17:1094-1104.[13]ChoBCJ,DonahoeL,BradburyPA,etal.Surgeryformalignantpleuralmesotheliomaafterradiotherapy(SMART):finalresultsfromasingle-centre,phase2trial.TheLancetOncology,2021,22:190-197.[14]CeresoliGL,AertsJG,DziadziuszkoR,etal.TumourTreatingFieldsincombinationwithpemetrexedandcisplatinorcarboplatinasfirst-linetreatmentforunresectablemalignantpleuralmesothelioma(STELLAR):amulticentre,single-armphase2trial.TheLancetOncology,2019,20:1702-1709.[15]VogelzangNJ,RusthovenJJ,SymanowskiJ,etal.PhaseⅢstudyofpemetrexedincombinationwithcisplatinversuscisplatinaloneinpatientswithmalignantpleuralmesothelioma.JournalofClinicalOncology,2003,21:2636-2644.[16]ZalcmanG,MazieresJ,MargeryJ,etal.BevacizumabfornewlydiagnosedpleuralmesotheliomaintheMesotheliomaAvastinCisplatinPemetrexedStudy(MAPS):arandomised,controlled,open-label,phase3trial.Lancet,2016,387:1405-1414.[17]PetrelliF,ArditoR,ContiB,etal.Asystematicreviewandmeta-analysisofsecond-linetherapiesfortreatmentofmesothelioma.Respiratorymedicine,2018;141:72-80.[18]PintoC,ZucaliPA,PaganoM,etal.Gemcitabinewithorwithoutramucirumabassecond-linetreatmentformalignantpleuralmesothelioma(RAMES):arandomised,double-blind,placebo-controlled,phase2trial.TheLancetOncology,2021,22:1438-1447.[19]BaasP,ScherpereelA,NowakAK,etal.First-linenivolumabplusipilimumabinunresectablemalignantpleuralmesothelioma(CheckMate743):amulticentre,randomised,open-label,phase3trial.Lancet,2021,397:375-386.[20]PetersS,ScherpereelA,CornelissenR,etal.First-linenivolumabplusipilimumabversuschemotherapyinpatientswithunresectablemalignantpleuralmesothelioma:3-yearoutcomesfromCheckMate743.AnnalsofOncology,2022,33:488-499.[21]NowakAK,LesterhuisWJ,KokPS,etal.Durvalumabwithfirst-linechemotherapyinpreviouslyuntreatedmalignantpleuralmesothelioma(DREAM):amulticentre,single-arm,phase2trialwithasafetyrun-in.TheLancetOncology,2020,21:1213-1223.[22]FennellDA,EwingsS,OttensmeierC,etal.Nivolumabversusplaceboinpatientswithrelapsedmalignantmesothelioma(CONFIRM):amulticentre,double-blind,randomised,phase3trial.TheLancetOncology,2021,22:1530-1540.[23]ScherpereelA,MazieresJ,GreillierL,etal.Nivolumabornivolumabplusipilimumabinpatientswithrelapsedmalignantpleuralmesothelioma(IFCT-1501MAPS2):amulticentre,open-label,randomised,non-comparative,phase2trial.TheLancetOncology,2019,20:239-253.[24]AlleyEW,LopezJ,SantoroA,etal.Clinicalsafetyandactivityofpembrolizumabinpatientswithmalignantpleuralmesothelioma(KEYNOTE-028):preliminaryresultsfromanon-randomised,open-label,phase1btrial.TheLancetOncology,2017,18:623-630.[25]PonceS,CedresS,RicordelC,etal.ONCOS-102pluspemetrexedandplatinumchemotherapyinmalignantpleuralmesothelioma:arandomizedphase2studyinvestigatingclinicaloutcomesandthetumormicroenvironment.Journalforimmunotherapyofcancer,2023,11(9):e007552.
来源:国家卫生健康委官网
查看更多