查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





随着免疫检查点抑制剂(ICI)适应证逐渐扩大,临床应用人群越来越多,在关注免疫治疗疗效的同时,临床医生和患者开始更加关注免疫治疗相关不良反应(irAE)。为了保障免疫治疗临床应用的规范化和安全性,中国临床肿瘤学会(CSCO)推出了首部《CSCO免疫检查点抑制剂相关的毒性管理指南》(以下简称《指南》)。
免疫治疗相关性肺炎是一种起病方式多样,临床、影像和病理表现各异的ICI相关的毒副反应。在本文中,上海市肺科医院苏春霞教授针对免疫治疗相关肺毒性的表现和处理原则进行了详细介绍。
发生率及影响因素
免疫治疗相关肺炎的发生率(所有级别、3级以上及死亡)相对较低。临床研究显示,接受抗PD-1/PD-L1单抗治疗的患者,肺炎发生率在0~11%之间,3级以上的肺炎发生率在0-4.3%之间[1-5]。一项真实世界的研究报道,在14种特定不良反应中,间质性肺病的发生率最高,为9.57%[6]。
免疫治疗相关性肺炎与肿瘤类型有关。研究显示,不同癌种的发生比值有所不同。Nishino等人的meta分析数据表明,在非小细胞肺癌(NSCLC)中,各级别肺炎发生率均高于黑色素瘤(4.1% 对 1.6%; P =0 .002),且在NSCLC 中肺炎相关的死亡率更高[5]。同样在肾癌中,各级别肺炎的发生率也高于黑色素瘤(4.1% 对 1.6%; P < 0.001)。
另外,对于不同种类的ICI,免疫治疗相关性肺炎的发生率也存在差异。有研究显示,PD-1抑制剂与PD-L1抑制剂相比,所有级别的肺炎发生率更高(3.6%对1.3%),重度肺炎发生率更高(1.1% 对0.4%)[7]。而CTLA-4抑制剂与PD-1/PD-L1抑制剂相比,免疫治疗相关性肺炎的发生率较低,大概在1%左右[8-9]。
研究显示,免疫治疗与其他药物的联合治疗增加了免疫治疗相关性肺炎发生率,抗PD-1/PD-L1单抗联合CTLA4抑制剂治疗与单药治疗相比,各级和3级以上不良事件的发生率增加了3倍左右[10]。免疫联合化疗也增加了肺炎发生率,但没有达到统计学差异[11]。值得注意的是,在EGFR突变阳性的肺癌患者中,ICI单药治疗可出现致死性的肺毒性,ICI联合EGFR-TKI更会显著增加肺炎的发生率和死亡率[12-15]。
有意思的是,免疫治疗相关性肺炎的发生率与ICI的用药剂量无关。一项Meta研究对16个Ⅱ/Ⅲ期临床研究中的6360例多瘤种患者进行了分析,结果显示,所有级别及3/4级肺炎发生率与纳武利尤单抗及帕博利珠单抗用药剂量无相关性[16]。
最后,针对东西方NSCLC人群免疫相关性肺炎的调查显示,东西方人群发生率基本相似,东方人群稍高,但需要更多数据支持[17-19]。
发生机制与风险因素
免疫治疗相关性肺炎的发生机制目前还在探索中,可能机制包括以下三方面,①T细胞活性增强,对存在正常组织和肿瘤细胞上的抗原产生应答;②预先存在的自身抗体的增加(如甲状腺抗体);③炎症因子的增加。
有研究结果提示,PD-1抑制剂与PD-L1抑制剂肺炎的发生率不同,可能与一种排斥导向分子(RGMb)的激活有关,RGMb可与PD-L2结合抑制肺部的炎症反应[20]。
免疫治疗相关性肺炎可能在任何时间发生,但是与其他免疫相关毒副反应相比,肺炎发生的时间相对较晚,中位发病时间在2.8个月左右(9天~19.2个月)[2],而联合治疗患者肺炎的发病时间有提前的趋势,NSCLC发生肺炎的起始时间要早于恶性黑色素瘤[21]。
免疫治疗相关性肺炎的高危人群包括,①接受EGFR-TKI联合免疫治疗的驱动基因敏感突变阳性的NSCLC患者;②先前存在慢性肺部疾病(如COPD、肺纤维化等)或目前存在肺部活动性感染的患者;③免疫治疗相关性肺炎及肺炎相关的死亡的其他高危因素尚不明确。有研究提示,病理类型、联合治疗、年龄、治疗前接受过胸部放疗等是肺毒性发生率增加的因素,但尚需要更多的数据支持。
临床表现
1.症状:包括呼吸困难(53%)、咳嗽(35%)、发热(12%)、胸痛(7%),偶尔会发生缺氧且会快速恶化以致呼吸衰竭,但是约1/3患者无任何症状,仅存在影像学异常[1]。
2.体征:缺乏特异性,重度患者听诊可闻及双肺底吸气末期爆裂音(Velcro啰音)。
3.影像:缺乏特异性,可表现为隐源性机化性肺炎(COP)、磨玻璃样型、 间质性肺炎(NSIP)、 过敏性肺炎(HP)和其他非特异性肺炎,需与肺部感染、肿瘤淋巴管扩散、 肿瘤肺部进展及弥漫性肺泡出血相鉴别。当然,有影像学改变时,临床上也可以无任何症状,或合并初次出现或恶化的呼吸困难、咳嗽、 哮喘、胸痛、运动耐量减少、乏力和吸氧[22]。
4.病理:缺乏特异性,镜下可表现为细胞间质性肺炎、组织性肺炎、弥漫性肺泡损伤、形成不良的肉芽肿、嗜酸性粒细胞浸润,因此要从病理上区分免疫介导的肺炎、免疫相关的肿瘤炎症和肿瘤进展具有挑战性[1]。
诊断与处理
免疫相关性肺炎诊断比较困难:更多需要排除诊断,需排除全身性疾病肺部表现。一般除了查体和询问病史,影像学检查,可经支气管镜检查行活检或支气管肺泡灌洗以排除肺部感染[23]。
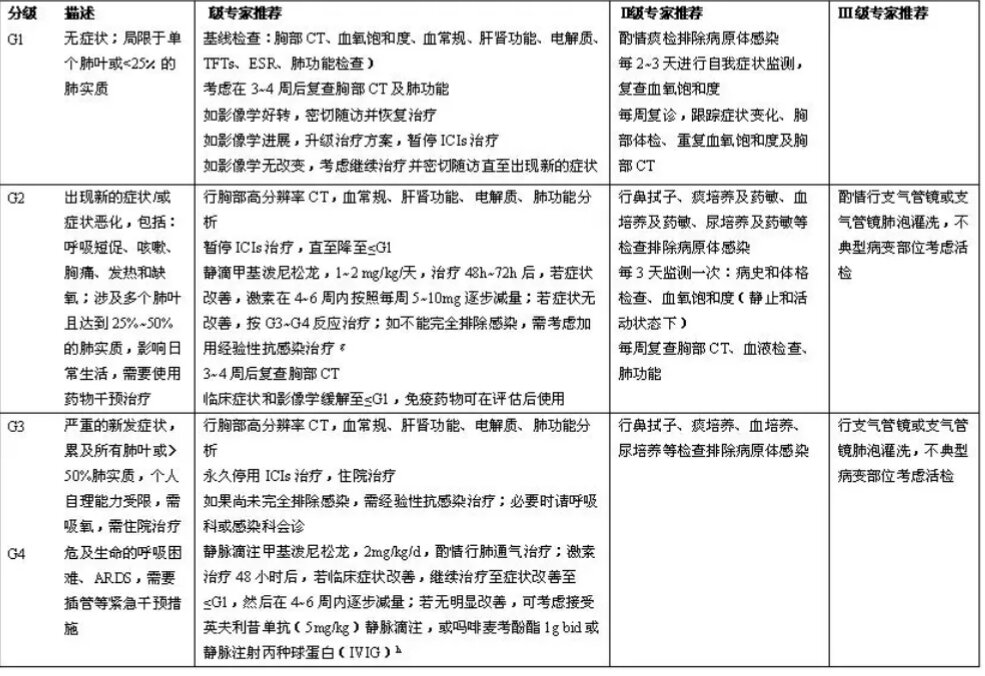
图 免疫治疗相关性肺炎处理原则[24]
预后
在所有肺炎病例中,72%的患者为1~2级, 与甲状腺炎和肝炎等自限性免疫不良反应不同,大部分的免疫治疗相关性肺炎需要激素或免疫抑制剂的治疗[1]。据文献报导,超过85%的患者可以通过停药和免疫抑制治疗得到缓解或治愈,但是有10-15%的患者使用激素治疗之后得不到缓解。双免疫治疗较单免疫治疗患者发生免疫治疗相关性肺炎更难以恢复,而且对免疫抑制剂的疗效相对差,这部分患者的死亡率很高[1]。
此外,虽然多数肺毒性可通过暂停给药±皮质类固醇激素得以控制甚至逆转,但激素用量以及减少时间目前数据仍旧不足,而且肺毒性恢复后,是否继续使用ICI仍旧需要更多数据。
参考文献
1. Naidoo J, Wang X, Woo KM, et al, Pneumonitis in Patients Treated With Anti-Programmed Death-1/Programmed Death Ligand 1 Therapy. J Clin Oncol, 2017. 35(7): p. 709-717.
2. Naidoo J, Page DB, Li BT et al, Toxicities of the anti-PD-1 and anti-PD-L1 immune checkpoint antibodies. Ann Oncol 26:2375-91, 2015. Erratum in: Ann Oncol 27:1362, 2016
3. Suresh K, Voong KR, Shankar B, et al, Pneumonitis in Non-Small Cell Lung Cancer patients receiving Immune Checkpoint Immunotherapy: incidence and risk factors. J Thorac Oncol, 2018.
4. Khunger M, Rakshit S, Pasupuleti V, et al, Incidence of Pneumonitis With Use of Programmed Death 1 and Programmed Death-Ligand 1 Inhibitors in Non-Small Cell Lung Cancer: A Systematic Review and Meta-Analysis of Trials. Chest, 2017. 152(2): p. 271-281.
5. Nishino M, Giobbie-Hurder A, Hatabu H, et al, Incidence of Programmed Cell Death 1 Inhibitor-Related Pneumonitis in Patients With Advanced Cancer: A Systematic Review and Meta-analysis. JAMA Oncol, 2016. 2(12): p. 1607-1616.
6.
7. Pillai RN, Behera M, Owonikoko TK, et al, Comparison of the toxicity profile of PD-1 versus PD-L1 inhibitors in non-small cell lung cancer: A systematic analysis of the literature. Cancer, 2018. 124(2): p. 271-277.
8. Tirumani SH, Ramaiya NH, Keraliya A, et al,Radiographic profiling of immune-related adverse events in advanced melanoma patients treated with ipilimumab. Cancer Immunol Res 3:1185-1192, 2015;
9. Chuzi S, Tavora F, Cruz M, et al, Clinical features, diagnostic challenges, and management strategies in checkpoint inhibitor-related pneumonitis. Cancer Manag Res 9:207-213,2017.
10. Al-Dliw M, Megri M, Shahoub I, et al, Pembrolizumab reactivates pulmonary granulomatosis. Respir Med Case Rep, 2017. 22: p. 126-129.
11. Su Q, Zhu, E. C, Wu, J. B, et al. Risk of Pneumonitis and Pneumonia Associated With Immune Checkpoint Inhibitors for Solid Tumors: A Systematic Review and Meta-Analysis. - Front Immunol. 2019 Feb 4;10:108.
12. Lisberg A, Cummings A, Goldman JW, et al, A Phase II Study of Pembrolizumab in EGFR-Mutant, PD-L1+, Tyrosine Kinase Inhibitor Naive Patients With Advanced NSCLC. J Thorac Oncol, 2018. 13(8): p. 1138-1145.
13. Oshima Y, Tanimoto T, Yuji K, et al, EGFR-TKI-Associated Interstitial Pneumonitis in Nivolumab-Treated Patients With Non-Small Cell Lung Cancer. JAMA Oncol, 2018. 4(8): p. 1112-1115.
14. Ahn MJ, Sun JM, Lee SH, et al, EGFR TKI combination with immunotherapy in non-small cell lung cancer. Expert Opin Drug Saf, 2017. 16(4): p. 465-469.
15. Ahn MJ, Yang J, Yu H, et al. 136O: osimertinib combined with durvalumab in EGFR-mutant non-small cell lung cancer: results from the TATTON phase Ib trial. J Thorac Oncol. 2016;11:S115.
16. Wu J, Hong D, Zhang X, et al. PD-1 inhibitors increase the incidence and risk of pneumonitis in cancer patients in a dose-independent manner: a meta-analysis. - Sci Rep. 2017 Mar 8;7:44173.
17. Brahmer J, Reckamp KL, Baas P, et al. Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. - N Engl J Med. 2015 Jul 9;373(2):123-35.
18. Hida T, Nishio M, Nogami N, et al. Efficacy and safety of nivolumab in Japanese patients with advanced or recurrent squamous non-small cell lung cancer. - Cancer Sci. 2017 May;108(5):1000-1006.
19. Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. - N Engl J Med. 2015 Oct 22;373(17):1627-39.
20. Xiao Y, Yu S, Zhu B, et al. RGMb is a novel binding partner for PD-L2 and its engagement with PD-L2 promotes respiratory tolerance. - J Exp Med. 2014 May 5;211(5):943-59.
21. Delaunay M, Cadranel J, Lusque A, et al, Immune-checkpoint inhibitors associated with interstitial lung disease in cancer patients. Eur Respir J, 2017. 50(2).
22. Naidoo J, Page DB, Li BT, et al, Toxicities of the anti-PD-1 and anti-PD-L1 immune checkpoint antibodies. Ann Oncol 2015;26:2375–91.
23. Suresh K, Naidoo J, Lin CT, et al, Immune checkpoint immunotherapy for non-small cell lung cancer: benefits and pulmonary toxicities. Chest, 2018.
24. 中国临床肿瘤学会(CSCO): 免疫检查点抑制剂相关的毒性管理指南。
作者 | 苏春霞(上海市肺科医院)
编辑 | 郝冉(中国医学论坛报)
查看更多