查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





近日,中国医学科学院肿瘤医院肿瘤内科杨林教授团队和病理科合作的关于间变性淋巴瘤激酶(ALK)重排阳性晚期胰腺癌诊治的病例报告发表在《肿瘤学前沿》(Frontiers in Oncology,IF=6.244)上。中国医学科学院肿瘤医院肿瘤内科研究生欧凯作为第一作者,刘秀、介入治疗科研究生杨伊与病理科李卫华教授及应建明教授作为共同作者。


ALK重排阳性在胰腺癌中罕见,但仍可能发生在 KRAS野生型患者(占所有胰腺癌患者比例少于0.2%,KRAS野生型患者可达1.1%)中。
本文报道了一位34岁患有ALK重排阳性/KRAS野生型胰腺癌的年轻男性患者,他对化疗耐药,克唑替尼治疗有效,在后续发生脑转移后改用阿来替尼治疗仍效果良好,目前生存时间已超过36个月,且生活质量好。
这一病例表明,分子病理检测对于部分胰腺癌患者的精准治疗具有不可替代的作用。胰腺癌死亡率在全球癌症中排名第七。局部晚期胰腺癌患者的中位总生存(mOS)期为 8~12个月,而远处转移患者的mOS期仅为3~6个月。虽然手术是治愈胰腺癌的唯一方法,但大约 80% 患者的肿瘤在初诊时即无法切除。化疗是大多数胰腺癌患者的主要治疗手段,但疗效有限。
分子生物学的发展促进了基于特定生物标志物的靶向治疗和免疫治疗的发展,并为多种肿瘤的预后带来了益处。但大部分胰腺癌患者的常见突变基因,如KRAS、p16/CDKN2A、TP53和SMAD4等,尚未匹配有效的靶向治疗方法。免疫治疗在胰腺癌治疗中也疗效甚微。
ALK融合蛋白是精准医学的一个明星靶点。已证明ALK 抑制剂对多种ALK 重排阳性肿瘤患者有效。ALK 重排于 2017年首次在胰腺癌中报道,迄今为止仅报道8例(包括本例)。
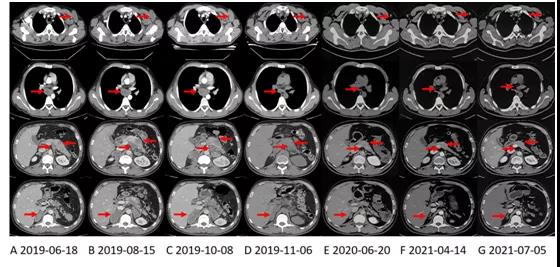
本病例于2019年6月因上腹痛入院,查体发现左侧腋窝可触及多个肿大淋巴结。腹部增强CT(图2A)显示胰体尾部有一10.0*4.3cm肿块,双侧肾上腺多发转移,胸腹腔多发肿大淋巴结。
2019年7月3日行左侧腋窝淋巴结活检,病理示纤维组织中低分化腺癌浸润。免疫组化 (IHC) 染色表明细胞CA19-9、CK18、CK19、CK7、AE1/AE3、MUC5AC 呈阳性,CDX-2、CK20 和 MUC6 呈阴性。
综合以上结果明确诊断为胰腺癌。患者经过一线3个周期XELOXIRI(伊立替康+奥沙利铂+卡培他滨)和二线2个周期白蛋白紫杉醇+吉西他滨化疗,效果不佳,2019年10月复查CT(图2C)显示肿瘤进展。
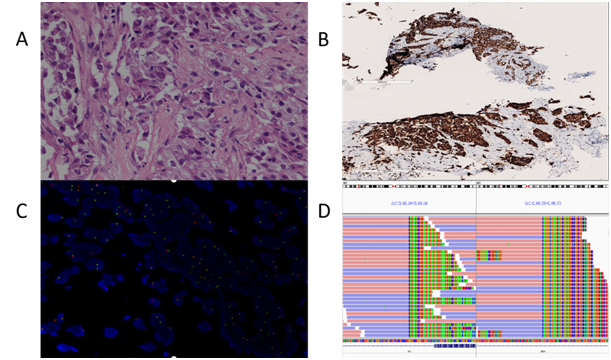
随后,对取自左侧腋窝淋巴结穿刺的肿瘤组织进行了下一代测序(NGS)(包含 520 个癌症相关基因),显示EGFR、KRAS、BRAF无突变,肿瘤突变负荷 (TMB) 为 0.8 个突变/Mb,微卫星状态稳定 (MSS)。但发现了ALK基因重排((EML4(外显子6)-ALK(外显子 20)/ALK(外显子20)-EML4(外显子 17)),根据 ALK 重排的致病机制 ,EML4(外显子 6)-ALK(外显子 20)这种重排形式可能致癌,但在胰腺癌中发生罕见。ALK 重排通过荧光原位杂交试验(FISH)和免疫组织化学(IHC)交叉验证(图3 A H&E;B IHC;C FISH;D NGS)。
随后患者开始口服第一代ALK抑制剂克唑替尼,250mg每天两次,达到了明显的临床缓解。治疗3天后,可触及的左侧腋窝淋巴结迅速缩小。1个月后患者腹痛消失,CT显示肿瘤明显缩小(图2D)。不良事件是1级腹泻。治疗持续了8个月。
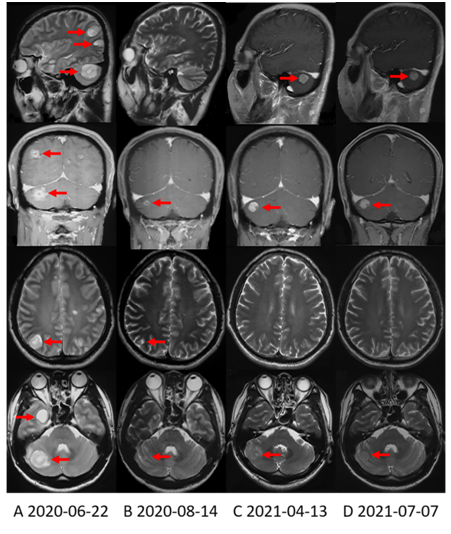
2020年6月,患者主诉头痛,左眼视力下降,左侧肢体平衡障碍,查 CT和MRI显示发生脑转移(图4A)。随后患者开始口服血脑屏障渗透性高的第二代ALK抑制剂阿来替尼600 mg每天两次,治疗过程中上述新发症状迅速缓解,无不良反应发生。脑部病变明显缩小(图4B)。
但在持续治疗近10个月后,2021年4月,患者复查脑部MRI显示右侧小脑(图4C)和左侧额叶病灶增大。脑转移进展,但颅外病变仍然稳定(图2F))。
患者于2021年4月进行了循环肿瘤DNA(ctDNA)检测,结果新发现10个基因突变,但暂时没有可针对这些突变的用药策略。因此,在继续应用阿来替尼的基础上,患者于2021年6月接受了脑部放疗。在最近一次检查中,脑部病变(图4D)和其他部位(图2G)病情稳定。
包括本例,迄今为止全球仅报道了8例 ALK 重排阳性胰腺癌病例,其平均和中位发病年龄分别为42岁和38岁(范围 32-72)。
除一例72岁的患者外,其余患者的发病年龄均在50岁以下。胰腺癌总体平均发病年龄晚,但这8例ALK重排阳性胰腺癌患者发病年龄早,所以,对于年轻的胰腺癌患者,应考虑ALK 重排阳性可能。
这8例患者原发胰腺病变的主体多数在胰头(7/8),但本例除外(位于胰体和胰尾)。8例均为KRAS野生型。根据 Singhi AD 等人发表的 3594 例胰腺导管腺癌 (PDAC) 患者的基因组谱分析,12% 的 PDAC (n = 445)不存在 KRAS 变异,在这些KRAS阴性患者中,ALK 重排阳性患者占比仅1.1% (n=5)。在我们的数据集中,最常见的 ALK 重排类型是 EML4-ALK (5/8),其他类型的融合包括 STRN-ALK (1/8)、DCTN1 –ALK (1/8) 和 PPFIBP1-ALK (1/ 8)。
研究表明,EML4-ALK融合亚型也直接影响ALK抑制剂的有效性。原因之一可能是亚型的结构稳定性不同。在这8位患者中,6 位患者接受了 ALK抑制剂,有 5位接受了克唑替尼, 1位接受了阿来替尼作为一线靶向治疗。服用克唑替尼的5位患者中位无进展生存期(PFS)为 8.5个月(范围2~17个月),与 ALK 重排阳性非小细胞肺癌(NSCLC)相似(在NSCLC中ALK重排常见,且应用ALK抑制剂后其预后相对较好),显著优于晚期胰腺癌的总体中位PFS。依照以往的治疗总结,ALK抑制剂的耐药性是不可避免的。由于血脑屏障(BBB)渗透性差,克唑替尼颅内疗效较差。
本病例经历了颅外病变无进展的 BMs,表明对克唑替尼的耐药机制很可能是由于 BBB 的渗透性差。阿来替尼是一种强效的第二代 ALK 抑制剂,具有高 BBB 渗透率。其对 BMs 的疗效已在 Ⅰ~Ⅲ期临床试验中得到评估。
因此,研究者选取了阿来替尼替代克唑替尼对患者继续进行治疗。但阿来替尼在控制脑部病变10月后,近期治疗效果也显露疲态,如果这例患者的脑转移继续进展,可以改用第三代ALK抑制剂劳拉替尼,它可以抑制多种已知的ALK耐药突变,并具有高血脑屏障通透性。胰腺癌通常转移到肝脏(76%),其次是肺(19.9%)、远处淋巴结(9.4%) 和骨骼(6.8%),脑转移极为罕见(0.6%)(8)。
这是因为大多数患者的生存时间不足以发生脑转移,也有可能有相当一部分发生脑转移但没有神经系统症状的胰腺癌患者未被发现。

ALK 重排在胰腺癌中极为罕见。
BM 在胰腺癌中也很少见。据我们所知,这是 EML4-ALK 融合并伴有BMs的胰腺癌用克唑替尼治疗的第一份报告。总览全文,本病例揭示了ALK抑制剂在对既往化疗耐药后ALK重排阳性和KRAS野生型转移性胰腺癌中表现出明显疗效,显示了精准医疗的优势。
此外,最近发表的真实世界研究表明,与接受非分子病理学匹配疗法的患者相比,分子病理学分析和相应的匹配疗法不仅可行,而且显着改善了相应胰腺癌亚组患者的生存结局。
此病例表明,应适时对胰腺癌患者进行基于肿瘤和胚系的基因分析,尤其是对标准化疗耐药但身体状况良好的患者。最后,由于治疗方法优化延长了患者的生存期,预计胰腺癌 BM 的发生率会增加。因此,当晚期胰腺癌患者出现神经系统相关症状时,应及时警惕脑转移的发生。
中国医学科学院肿瘤医院病理科 平台发布
查看更多