查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





首都医科大学宣武医院王培昌教授团队经过多年深入研究,于2026年1月6日在Aging Cell以"Synaptic Vesicle Glycoprotein 2A Suppresses Amyloidogenesis Beyond Its Synaptic Role: A Novel Mechanism Disrupting BACE1 Binding and Altering APP Localization"为题发表多年来的研究结果。其证实了突触囊泡蛋白2A(SV2A)影响阿尔茨海默病(AD)发病的新机制,为疾病的早期干预提供了新方向。
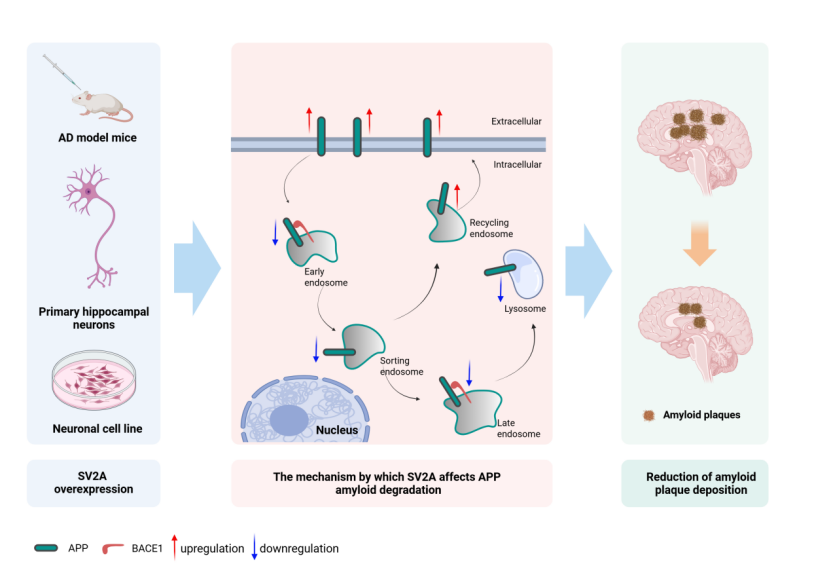
图1 文章摘要图
一、研究背景
AD是一种以认知功能进行性衰退为特征的神经退行性疾病,目前全球患病人数已超过4700万。据2021年统计数据显示,当年因AD导致的死亡人数达119399人;而2023年全球痴呆症相关医疗与社会照护成本已高达3466亿美元,给公共卫生体系及家庭带来沉重负担。尽管近年来针对AD经典病理假说相关靶点的药物研发有所进展,至今尚未有能够完全阻断或逆转疾病进程的疗法问世,因此早期干预已成为延缓AD发展的关键方向。
AD的病理级联反应以β-淀粉样蛋白(Aβ)沉积为关键始动环节,其生成主要源于淀粉样前体蛋白(APP)的淀粉样代谢途径。因此,阐明该途径的触发机制是实现AD早期干预的核心科学问题。研究发现,SV2A在AD早期即出现表达下降,且其水平与Aβ沉积呈显著负相关,然而二者之间的分子联系尚未明确。尤其值得注意的是,SV2A是否直接参与调控APP的淀粉样降解过程,目前仍亟待阐明。
传统上,SV2A被认为主要参与突触囊泡循环等突触功能。然而,本研究提出一个尚未被充分探讨的科学假设:SV2A可能具备独立于其经典突触角色之外的新功能,能够直接调控APP代谢及Aβ生成。若能证实SV2A在APP加工途径中的直接作用,不仅可突破对其功能的传统认知,更有望从全新视角揭示突触功能障碍与Aβ病理之间的内在联系,从而连接AD两大核心病理特征。
综上所述,阐明SV2A在APP代谢中的调控机制,不仅有助于深入理解AD早期病理进程,更可能为开发作用于Aβ生成上游的新型早期干预策略提供原创性靶点,为实现临床症状前阻断疾病进展开辟新的研究方向。
二、研究方法
本研究利用脑立体定位技术注射腺相关病毒(AAV)成功构建了SV2A过表达的A模型小鼠,并通过多种技术手段系统揭示了SV2A调控淀粉样蛋白沉积的分子机制。
实验整合了细胞表面生物素化、双分子荧光互补、免疫共沉淀、pull-down及行为学检测等方法,从细胞、动物组织及人体样本多个层面开展综合分析,构建了完整的证据体系。
三、研究结果
本研究通过体内外实验体系,系统阐明了SV2A在AD病理进程中的关键调控作用。结果显示,SV2A过表达可显著减少APP/PS1小鼠脑内的Aβ斑块沉积。
在机制层面,本研究首次鉴定SV2A为一种新型APP结合蛋白,其通过抑制APP与β位点淀粉样前体蛋白裂解酶1(BACE1)在内体-溶酶体网络中的互作,从而削弱APP的淀粉样蛋白生成途径。
进一步研究发现,SV2A过表达能够重塑APP的亚细胞分布模式,表现为其在早期内体、晚期内体及溶酶体中的定位减少,并向循环内体与细胞膜转移。这些结果共同揭示了SV2A通过调控APP 细胞内转运及与BACE1的相互作用,抑制Aβ生成的分子机制。
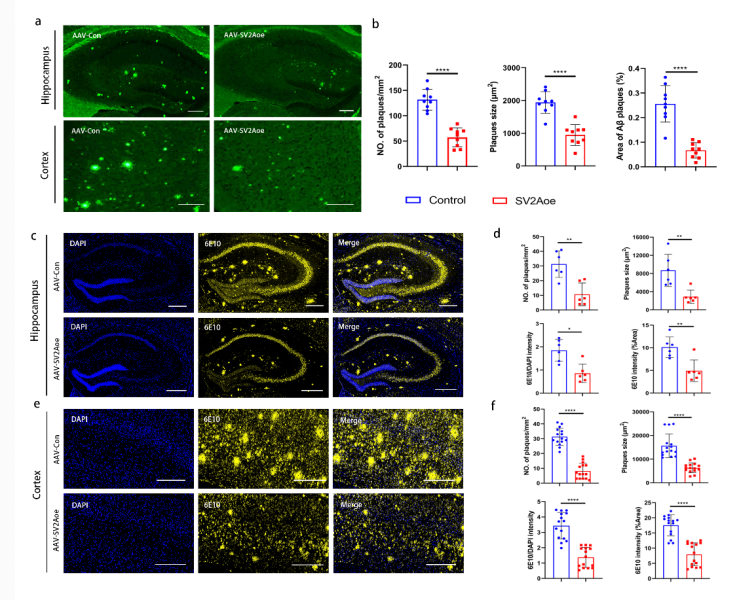
图2 SV2A上调的APP/PS1小鼠中淀粉样蛋白沉积情况
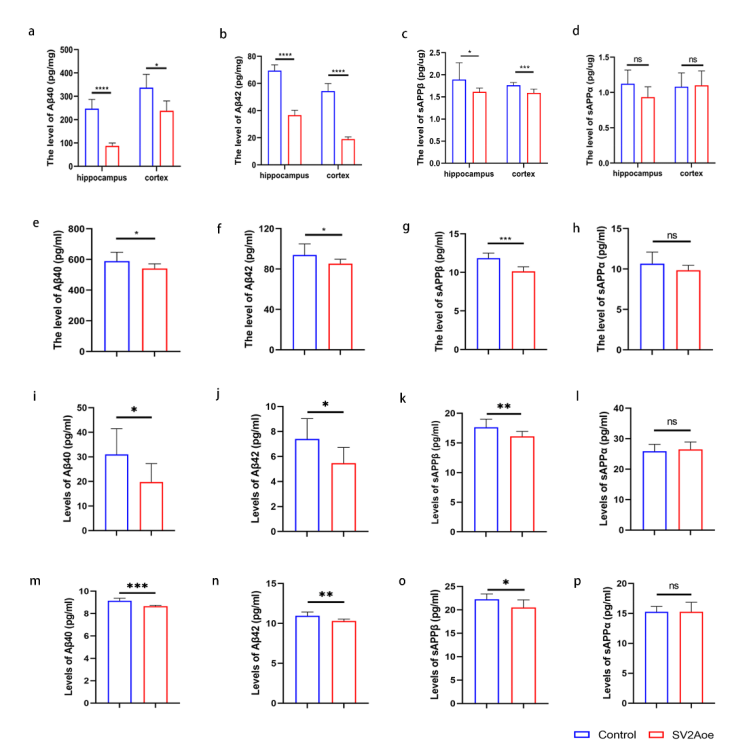
图3 SV2A对APP降解的体内外影响研究
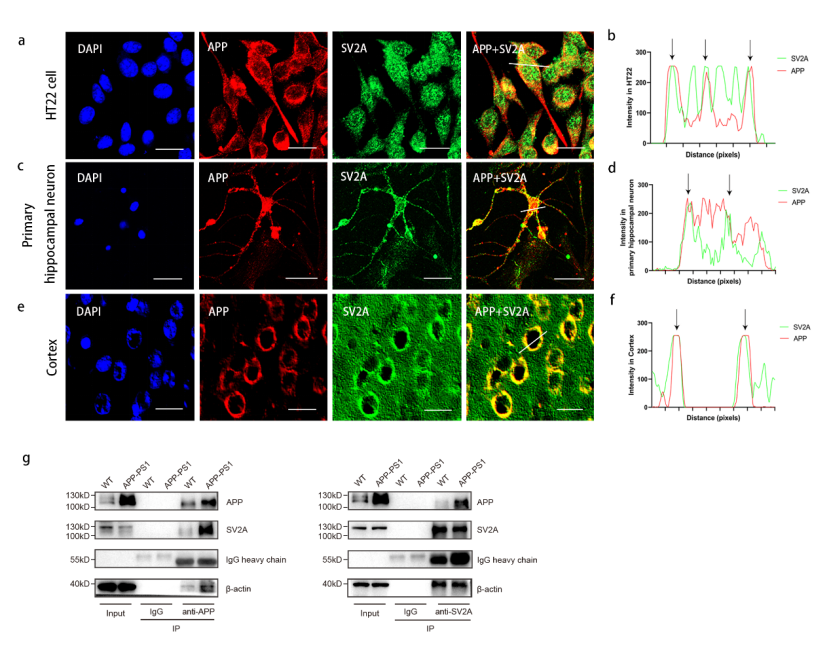
图4 SV2A与APP的结合实验
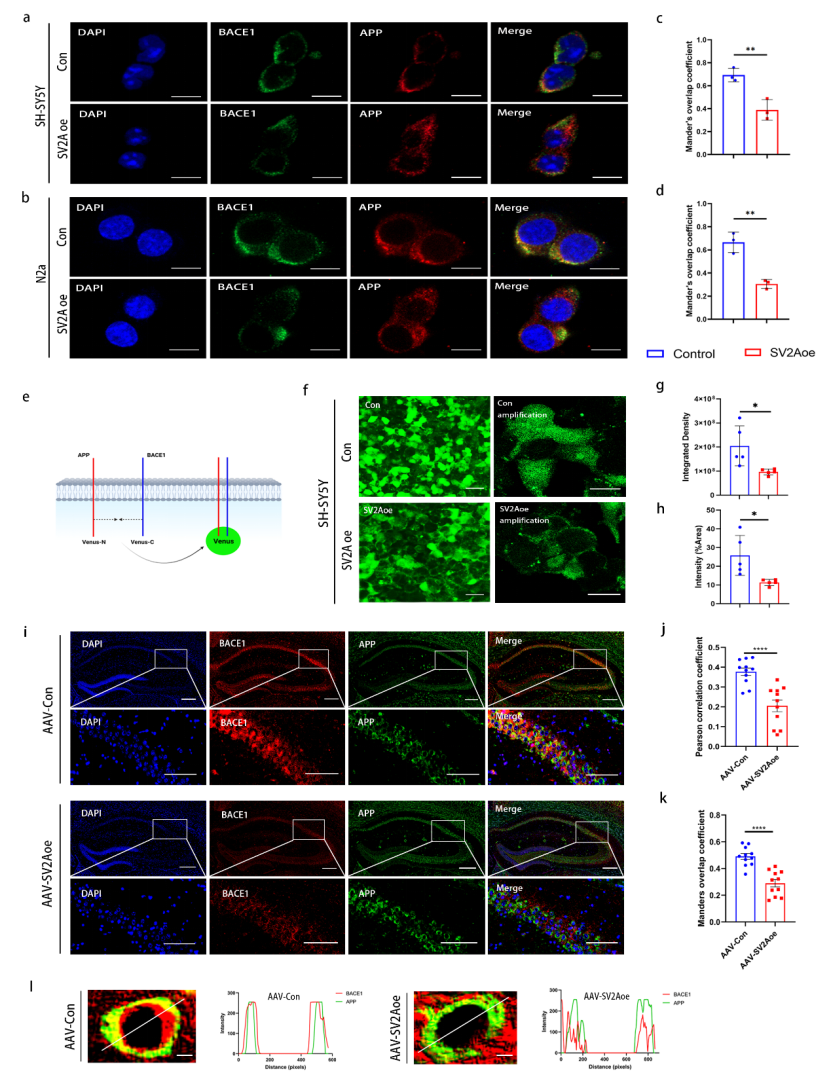
图5 SV2A过表达对BACE1与APP结合的影响
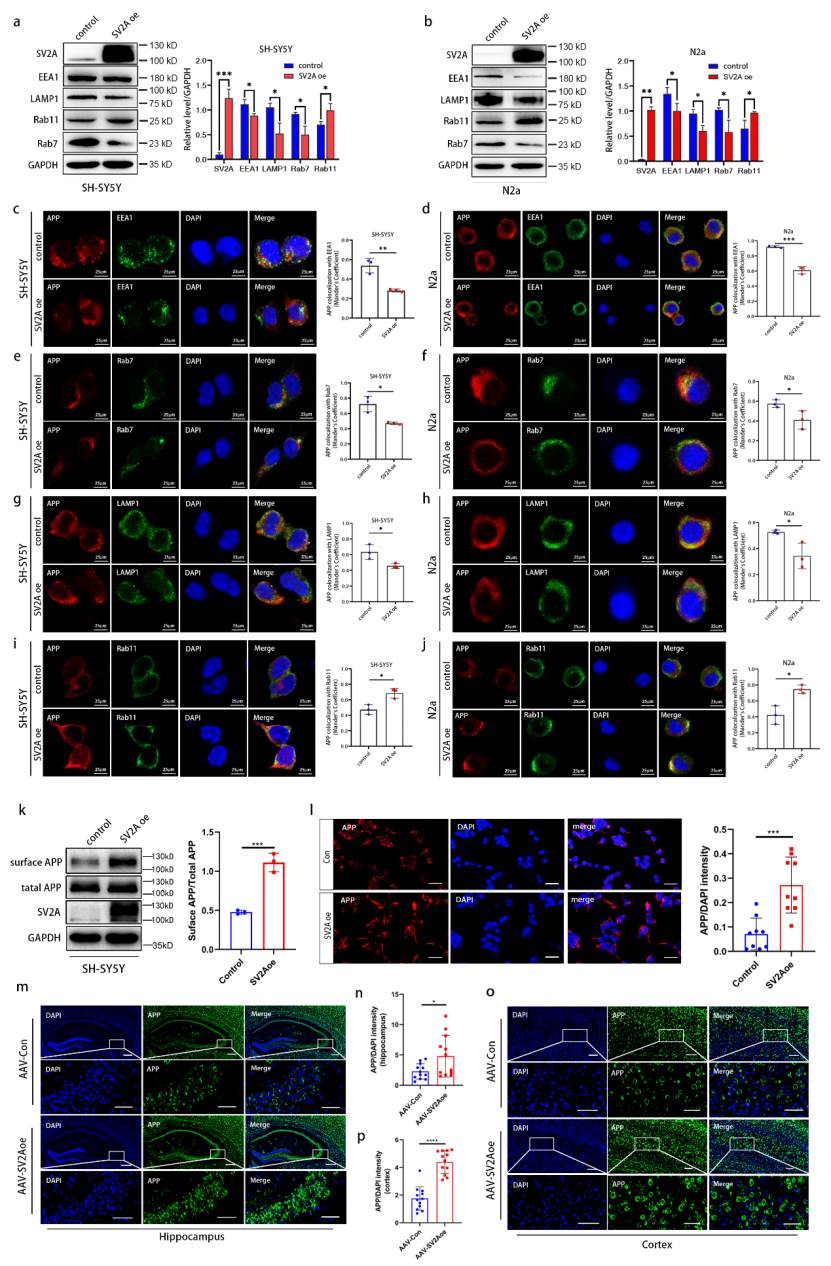
图6 SV2A过表达对APP分布的影响研究
四、研究结论及临床意义
综上所述,SV2A通过调控APP的细胞内运输及其与BACE1的互作,抑制APP的淀粉样蛋白降解途径,从而降低Aβ生成与沉积。该发现首次揭示了SV2A是APP代谢的重要调控因子,为干预AD早期病理进程提供了新的潜在治疗靶点。
来源 宣医图书馆
查看更多