查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





溶血葡萄球菌是凝固酶阴性葡萄球菌(Coagulase-negative staphylococci, CoNS)中的一类细菌,是人类皮肤的正常定植菌,也是重症监护病房患者感染的主要病原体。此外,医院内引起感染的溶血葡萄球菌较其他凝固酶阴性葡萄球菌更容易产生耐药性,许多研究显示,其它葡萄球菌可以通过溶血葡萄球菌获得耐药基因。溶血葡萄球菌可在医院存活和传播,但其存在和传播的因素尚不明确,研究显示导致医院感染的溶血葡萄球菌其基因组具有丰富的插入序列,且对多种抗生素耐药。本文将围绕溶血葡萄球菌在临床上的感染、耐药性以及毒力因子展开阐述。

1
溶血葡萄球菌相关临床感染
溶血葡萄球菌可引起血液感染、眼部感染、附睾睾丸炎、慢性前列腺炎、尿路感染等多种感染。在免疫功能低下人群中,溶血葡萄球菌感染也会导致一些并发症的发生,如败血症、脑膜炎、中耳炎。
1.1 血液感染
溶血葡萄球菌在中心导管相关性血液传播感染后会引起菌血症,并在ICU中性粒细胞减少患者和肾透析导管相关性败血症(CRS)中引起败血症。引起血液感染的溶血葡萄球菌高度耐药,一些分离菌株如耐甲氧西林溶血葡萄球菌(MRSH)可导致严重的并发症甚至死亡。
1.2 眼部感染
最初,溶血葡萄球菌并未被看作是引起角膜溃疡的病原体,直到诊断方法改进才发现CoNS是感染性角膜溃疡的重要原因,而溶血葡萄球菌是CoNS中导致眼部感染的第二大病原菌。Makki等人报道,36%的眼部感染是由溶血葡萄球菌引起的,Wong等人报道溶血葡萄球菌主要在术后引起眼内炎。而生物膜的存在和群体感应基因的表达是导致眼部感染的溶血普通球菌分离株的主要特征。
1.3 医院感染
CoNS是一种常见的皮肤共生菌,生命早期就定居在体表。出生48小时后,约100%的婴儿通过产道或接触育婴人员获得CoNS。最常见的定植菌群是表皮葡萄球菌、华氏葡萄球菌和溶血葡萄球菌。在伦敦的社区和医院高频接触物表面发现的三种最常见葡萄球菌分别是溶血葡萄球菌、表皮葡萄球菌和人型葡萄球菌。溶血葡萄球菌和表皮葡萄球菌也是在伊朗不同医院病房中检测到的最常见CoNS分离株(分别为34%和27%)。Perdreau-Remington等人报道,溶血葡萄球菌单个克隆可以在医务人员手中及不同地点和病房中广泛传播,这或许可以解释与溶血葡萄球菌相关的医院感染。
1.4 动物疾病
从家犬身上分离到耐甲氧西林溶血葡萄球菌(MRSH),先前的研究结果表明,细菌有可能从动物传播给主人和兽医人员。重要的是,感染人类和动物的分离菌株对可用的抗生素(包括β-内酰胺、大环内酯、庆大霉素和四环素)具有高度耐药性。此外,在动物食品中发现了多药耐药溶血葡萄球菌,表明这些细菌可以在食品制造场所传播抗菌药物的耐药性。
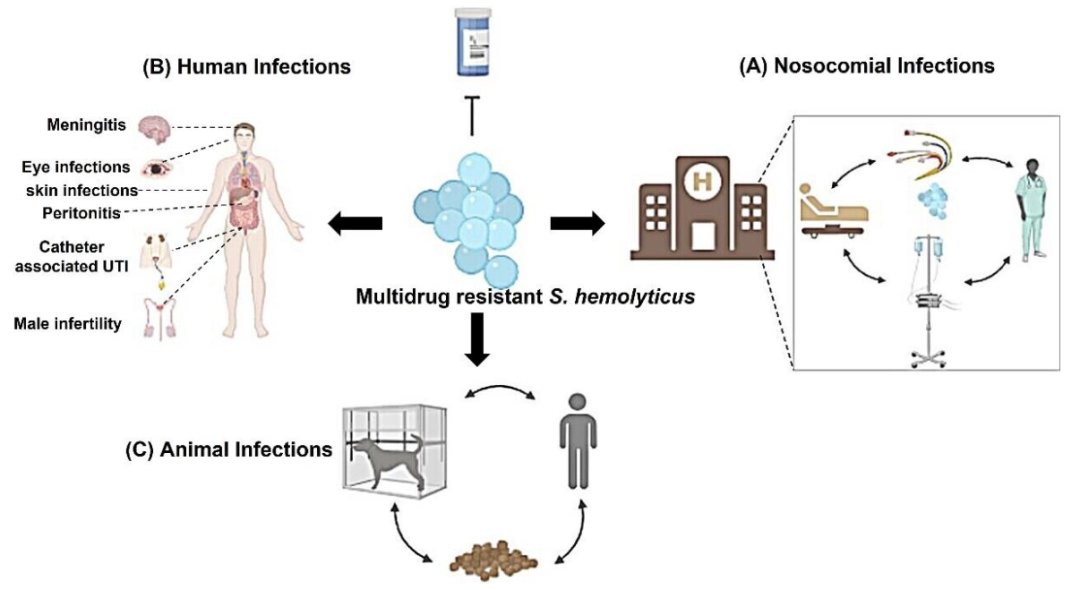
图1. 溶血葡萄球菌相关感染示意图
2
溶血葡萄球菌的耐药性
近年来,多项研究发现溶血葡萄球菌多耐药菌株的分离频率越来越高。溶血葡萄球菌对抗生素的耐药性明显高于其他CoNS,从医院环境中分离到的菌株检测到具有广泛的耐药性。溶血葡萄球菌中存在耐药基因及其在医院环境中的传播构成了潜在的风险,因为这种细菌可以储存耐药基因并将其传播给其他物种。此外,在人类临床分离的溶血葡萄球菌中还发现了外排泵机制,它与庆大霉素、红霉素、环丙沙星、氯霉素和四环素的耐药性有关。多药耐药泵由几个基因介导,如qacG、qacH和qacJ基因。有趣的是,qac基因还赋予溶血葡萄球菌对防腐剂的抗性,这些抗性基因可以在细菌之间水平转移。
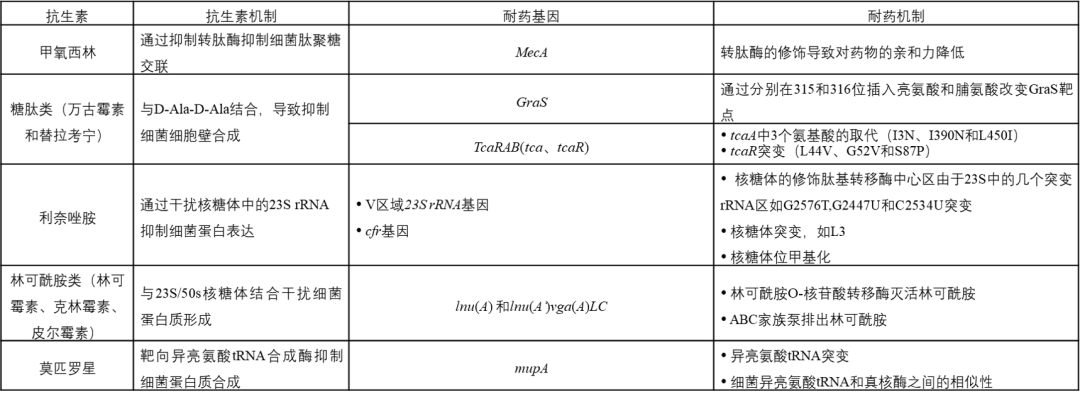
表1. 溶血葡萄球菌对常见抗生素的耐药性
3
溶血葡萄球菌的毒力因子
普通溶血葡萄球菌C10A的基因组测序表明了对多种抗生素耐药基因和毒力基因的简要检测。然而,这些毒力因子中的许多基因仍未被研究。表面物质和溶细胞素对溶血葡萄球菌的毒力有重要影响。生物膜和纤连蛋白结合蛋白(FnBP)介导细菌黏附和内化,进入宿主细胞后,溶血葡萄球菌释放毒素和酶,这些毒素和酶介导组织损伤、促炎细胞因子的激活和宿主细胞的凋亡。
3.1 生物膜形成
产生生物膜的溶血葡萄球菌会导致菌血症,尤其是与使用导管相关的感染和医院感染相关的菌血症。溶血葡萄球菌生物膜的形成是一个复杂的过程,并且在抗菌剂存在时会增加。抗生素对生物膜形成的抑制作用尚且存在争议,Pereira-Ribeiro等人报道利奈唑胺、替考拉宁、万古霉素、替加环素、利福平等抗生素不能抑制溶血葡萄球菌在非生物表面上形成生物膜;然而,Szczuka等人报道,替加环素/利福平组合(生物膜抑制浓度范围为0.062至1µg/mL)比达托霉素/利福平联合(生物膜浓度范围为0.125至2µg/mL)对溶血葡萄球菌产生的ica非依赖性生物膜更有效。生物膜的形成和耐药性的存在可能是导致持续的细菌感染和细菌在医院存活的重要原因。
3.2 溶血葡萄球菌表面蛋白用于细菌黏附
除形成生物膜外,溶血葡萄球菌还分泌纤连蛋白结合蛋白(FnBP),这些蛋白在细菌黏附到细胞外基质、细菌内化到宿主细胞和入侵中发挥重要作用。临床溶血葡萄球菌的黏附特性不同于共生溶血葡萄球菌,共生溶血葡萄球菌对纤连蛋白和胶原的粘附性很高,而临床溶血葡萄球菌对纤维结合蛋白和胶原粘附性很低。然而,使用细菌表面剃刮方法,在临床溶血葡萄球菌分离物中鉴定出65种表面蛋白,它们与人角质形成的细胞黏附有关,如细菌Toll/白介素-1样(TIR)结构域蛋白、双功能自溶素Atl、LPXTG和转糖基化酶SceD。
3.3 毒素和酶
一些溶血葡萄球菌分离株分泌肠毒素和/或溶血素。葡萄球菌肠毒素作为超抗原,激活免疫细胞产生细胞因子,导致食物中毒和其他疾病,如败血症和多器官功能障碍。溶血葡萄球菌中含有几种肠毒素基因,如sea、seb、sec、seg和sei,且从血液培养物中也可分离到一种或多种基因。奶牛乳腺炎和持续不卧床腹膜透析(CAPD)患者的发病机制也与溶血葡萄球菌含有的肠毒素基因有关。此外,从新生儿的临床样本中分离出产生肠毒素的溶血葡萄球菌。细胞毒素(也称为溶血素)是与金黄色葡萄球菌发病机制相关的毒力因子,但关于这些毒素在CoNS感染中的作用尚不清楚。与葡萄球菌感染相关的溶血素包括α-溶血素、β-溶血素和δ-溶血素。产生α-溶血素的金黄色葡萄球菌菌株表达高水平的hla基因,会对皮肤、神经元、上皮细胞、内皮细胞和免疫细胞造成损害,而缺乏hla基因的菌株毒性较小。有趣的是,90%以上的溶血葡萄球菌携带hla基因,这类分离株与糖尿病溃疡有关。此外,81%和40.5%的溶血葡萄球菌分离株中分别检测到β-溶血素和δ-溶血素,30%的分离株检测到这两种毒素。
3.4 溶血葡萄球菌感染导致宿主细胞毒性和凋亡
体外研究表明,溶血葡萄球菌感染可通过其对宿主细胞的影响来改变宿主免疫反应。Krzymi nska等人的研究表明,溶血葡萄球菌导致巨噬细胞线粒体膜电位损伤和损失。此外溶血葡萄球菌感染通过诱导caspase依赖性细胞凋亡对巨噬细胞具有细胞毒性。前期的研究结果表明,溶血葡萄球菌在宿主内持续和传播的策略之一是抑制宿主巨噬细胞。Eltwisy等人的研究表明,溶血葡萄球菌感染导致人原代皮肤成纤维细胞的损伤和凋亡,并诱导与皮肤成纤维细胞共培养的PBMC释放促炎细胞因子。先前的报告显示溶血葡萄球菌感染后通过诱导细胞凋亡对宿主细胞造成损害。
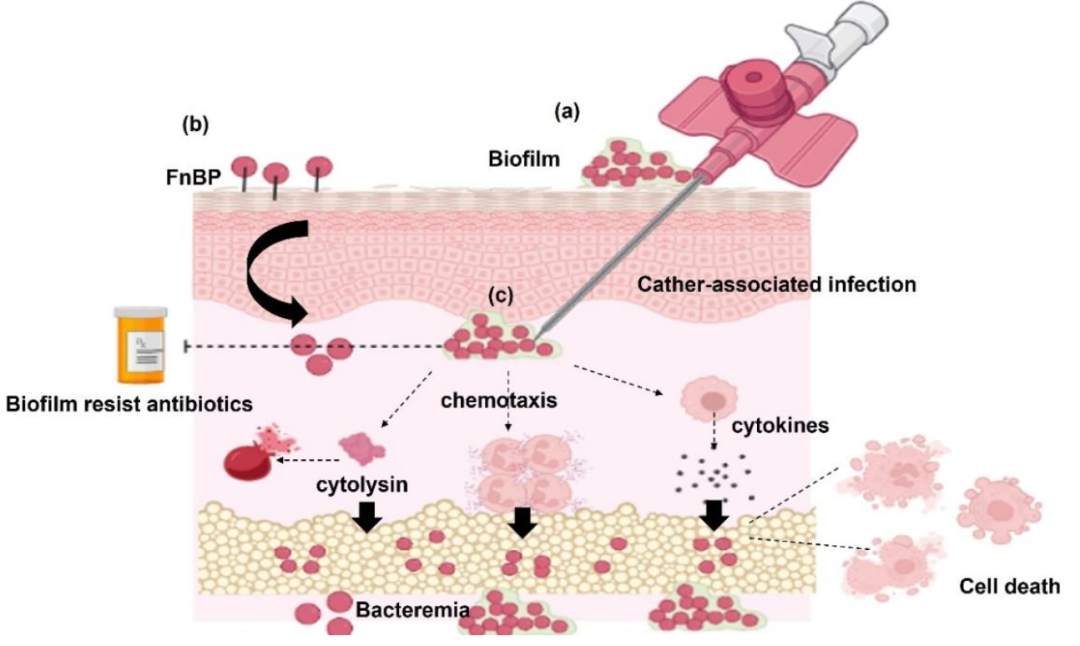
图2. 溶血葡萄球菌的致病性
小结
溶血葡萄球菌作为一种皮肤上常见的微生物群落,常被误认为是正常菌群,从而忽视了其致病性。事实上,溶血葡萄球菌也是一种重要的机会致病菌,尤其是临床分离菌株,不仅具有多重耐药性,还能产生生物膜、毒素和酶等,导致难以治疗的感染。同时,不受控制地使用抗生素加剧了耐药溶血葡萄球菌的传播。因此,在遇到溶血葡萄球菌感染人群时,要找准病原菌,合理使用抗生素,避免细菌耐药性的产生,以保证药物的临床效用。
作者:杨斓
来源:上海噬菌体与耐药研究所

更多噬菌体文章
关注上海噬菌体与耐药研究所公众号
上海市金山区漕廊公路2901号


点点分享吧
查看更多