查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





随着对非小细胞肺癌(NSCLC)分子分型研究的深入,ROS1(c-ROS 肉瘤致癌因子-受体酪氨酸激酶)基因突变逐渐受到关注。尽管ROS1融合在NSCLC中的发生率仅约1%-2%[1,2],但受我国庞大的人口基数影响,ROS1阳性NSCLC患者的临床诊疗需求不容忽视。值得关注的是,研究发现ROS1与ALK的进化路径密切相关,两者激酶结构域的氨基酸序列同源性高达70%[3]。这一分子层面的高度相似性,为ALK抑制剂跨界应用于ROS1阳性NSCLC治疗提供了坚实的理论基础。临床实践亦证实,多数ALK抑制剂对ROS1基因融合阳性的NSCLC具有明确疗效,这也进一步拓展了ROS1阳性NSCLC的治疗选择[4,5]。
近年来,随着新一代ALK/ROS1 TKI抑制剂不断涌现,为ROS1阳性NSCLC治疗带来新希望。为进一步探索ROS1阳性NSCLC患者的治疗选择,中国医学论坛报社开展“实例呈现——最佳临床病例分享项目”。特邀北京大学肿瘤医院张自然教授分享《一例ROS1阳性NSCLC患者接受一线伊鲁阿克治疗后PFS长达79个月》,并邀请北京大学肿瘤医院方健教授进行点评。现将病例及点评内容整理如下,供大家分享、交流。
该患者为ROS1阳性,确诊肺腺癌Ib期,术后2年出现肺转移;
入组伊鲁阿克I期研究扩展部分,开始接受伊鲁阿克180mg qd治疗,截至2025年5月仍在接受伊鲁阿克治疗,未出现复发进展,无进展生存期(PFS)超过6年(79.0个月);
接受伊鲁阿克治疗期间耐受性良好,仅出现轻度至中度不良反应,经相应处理后均得到有效控制。
一般资料:患者男性,初诊年龄52岁,ECOG 0分,既往体健,不吸烟。
病史与诊断过程:
(1)初诊与手术
2016年6月:体检时,胸部CT提示左肺占位
2016年8月:于外院住院治疗期间进行头颅增强MRI及全身PET/CT分期检查,未见远处转移,术前分期cT2aN0M0 Ib期
2016年8月18日,行全麻下行根治性左肺下叶切除术+区域淋巴结清扫术。术后病理提示,(肺)浸润性腺癌及浸润性黏液腺癌(浸润性腺癌腺泡状40%,乳头状20%,浸润性黏液腺癌40%),大小3.5cm*3.0cm*2.5cm,区域淋巴结未见癌转移(0/7),支气管切缘(-)。免疫组化(IHC)结果为ROS-1(3+),ALK-ventana(-)。病理分期pT2aN0M0 Ib期。
图1 会诊病理结果提示ALK Ventana IHC (-)
(2)复发与再分期:
2018年8月24日,术后定期复查中,胸部平扫CT提示右肺上叶多发结节,考虑转移。
2018年9月,完善头颅增强MRI、胸腹盆部增强CT、骨扫描、浅表淋巴结B超再分期检查,肺部CT提示,提示右肺上叶多发转移,rTxN0M1a IVa期。
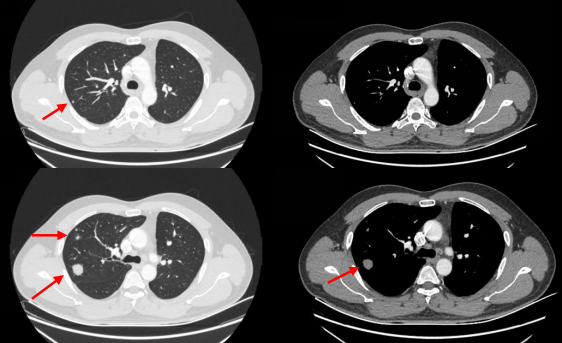
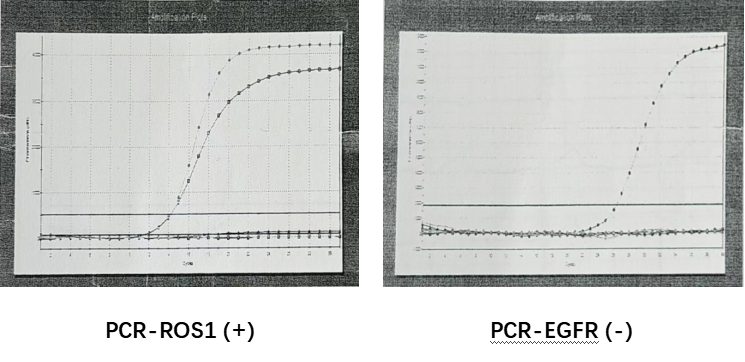
(3)基因检测:
手术组织经PCR法检测,结果显示,ROS-1融合基因(+),EGFR野生型。
入组WX0593-001研究180mg qd剂量组。
2018年10月17日单次给药,2018年10月23日开始连续给药,180mg qd至今。
疗效评估:治疗1个月后评效为疾病稳定(SD),2个月达部分缓解(PR),3个月维持PR(近完全缓解,CR)。截至2025年5月,患者仍持续服药,未出现复发进展,持续服药已79个月。
靶病灶变化:基线时靶病灶最大直径总和为19mm,服药1个月后降至17mm,2个月降至5mm,4个月及之后长期维持在2mm。
图4 伊鲁阿克治疗期间肺内病灶(靶病灶及非靶病灶均在肺内)逐渐消失
图5 伊鲁阿克治疗期间靶病灶最大直径总和
患者治疗期间耐受性良好,未见早发肺相关事件。
出现血脂升高1级(参考值:TCHO 2.84-5.68mmol/L,TG 0.56-1.70mmol/L),未特殊处理。
转氨酶升高2级(参考值:ALT 0-40 U/L,AST 0-45 U/L,经甘草酸二铵肠溶胶囊、双环醇片、多烯磷脂酰胆碱胶囊等药物保肝治疗后降至正常。
血压升高2级,应用降压药物后控制良好。
图6 血脂变化情况
图7 转氨酶变化情况
本病例为1例ROS1阳性NSCLC患者,术后2年出现右肺转移,一线接受伊鲁阿克治疗后取得显著疗效。自2018 年10月开始治疗至今,已持续79个月未发生疾病进展,治疗2个月达到PR,最佳疗效接近CR。治疗期间患者耐受性良好,仅出现轻度至中度不良反应,经相应处理后均得到有效控制。本病例充分体现了伊鲁阿克在ROS1阳性NSCLC一线治疗中的优异疗效和良好安全性。
病例分享视频
方健教授点评
从疗效深度到安全可控,伊鲁阿克为ROS1阳性NSCLC带来综合治疗优势
从临床疗效与安全性综合评估,伊鲁阿克在ROS1阳性NSCLC治疗中展现出显著优势,具体体现在以下三方面:
一是长生存获益突出。本例患者实现79个月的PFS,超越现有ROS1抑制剂——如ROS1融合NSCLC患者一线接受克唑替尼治疗的中位PFS达到23个月[6]、恩曲替尼约16个月[7],接近6.5年的持续缓解充分印证其对肿瘤的深度控制能力。这一优势源于其药物特性:作为高选择性ROS1激酶抑制剂,伊鲁阿克不仅对原发突变有强效抑制作用,对G2032R、D2033N等常见耐药突变也能保持强活性,从机制上延缓耐药发生,为长期疗效奠定基础。
二是脑转移控制更具优势。ROS1阳性NSCLC患者中,约20%在初诊时即存在脑转移,40%-50%的患者在病程中进展为脑转移[8-10]。血脑屏障穿透能力是制约治疗效果的关键挑战。伊鲁阿克通过分子结构优化,增强了跨血脑屏障的被动扩散能力,有助于提升颅内药物暴露,为脑转移患者提供了更有效的控制手段[11]。
三是安全性与耐受性良好。INNOVATION研究结果显示[12],在不可切除ALK/ROS1阳性NSCLC患者中,根治性放化疗后进行伊鲁阿克巩固治疗,中位随访12.1个月期间,包括1例ROS1阳性患者在内的8例入组者均未发生3级及以上药物相关性肺炎,无患者因肺炎需减量或停药;相关3-4级不良事件仅见1例血肌酸磷酸激酶升高和1例高胆固醇血症。这一数据表明,伊鲁阿克在安全性方面表现优异,为临床提供了耐受度高的治疗选择。
综上,伊鲁阿克在疗效深度、特殊病灶控制及安全性上的综合优势,使其成为 ROS1阳性NSCLC治疗中颇具潜力的方案。
从机制到实践,伊鲁阿克用药安全管理的临床指导价值
从不良反应机制解析、长期监测要点到临床管理的普适性,伊鲁阿克的用药安全管理体系呈现出鲜明的临床指导价值:
不良反应的发生机制与处理逻辑:伊鲁阿克的常见不良反应具有明确的生物学基础及规范的处理路径。转氨酶升高(2级)可能与药物经肝脏CYP450代谢引发的胆汁淤积或肝细胞损伤相关[13],采用甘草酸二铵、双环醇等保肝药物干预后恢复正常,且未调整伊鲁阿克剂量,这一处理符合NCCN指南对2级肝毒性的管理原则(允许在加强保肝的前提下维持原剂量)。血压升高(2级)推测与VEGF通路抑制导致的血管内皮功能异常有关——这是靶向药常见的类效应[14],通过降压药物有效控制的案例提示,常规血压监测与及时干预是关键。血脂升高(1级)可能涉及mTOR通路抑制或脂蛋白代谢酶活性降低[15],按指南建议未予干预,但需长期随访以防进展,体现了分级处理的精准性。
长期用药的监测重点与频率规划:针对药物特性制定的监测体系具有鲜明的针对性——肝功能方面,建议每3-6个月复查ALT、AST、胆红素等指标,重点排查慢性肝损伤或胆汁淤积风险;心血管系统需定期监测血压(每周1-2次)、血脂(总胆固醇、甘油三酯)及心电图,尤其需关注长期高血脂可能加剧的动脉粥样硬化与心血管事件风险;肿瘤进展评估则以胸部CT等影像学检查为核心(每2-3个月一次),结合本例患者79个月无进展的特点,监测间隔可个体化延长,但需警惕无症状进展。
管理策略的临床价值与应用边界:该病例的不良反应处理模式具有普适性参考意义——转氨酶、血压、血脂异常作为ALK/ROS1抑制剂的共性不良反应,其保肝、降压、动态观察血脂的干预方案可推广至同类药物治疗中。但需注意个体差异带来的局限性——部分患者可能出现间质性肺炎等特殊不良反应,且基线肝肾功能、心血管病史会影响监测频率的调整,临床实践中需结合患者具体情况制定个体化管理策略。
79个月超长PFS,伊鲁阿克为ROS1阳性NSCLC带来长期治疗新视角
本病例初诊为肺腺癌IB期,术后2年出现右肺多发转移,一线入组伊鲁阿克I期临床研究,自2018 年10月起接受治疗至今,无疾病进展,PFS已达79个月。治疗2个月即达到PR,最佳疗效接近CR,且耐受性良好,出现血压升高(2级)、转氨酶升高(2级)及血脂升高(1级),未发生严重不良事件,这一病例为ROS1阳性NSCLC治疗提供了高价值临床参考,同时,这一病例也带来两重重要启示:
其一,验证了超长疗程用药的安全性与可行性。患者持续服用伊鲁阿克超6.5年且耐受性良好,打破了“靶向药物因累积毒性限制疗程”的认知,为个体化停药策略的制定提供了证据支持。这提示我们,对于无严重毒性且持续获益的患者,可探索“无限期维持治疗”模式,而非拘泥于预设的固定疗程(如2年)。
其二,超长期PFS对总生存(OS)的预测意义重大。79个月的PFS通常预示着总生存期的显著延长,提示伊鲁阿克可能使部分ROS1阳性患者接近“临床治愈”。该病例也为后续研究指明方向——需建立长期随访数据库,重点分析PFS≥5年患者的OS数据,验证“长PFS转化为长OS”的临床路径,为药物提供超长期疗效证据,同时为ROS1阳性NSCLC的治疗目标设定提供新的参考维度。
方健 主任医师
北京大学肿瘤医院
北京大学肿瘤医院胸部肿瘤内二科科主任、硕士研究生导师
北京肿瘤防治研究会副会长
北京肿瘤防治研究会肺癌分委会主任委员
中国老年学学会老年肿瘤专业委员会分子靶向委员会副主任委员
中国老年学学会老年肿瘤专业委员会肺癌委员会委员
CSCO血管靶向治疗专家委员会委员
中国抗癌协会化疗专业委员会委员
中国抗癌协会老年专业委员会执行委员
国家药监局药品审评专家
北京大学肿瘤医院
医学博士,毕业于北京大学医学部
北京大学肿瘤医院胸部肿瘤内二科
2016年至今于北京大学肿瘤医院胸部肿瘤内二科从事肺癌等常见胸部肿瘤疾病临床诊疗工作,并以SUB-I身份参与多项临床研究。
参考文献
[1] Lin JJ, Shaw AT. Recent Advances in Targeting ROS1 in Lung Cancer[J]. Thorac Oncol, 2017,12(11):1611-1625.
[2] Pal P, Khan Z. ROS1 [corrected] [J]. J Clin Pathol, 2017,70(12):1001-1009.
[3] Drilon A, Jenkins C, Iyer S, et al. ROS1-dependent cancers - biology, diagnostics and therapeutics[J]. Nat Rev Clin Oncol, 2021,18(1):35-55.
[4] 张瑞锋,张奇,刘林林.ROS1阳性的非小细胞肺癌的检测及靶向治疗进展[J].现代肿瘤医学,2021,29(21):3851-3854.
[5] Stanzione B, Del Conte A, Bertoli E, et al. Therapeutical Options in ROS1-Rearranged Advanced Non Small Cell Lung Cancer[J]. Int J Mol Sci, 2023,24(14):11495.
[6] Zheng J, Cao H, Li Y, et al. Effectiveness and prognostic factors of first-line crizotinib treatment in patients with ROS1-rearranged non-small cell lung cancer: A multicenter retrospective study[J]. Lung Cancer, 2020, 147:130-136.
[7] Lu S,Fan Y,Dong X,et al. Entrectinib in Asian patients (pts) with ROS1 fusion-positive (fp) non-small cell lung cancer (NSCLC): updated efficacy and safety analysis. 2024 CSCO,P20.
[8] Rangachari D, Yamaguchi N, VanderLaan PA, et al. Brain metastases in patients with EGFR-mutated or ALK-rearranged non-small-cell lung cancers. Lung Cancer. 2015. 88(1): 108-11.
[9] Peters S, Bexelius C, Munk V, et al. The impact of brain metastasis on quality of life, resource utilization and survival in patients with non-small-cell lung cancer. Cancer Treat Rev. 2016. 45: 139-62.
[10] Stanic K, Zwitter M, Hitij NT, et al. Brain metastases in lung adenocarcinoma: impact of EGFR mutation status on incidence and survival. Radiol Oncol. 2014. 48(2): 173-83.
[11] Shi Y, Chen J, Yang R, et al. Iruplinalkib (WX-0593) Versus Crizotinib in ALK TKI-Naive Locally Advanced or Metastatic ALK-Positive NSCLC: Interim Analysis of a Randomized, Open-Label, Phase 3 Study (INSPIRE). J Thorac Oncol. 2024 Jun;19(6):912-927.
[12] 2024 ELCC 144P; 2024 ASTRO p61456.
[13] Zhou SF, Liu JP, Chowbay B. Polymorphism of human cytochrome P450 enzymes and its clinical impact. Drug Metab Rev. 2009;41(2):89-295.
[14] Ferrara N. Vascular endothelial growth factor: basic science and clinical progress. Endocr Rev. 2004 Aug;25(4):581-611
[15] Lu XY, Shi XJ, Hu A, et al. Feeding induces cholesterol biosynthesis via the mTORC1-USP20-HMGCR axis. Nature. 2020 Dec;588(7838):479-484.
审校| 方健主任医师、张自然主治医师
整理| 中国医学论坛报社 雏菊
查看更多