查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2021年2月4~6日,第30届亚太肝脏研究学会年会(APASL2021)在泰国曼谷举行。本届年会壁报展示了由新西兰和美国学者联合进行的一项乙肝抗病毒新药——ALG-000184的Ⅰ期临床研究结果。亚太肝脏研究学会前任主席廖家杰教授指出,“ALG-000184是一种衣壳组装调节剂(CAM),是慢性乙肝药物开发的新靶点,具有非常好的研发前景,虽然这仅是Ⅰ期临床研究,但结果喜人,是最有希望的一个小分子药物。”为什么一项Ⅰ期临床研究就能如此令人期待,接下来,小编将带大家“一探究竟”。

慢性乙型肝炎病毒感染给全球医疗卫生系统带来极大挑战。全世界约有3亿人感染乙型肝炎病毒(HBV),其中约90万人死于慢性乙型肝炎(CHB)并发症。为了持续抑制HBV复制并减少肝损伤,大多数患者需要用HBV核苷类似物(NA)进行终身治疗。但这种方法的功能治愈率非常低,并且患者依从性差,可能导致疾病复发危及生命以及产生药物耐药。因此,临床迫切需要有效的治疗方案能够提高功能性治愈率和改善长期临床结果(即降低肝硬化和肝癌的死亡率和发病率)。目前的治疗策略是针对HBV生命周期中的多个步骤进行联合抗病毒治疗,以达到抑制病毒复制,减少乙肝表面抗原等产生的目的。
CAM是一类经过临床验证的抗病毒化合物,可以抑制HBV RNA的衣壳包裹,减少HBV DNA和RNA。ALG-000184属于CAM类药物,为ALG-001075的前药。此前研究显示,ALG-001075在小鼠腺相关病毒-乙型肝炎模型中显示了良好的抗病毒能力。研究者在本次年会中汇报了正在进行的人类第一阶段(FIH)1a/1b期剂量范围研究的第一部分的初步结果。
该研究是一项单次递增剂量(SAD)的双盲、随机、安慰剂对照研究。每个SAD队列中有8名健康志愿者,在禁食状态下随机接受口服单剂量的ALG-000184(n=6)或安慰剂(n=2),并在最后1次给药后随访1周;每个队列至少纳入了4名亚裔作为受试对象;有2名前哨受试者随机接受ALG-000184或安慰剂(1:1比例)以评估急性不良事件,其余6名受试者(5名ALG-000184:1名安慰剂)在主要研究者(PI)审查了现有的安全性数据后,在前哨受试者用药至少24小时后随机给药。
队列1的剂量预先指定为40 mg。对于随后的队列,在研究审查委员会(SRC)召开的数据审查会议上,对所有可用的安全性、耐受性和PK数据进行审查后,确定给药剂量。队列2的受试者在禁食状态下接受单剂量100 mg的ALG-000184,然后在进食状态(高脂肪、高卡路里膳食)下接受第2剂100 mg,以评估食物对药代动力学的影响。
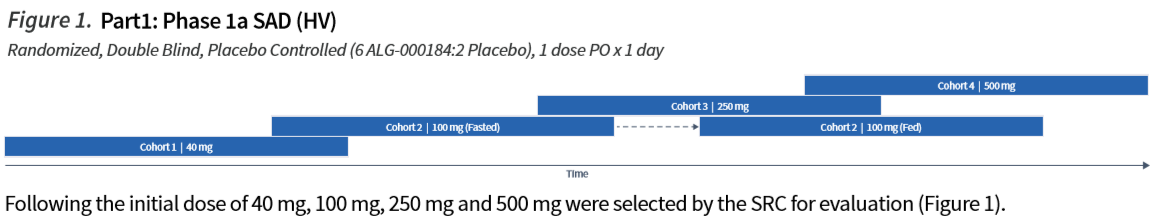
ALG-000184 研究的主要目的是评估单剂量ALG-000184在健康志愿者中的安全性和耐受性。次要目标为单剂量ALG-000184 给药后ALG-000184和ALG-001075的血浆药代动力学;单剂量ALG-000184给药后,食物对 ALG-000184 和 ALG-001075 药代动力学的影响;协变量如种族(亚裔与非亚裔)对安全性和药代动力学的影响。用药8天后进行安全性评估。
在所有剂量水平下,血浆ALG-000184浓度均较低,表明从ALG-000184到ALG-001075(活性部分)的转换迅速有效;随ALG-000184剂量的增加,ALG-001075的剂量呈线性增加;半衰期范围为6.9~8.0小时,支持QD(一日一次)给药,达峰时间(Tmax)范围在1~3.5小时;给药后120小时内,约6.3%~10.4%的ALG-000184以未改变的ALG-001075形式在尿液中排出;≥100 mg的给药剂量会导致血浆活性化合物ALG-001075浓度升高,预计会在慢乙肝患者中产生抗病毒活性。
ALG-000184单次剂量达500 mg后无严重不良事件或剂量限制性毒性;所有因治疗引起的不良事件的严重程度均较轻(1级),且无临床意义;队列1中有一名受试者出现与运动相关的3级肌酸激酶升高;无具有临床意义的体格检查、生命体征或心电图异常;与非亚裔受试者相比,亚裔受试者的ALG-000184安全性无临床意义上的差异。
研究者认为,在健康志愿者中,单次口服500 mg的ALG-000184安全、耐受性好且不受饮食影响;ALG-001075表现出理想的线性动力学关系,支持QD给药;在亚裔和非亚裔健康志愿者之间,ALG-000184/ALG-001075的安全性或药代动力学不具有临床意义的差异;这些发现支持在健康志愿者和慢性乙型肝炎患者中采用多次递增剂量给药对ALG-000184进一步评估。
(中国医学论坛报 佟艳华 编译)
查看更多