查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





导语:
2023年欧洲肿瘤内科学会(ESMO)年会已于欧洲中部夏令时间10月20日-24日在西班牙马德里顺利召开。ESMO大会交流内容涵盖了基础研究、转化研究以及最新的临床研究成果,为全世界各地的专家学者的研究数据分享、临床实践和多学科讨论提供了交流平台。此次ESMO大会备受关注的头颈肿瘤领域,不乏众多出色的放疗相关研究,为充分翔实解读研究数据,本报特邀请胡广原教授、韩亚骞教授、杨坤禹教授对其中三项研究进行分享和点评,与大家共同探讨头颈肿瘤治疗策略研究的前沿进展!
使用立体定向消融放疗(SABR)在有1-3个寡转移的头颈癌(HNSCC)患者中去一线化疗,GORTEC 2014-04“OMET”随机II期试验1
GORTEC 2014-04(摘要853O,NCT03070366)研究比较了在寡转移HNSCC接受SABR者中加或不加一线化疗的疗效,结果显示SABR联合化疗与单独SABR相比,明确健康相关生活质量恶化的1年生存率无差异,两组间OS和PFS无差异,但SABR联合化疗的毒性更大,而SABR耐受性非常好,成本最小化。
背景:大多数转移性 HNSCC有关SABR的研究都是与系统性治疗进行比较的,在少数多瘤种的SABR试验中,HNSCC的代表性不足。目前尚无研究评估单独 SABR 与化疗联合SABR 在HNSCC中的疗效。
目的:GORTEC 2014-04 (NCT03070366)是一项评估去除前期化疗而单独使用 SABR对寡转移 HNSCC 患者无生活质量评分恶化生存的影响的随机 II 期研究。主要终点:单独使用 SABR(试验组)或SABR+化疗(标准Extreme方案)(对照组)治疗寡转移 HNSCC (1-3个转移灶)患者所有转移灶的1年无明确健康相关生活质量评分恶化的总生存率。次要终点:OS、PFS、明确生活质量恶化(总体,10分)和毒性(最高级别/患者)。
方法:主要入组标准:PS 0-2(RW类似)预期寿命≥6个月;在原发部位获得局部区域控制;1-3个转移灶(通过PET确认全部转移灶位置);最大单个器官累积肿瘤直径≤6厘米。化疗:2014年的标准治疗Extreme方案(允许使用卡铂)。SABR: 任何设备,标准化分割(3或5次) 取决于转移灶位置、与危险器官的接近程度和转移灶大小。
研究设计:所有寡转移、PS≤2分患者按1:1比例随机分入化疗+SABR组或单独SABR组,分层因素包括转移部位(肺对比其他)、中心、基线QLQ-C30评分和Extreme方案或改良方案。
结果:在COVID-19流行期间和一线免疫治疗获批后出现早期终止和缓慢入组。2016-2022年11个中心,共入组了69例患者,其中单独SABR组34例,化疗+SABR组35例,男性81.2%,中位年龄62.7岁,PS 1-2分占52.3%,有合并症的占81.7%,仅肺转移82.6%,孤立转移的占58.0%,HPV+占23.2%。57例患者有完整的生活质量评分及1年无生活质量恶化生存率数据。单独使用SABR可改善身体功能和无生存恶化咳嗽评分。
在69例的ITT人群中,1年生存率:单独SABR 组63.4% (95%CI 47.6%-84.5%) ,SABR+化疗组61.7%(95%CI 46.2%-82.4%) 。中位生存未达到:单独SABR组中位随访时间55.3个月 (95%CI 42.5%-72.1%),SABR+化疗组中位随访时间45.4个月(95%CI 36.7%-69.1%)。
中位1年-PFS:SABR+化疗相比单独SABR未见显著优势。CT评估时间偏差:单独SABR组更早且更多(第一次评估是在治疗后3个月完成的)。后续复发病灶数为 58(在48例患者中),其中17个病灶(16个为野外复发,其中10个在化疗+SABR组,6个在单独SABR组;1个为野内复发)采用单独SABR治疗(17/58, 29.3%)。
任意级别毒性:单独SABR组10/34 (29.4%) ,SABR+化疗组33/35 (94.3%)。3-4级毒性:单独SABR组2/34 (5.9%) ,SABR+化疗组21/35 (60.0%) 。
结论:在接受SABR的寡转移HNSCC中去除前序化疗可降低毒性,取得相似生存和1年无生活质量恶化生存率。

胡广原教授
华中科技大学附属同济肿瘤医院
GORTEC 2014-04是首个在HNSCC寡转移人群的特异性研究,通过研究相关治疗策略,可外推于真实世界人群。由于降低治疗强度在临床诊疗中具有重要意义,因此该研究值得进一步关注。研究显示在寡转移HNSCC中单独SABR可获得较好的无生活质量恶化的生存,加入标准一线化疗仅增加毒性,不改善生存,因此单用SABR具有成本最小化优势,在当今时代具有重要意义。
该研究入组人群与Extreme研究不同2,后者人群为不适合局部治疗的复发和/或转移性HNSCC,仅能依靠系统性药物治疗来控制疾病进展。而在本研究的入组人群中,寡转移患者肿瘤负荷小,所有病灶在接受SABR治疗后,可获得良好的局部控制。该研究表明,在寡转移HNSCC患者中一线标准化疗不能在SABR基础上带来生存和控制肿瘤的获益,提示此类患者全身转移的风险较低,仅做局部治疗足够获得较好的预后。
目前RM HNSCC已经进入了免疫治疗时代,以PD-1抑制剂为基础的免疫治疗在晚期HNSCC二线及一线治疗中均成为了标准治疗。免疫治疗较化疗或靶向治疗不同的特点在于,一旦治疗有效,可激活有记忆功能的效应性T细胞,该细胞可在患者体内长期存在,在肿瘤复发转移时可重新识别并杀灭肿瘤,有长拖尾效应,进而带来长生存。多种肿瘤中,已经证实SABR有助于激活免疫,增加其治疗获益。在GORTEC 2014-04这一研究的结果基础上,对于寡转移HNSCC,SABR是否与免疫治疗有同样的协调作用,值得开展进一步的研究来明确。
放射增强剂 NBTXR3 对注射病灶的抗肿瘤活性,以估计总体生存率:对不适合顺铂的局部晚期 HNSCC 患者进行 I 期探索性分析3
2023年ESMO大会上发表了一项NBTXR3治疗不能耐受顺铂的头颈部鳞癌患者的I期剂量扩展队列的数据(887P, NCT01946867). 在这项多中心、I期剂量递增和剂量扩展研究中,总共招募了56例患者,其中绝大多数是高龄及多种合并症无法耐受顺铂的人群,对他们的原发病灶进行单次注射NBTXR3后IMRT调强放疗。研究结果显示,相对于整体人群来说,注射NBTXR3注射病灶组的中位客观反应持续时间更长,中位缓解持续时间(DoR)更高,LPFS更优。出现复发或者进展的主要在未注射NBTXR3的相关淋巴结。
背景: NBTXR3是一种无机结晶的氧化铪纳米粒子水悬液,其具有高原子序数(Z=72)和电子密度的特点,无电离辐射时为惰性状态即“关闭”状态,被电离辐射激活时则为“开启”状态,一次性瘤内给药,可持续残留在瘤内,具有针对所有实体瘤的通用作用模式。NBTXR3的抗肿瘤活性已经在局晚期软组织肉瘤的Ⅱ/Ⅲ期临床研究中被证实,其显示出NBTXR3联合RT治疗达到病理完全缓解的患者比例显著增高(2倍以上)。
目的:这项多中心、I期剂量递增和剂量扩展研究(NCT01946867)旨在探索性分析不适合顺铂的局部晚期 HNSCC 患者放射增强剂 NBTXR3 对注射病灶的抗肿瘤活性,并评估其他终点,以更好的定义NBTXR3的抗肿瘤活性,并明确NBTXR3的抗肿瘤活性是否可能作为估算总生存的有价值的指标。
患者与方法:对所有治疗人群(56人)及可评估人群(44人)做了探索性分析。对于评估肿瘤客观反应有价值的患者,需要至少接受了1次治疗后评估,并接受≥80%的NBTXR3计划剂量加上≥60 Gy的IMRT。
对56例接受瘤内注射NBTXR3 治疗的原发肿瘤患者(2019 年 4 月至 2022 年 1 月)进行了分析,随后对原发肿瘤和受累淋巴结进行了 RT 治疗。44例患者可评估客观肿瘤反应。将注射病灶和LPFS与OS的反应相关终点与总体反应和PFS的反应相关终点进行了比较。在个体患者水平评估了NBTXR3注射的反应相关终点(注射病灶的DoR,DoCR)及LPFS与OS的相关性,并与使用的传统反应终点(如所有病灶的DoR,DoCR)及PFS进行了比较。
进行了限制性平均生存时间(RMST)分析,以评估 IT 病变反应持续时间的 RMST 和 LPFS 是否能估计出在有临床意义的时间点上OS的"成功"概率。
结果:
患者基线:研究人群是合并症负担较高的老年人群:61%年龄≥70;根据年龄调整的Charison合并症指数(ACCI≥4),67%患者具有高合并症负担;80%患者为T3-T4;43%患者具有N2-N3疾病;44.6%为口腔癌;14/56(26%)为p16+口咽癌。在12名无法评估肿瘤客观缓解的患者中,由9位具有高合并症风险(ACCI≥4)。
NBTXR3 有效性:NBTR3-注射病灶:28例(63.6%)患者达到CR,8例(18.2%)患者达到PR:ORR为81.8%(n=36);注射病灶及非注射病灶:23例(52.3%)患者达到CR,12例(27.3%)患者达到PR:ORR为79.5%(n=35)。
NBTR3-注射病灶的中位客观反应持续时间要长于注射病灶及非注射病灶的中位客观反应持续时间,在所有时间点,注射病灶的限制性中位DoR均高于所有病灶的限制性中位DoR。
在可评估患者(n=44)中,中位随访时间为18.2个月,所有治疗人群(16.9个月)和可评估人群(未达到)的LPFS均优于所有治疗人群(11.4个月)和可评估人群(16.9个月)的mPFS,支持NBTXR3实现了对原发肿瘤的局部控制。
根据实体瘤疗效评价标准评估的NBTXR3注射病灶总体客观缓解率(ORR)为81.8%(n=36),完全缓解率(CR)为63.6%(n=28)。目标病变的DoR未达到,NBTXR3注射病灶组中位无进展生存期(PFS)为16.9个月,中位总生存期(OS)为23.1个月。
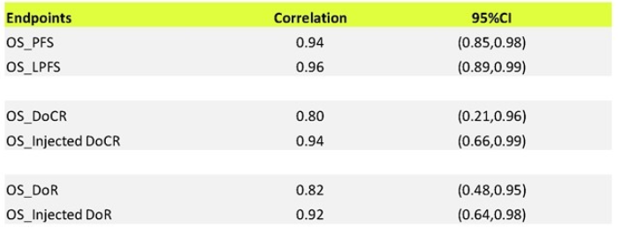
理想的早期疗效指标应该具有一个靠近特定时间点OS率(图中的黑点)的“成功”概率,PFS的“成功”概率(浅绿色)在每个时间点都一致地与OS率接近,支持了该模型的有效性。在所有治疗人群和可评估人群中,与所有病灶的治疗终点DoR相比, NBTXR3注射病灶相关反应终点(注射灶的DoR和LPFS)在24个月和36个月的时间点的成功率与OS率更接近。上述结果支持LPFS和NBTXR3注射病灶相关DoR是预估OS有价值的指标。
结论:NBTXR3增强放疗可能会延长客观反应持续时间,这一点在接受相同剂量 RT 治疗的注射病灶与未注射病灶之间的差异中已有所体现。相关性和 RMST 分析表明,NBTXR3 对注射病灶的影响可能会更好地估计 OS。

韩亚骞教授
湖南省肿瘤医院
NBTXR3 是一种氧化铪纳米粒子水悬液的放射增强剂,采用瘤内注射的方法,通过放射治疗来激活并增强放射治疗的疗效。2017年首次在肉瘤患者中使用,观察到临床有效,技术可行且毒性可控。2019年NBTXR3联合放疗在晚期软组织肉瘤的Ⅱ/Ⅲ期临床试验中达到主要终点及多个次要终点4。随后2021年开展NBTXR3联合放疗和PD-1单抗在PD-1单抗耐药小鼠肺癌模型动物实验,发现可以克服PD1耐药并触发远隔效应。2021年在老年不能耐受顺铂的头颈鳞癌患者中使用NBTXR3联合放疗的I期试验中证实这种组合方式安全有效5.2022年ASCO上介绍了Ⅲ期全球多中心的NANORAY-312[NCT04892173]研究,旨在比较经放疗激活的NBTXR3与单独放疗在不适合化疗的、高风险局部晚期头颈部鳞状细胞癌老年患者中的疗效和安全性。在该III期研究中,所有合格受试者将在随机分组前,根据研究者选择联合或不联合西妥昔单抗(研究分层因素之一),按照1:1比例随机分配至治疗组和对照组。而这次ESMO报道的研究结果显示,相对于整体人群来说,注射NBTXR3注射病灶组可使获得更长的客观反应持续时间,且中位DoR更高,LPFS更优。与此同时发现出现复发或者进展的主要在未注射NBTXR3的相关淋巴结,这一系列研究结果都充分证明了NBTXR3联合放疗的临床应用价值6。
NBTXR3联合放疗的组合带来了一种全新的治疗模式,在头颈鳞癌的研究中体现出很好的疗效和安全性,这种治疗模式也为未来联合化疗,靶向,免疫来进一步提高治疗疗效,改善治疗抗拒或者难治性头颈肿瘤治疗结局带来可能7。
HCC 15-132:一项在局部晚期头颈癌(LA HNSCC)患者中比较帕博利珠单抗同步与序贯放化疗(CRT)的随机II期研究:4年结果和肿瘤免疫微环境分析8
来自美国匹兹堡的学者们报道了一项多中心2期临床研究的结果(856MO),该研究针对接受同期放化疗的LA-HNSCC患者,研究同步或序贯免疫治疗的疗效,在更长时间(4年)随访中,序贯组治疗患者的局部区域控制率显著更高,OS和PFS在数值上持续增加。另外,该研究还在放疗开始前和放疗2周后分别获取肿瘤组织,应用多色荧光技术进行肿瘤微环境(TME)免疫全景分析,组间存在显著差异。
背景:HPV阴性或中风险HPV阳性的局部晚期HNSCC患者目前的临床预后情况不尽如人意,巨大的临床需求未得到满足。之前两项抗PD-1/PD-L1同步根治性放化疗的随机III期试验(KEYNOTE 412和JAVELIN 100)与单独放化疗相比,没有得到显著改善结局的研究结果,因此免疫治疗的最佳时机以及同步治疗疗效消除的潜在机制目前尚不明确。
目的: HCC 15-132 (NCT02777385)为在局部晚期头颈癌(LA HNSCC)患者中比较帕博利珠单抗同步与序贯放化疗(CRT)的随机II期研究,分析其随访4年的疗效数据验证同步放化疗HNSCC患者免疫治疗最佳时机,通过肿瘤微环境免疫全景分析初步探究同步治疗疗效消除的潜在机制。
方法:入组患者均为PULA HNSCC,分期III-IVb期,中等或高风险人群,病变部位包括OC,或OP,HP,喉或未知的原发性,患者ECOG评分 0-1分,随机化分组(图1)为序贯治疗组(1)与同步治疗组(2)
图1. 实验分组与治疗方案
主要复合终点:1年局部失效率<60%;1年PFS率≥60%;剂量限制性毒性率≤20%
配对患者治疗前和治疗中TME分析(图2):治疗前和放化疗第2周采集30对样本(同步组16例,序贯组14例)使用7色多光谱Vectra成像研究免疫景观,在QuPath中进行细胞分割和表型分析
图2. 配对患者治疗前和治疗中TME分析示例图
结果:
共入组患者80例,同步组(N=41)中位年龄64.7岁,序贯组(N=39)中位年龄63.1岁,原发病灶包括下咽部、喉、口咽,其中HPV阳性OPC同步组20例,序贯组22例,PD-L1 CPS中位数两组均为15.
在中位随访时间43个月时,序贯组治疗患者的局部区域控制率显著更高(95%vs.64%,HR=0.12,P=0.04);两组OS分别为67%和49%(HR=0.57,P=0.17),PFS为83%和71%(HR=0.51,P=0.18),序贯组显示出持续改善,但未达到统计学差异。
同步治疗患者的总PD-L1表达增加(图3.1),序贯治疗组无明显变化,PD-L1+ CD3- pan-CK- 细胞频率随治疗显著增加(图3.2),同步治疗组中,治疗后CD8 T浸润、Tregs 或 CD8 T与Treg 的比率均未发现变化。在序贯组中,远离肿瘤边缘的间质中CD8 T(图3.3)和Treg细胞显著减少(图3.4)。
图3.1 同步治疗患者的总PD-L1表达增加
图3.2 CD3-Pan-CK-细胞上的PD-L1表达
图3.3 CD8 T细胞密度
图3.4 序贯治疗组基质中Treg细胞密度降低
结论:在长期随访中,序贯组治疗患者的局部区域控制率显著更高,治疗前和治疗时配对样本的肿瘤免疫微环境分析显示,组间存在显著差异:同步治疗组中PD-L1表达细胞显著增加,在序贯组中CD8 T细胞和Treg细胞显著减少,进一步的相关分析正在进行中。

杨坤禹教授
华中科技大学协和医院
Checkmate 141 研究和Keynote 048研究先后明确了免疫检查点抑制剂PD-1单抗在二线和一线复发/转移性头颈鳞癌治疗中的重要作用9-10。然而,在接受同期放化疗的局部晚期头颈鳞癌(LA-HNSCC)患者中,PD-1/PD-L1单抗的作用仍不明确。两项大型三期前瞻性随机研究JAVELIN-100和Keynote 412的研究结果表明,在同期放化疗基础上,进一步同步联合PD-L1或PD-1单抗并不能够改善生存11-12。改变免疫治疗与同期放化疗联合的时间顺序,是否能够改善患者生存,一直是业界争论的焦点话题。
HCC 15-132的研究者报道了同期放化疗同步帕博利珠单抗组(同步组)和同期放化疗后序贯帕博利珠单抗(序贯组)两组的4年肿瘤控制率和生存数据,同步组vs序贯组4年肿瘤局部区域控制率64% vs 96%,无进展生存率 49% vs 67%,总生存率 71% vs 83%。无论肿瘤局部区域控制还是远期生存数据,序贯组均显著优于同步组。该研究临床结果与JAVELIN-100和Keynote 412的结果一致:接受同期放化疗的LA-HNSCC患者,同步免疫治疗不是最优的给药模式。研究者还报道了TME免疫全景分析的结果,发现放疗2周后两组免疫微环境显著不同,同步组肿瘤和周围间质中PD-L1+细胞密度显著增加;而序贯治疗组周围间质中CD8+细胞和Treg细胞数量显著下降。表明放疗前开始的同步免疫治疗确实显著改变了肿瘤免疫TME,但是,这种肿瘤免疫TME的改变是在免疫治疗仅仅一周期后出现的,随着免疫治疗周期数和放疗次数的增加,免疫TME是否会发生进一步改变,是否最终导致肿瘤控制率和生存率的差异仍有待于研究者最终相关性分析的结果。
结语:
随着各类全身治疗手段的综合应用不断进步,头颈肿瘤的治疗现已进入了精准医疗的新时代。放射治疗始终是头颈肿瘤治疗的一项重要策略,包括本次ESMO大会在内的肿瘤领域学术盛会上围绕放疗开展的相关综合治疗策略研究结果不断出炉,希望未来研究能够继续聚焦患者未被满足的临床需求,提供更加个性化的治疗新选择,有助于延长患者生存期、获得更好预后!
胡广原 教授
华中科技大学附属同济肿瘤医院党支部书记,副主任,博士生导师
华中科技大学附属同济医院头颈肿瘤科科主任
中华医学会放射治疗专委会鼻咽癌学组常委
CSCO鼻咽癌专业委员会常委
CSCO头颈肿瘤专业委员会常委
中国医师协会脑胶质瘤专业委员会放疗学组副组长
中国医师协会放射治疗专委会鼻咽癌学组委员
中国抗癌协会脑胶质瘤专业委员会委员
中国医师协会放射外科专委会常务委员
中国医药教育协会肿瘤疑难诊断与治疗学专委会常务委员
中南六省胶质瘤联盟常务委员
湖北省神经科学学会胶质瘤专委会主任委员
湖北省抗癌协会鼻咽癌专业委员会常务委员
湖北省抗癌协会肿瘤营养与代谢专委会副主任委员
湖北省抗癌协会理事
湖北省抗癌协会肺癌专业委员会委员
武汉市医学会放射肿瘤专业委员会常务委员
韩亚骞 教授
湖南省肿瘤医院头颈放疗科 科主任
中国抗癌协会鼻咽癌专委会 常务委员
CSCO头颈肿瘤专家委员会 委员
CSCO鼻咽癌专家委员会 委员
国家癌症中心鼻咽癌质控专委会 委员
国家癌症中心喉癌质控专委会 委员
中华医学会放射肿瘤学鼻咽癌学组 委员
中华医学会放射肿瘤学头颈肿瘤学组 委员
湖南省抗癌协会鼻咽癌专委会 主任委员
湖南省肿瘤医院头颈肿瘤诊疗策略MDT组长
湖南省鼻咽癌精准治疗临床医学研究中心 主任
杨坤禹教授
主任医师,博士生导师
华中科技大学协和医院肿瘤科主任/教研室主任
中国临床肿瘤学会(CSCO)头颈肿瘤专委会,副主委
中国临床肿瘤学会(CSCO)鼻咽癌专委会,副主委
中国临床肿瘤学会(CSCO)放疗专委会,常委
中华放射肿瘤学会头颈肿瘤学组,副组长
中华医学会生物学组,副组长
湖北省抗癌协会,副理事长
湖北省医师协会放射肿瘤治疗医师分会,主任委员
“十三五”规划教材《Oncology》、
“十四五”规划教材《肿瘤放射治疗学》副主编
参考文献:
[1].J. Thariat et,al.OMITting frontline chemotherapy in head and neck cancer (HNSCC) patients with 1-3 oligometastases using stereotactic ablative radiotherapy (SABR), the GORTEC 2014-04 “OMET” randomized phase II trial. Annals of Oncology (2023) 34 (suppl_2): S554-S593. 10.1016/annonc/annonc1326
[2].Vermorken, Jan B., et al. "Platinum-based chemotherapy plus cetuximab in head and neck cancer." New England Journal of Medicine 359.11 (2008): 1116-1127.
[3].C. Le Tourneau, et al. Antitumor activity of the radioenhancer NBTXR3 on injected lesions to estimate overall survival: Exploratory analyses from a phase I in cisplatin-ineligible locally advanced HNSCC patients. Annals of Oncology (2023) 34 (suppl_2): S554-S593. 10.1016/annonc/annonc1326
[4].Bonvalot S, Le Pechoux C, De Baere T, et al. First-in-Human Study Testing a New Radioenhancer Using Nanoparticles (NBTXR3) Activated by Radiation Therapy in Patients with Locally Advanced Soft Tissue Sarcomas. Clin Cancer Res. 2017;23(4):908-917.
[5].Hoffmann C, Calugaru V, Borcoman E, et al. Phase I dose-escalation study of NBTXR3 activated by intensity-modulated radiation therapy in elderly patients with locally advanced squamous cell carcinoma of the oral cavity or oropharynx. Eur J Cancer. 2021;146:135-144.
[6].Bonvalot S, Rutkowski PL, Thariat J, et al. NBTXR3, a first-in-class radioenhancer hafnium oxide nanoparticle, plus radiotherapy versus radiotherapy alone in patients with locally advanced soft-tissue sarcoma (Act.In.Sarc): a multicentre, phase 2-3, randomised, controlled trial [published correction appears in Lancet Oncol. 2019 Sep;20(9):e468]. Lancet Oncol. 2019;20(8):1148-1159.
[7].Hu Y, Paris S, Barsoumian H, et al. Radiation Therapy Enhanced by NBTXR3 Nanoparticles Overcomes Anti-PD1 Resistance and Evokes Abscopal Effects. Int J Radiat Oncol Biol Phys. 2021;111(3):647-657.
[8].D.P. Zandberg et al. A randomized phase II study of concurrent vs. sequential pembrolizumab with chemoradiation (CRT) in locally advanced head and neck cancer (LA HNSCC): 4-year results and tumor-immune microenvironment analysis. Annals of Oncology (2023) 34 (suppl_2): S554-S593. 10.1016/annonc/annonc1326.
[9].Ferris RL, Blumenschein G Jr, Fayette J, et al. Nivolumab for recurrent squamous-cell carcinoma of the head and neck[J]. N Engl J Med, 2016, 375(19): 1856-1867. DOI: 10.1056/NEJMoa1602252.
[10].Burtness B, Harrington KJ, Greil R, et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): a randomised, open-label, phase 3 study[J]. Lancet, 2019, 394(10212): 1915-1928. DOI: 10.1016/S0140-6736(19)32591-7.
[11].Lee NY, Ferris RL, Psyrri A, et al. Avelumab plus standard-of-care chemoradiotherapy versus chemoradiotherapy alone in patients with locally advanced squamous cell carcinoma of the head and neck: a randomised, double-blind, placebo-controlled, multicentre, phase 3 trial[J]. Lancet Oncol, 2021, 22(4): 450-462. DOI: 10.1016/S1470-2045(20)30737-3.
[12].Machiels, J. P., et al. "LBA5 primary results of the phase III KEYNOTE-412 study: pembrolizumab (pembro) with chemoradiation therapy (CRT) vs placebo plus CRT for locally advanced (LA) head and neck squamous cell carcinoma (HNSCC)." Annals of Oncology 33 (2022): S1399.
声明:
本资讯由默沙东医学团队编辑提供,旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
审批号:MI-PD1-5184-CN
Expiration Date: 2024-10
查看更多