查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





三阴性乳腺癌的雌激素受体、孕激素受体、人类表皮生长因子受体HER2均为阴性,故对内分泌治疗和HER2靶向治疗无效,目前主要依靠手术和放化疗。
近年来,免疫细胞程序性死亡受体PD-1及其配体PD-L1等免疫检查点(肿瘤细胞逃避人体免疫细胞追杀的关键)抑制剂虽然对其他癌症已经获得极大成功,但是仅对不到五分之一的三阴性乳腺癌患者有效。
2021年9月27日,全球自然科学三大旗舰期刊之一、美国《细胞》(CELL)正刊发表哈佛大学医学院达纳法伯癌症研究所、哈佛大学陈曾熙公共卫生学院的研究报告,发现了三阴性乳腺癌免疫治疗瓶颈的关键靶点。
该研究首先利用基因编辑技术建立了超过4500个基因的基因剔除筛选库,随后,将其转染小鼠三阴性乳癌4T1细胞,注入免疫功能缺陷小鼠和免疫功能正常小鼠的乳腺脂肪垫内形成肿瘤,16天后收集小鼠三阴性乳腺癌组织,对超过4500个基因进行大规模并行测序筛选。
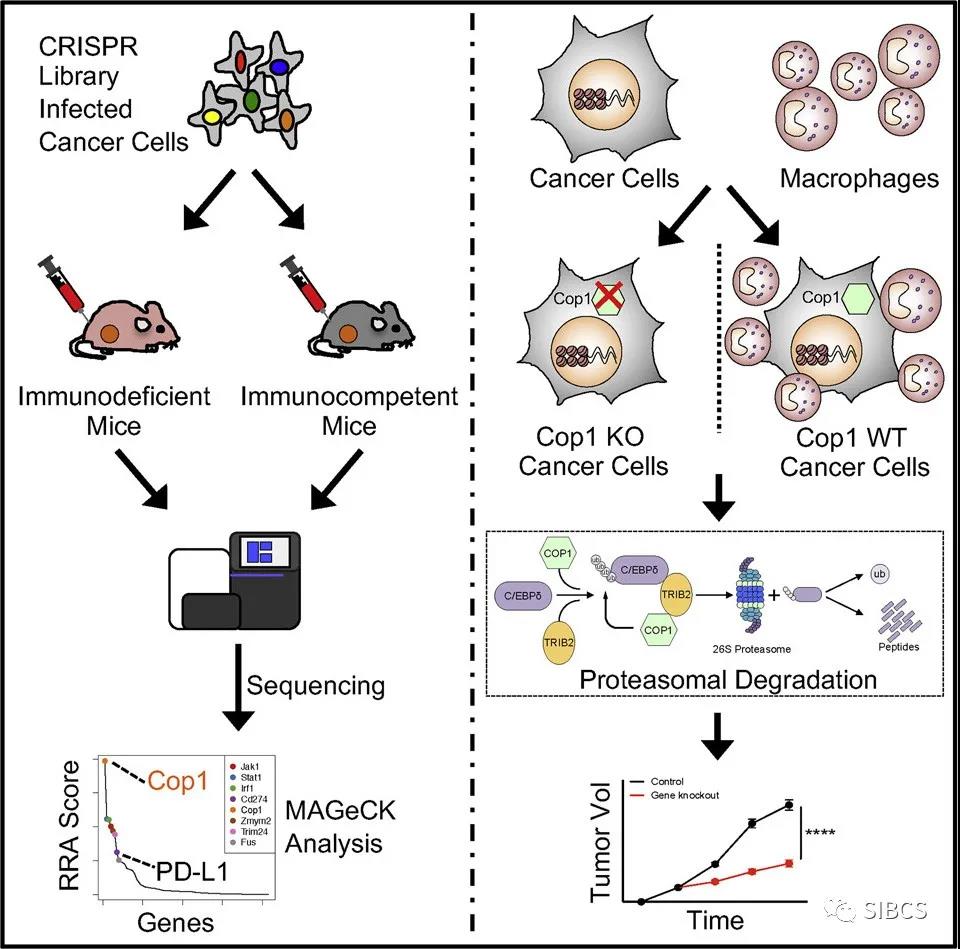
结果发现,肿瘤细胞的泛素连接酶COP1编码基因被剔除以后,可减少巨噬细胞相关趋化因子分泌和肿瘤巨噬细胞浸润、防止抗肿瘤免疫细胞被肿瘤巨噬细胞吞噬、增强抗肿瘤免疫和免疫检查点PD-1或PD-L1抑制剂疗效、显著缩小肿瘤体积并延长小鼠生存时间。
转录组学、表观基因组学和蛋白质组学分析表明,COP1主要通过蛋白酶体降解趋化因子转录蛋白C/EBPδ而发挥作用,COP1底物TRIB2可充当连接COP1和C/EBPδ的支架,导致C/EBPδ多聚泛素化而被蛋白酶体降解。此外,利用泛素连接酶抑制剂MLN4924或蛋白酶体抑制剂MG132可防止C/EBPδ泛素化或降解,从而抑制巨噬细胞趋化基因表达,防止肿瘤细胞逃避人体免疫细胞追杀。
因此,该研究结果表明COP1可调节肿瘤免疫微环境趋化因子分泌和巨噬细胞浸润,为突破三阴性乳腺癌免疫治疗瓶颈奠定了基础。
SIBCS 平台发布
查看更多