查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





导语:替奈普酶在AIS中的应用建议发生了变化,这与越来越多的TNK相关临床研究结果有关。


卒中已跃居为我国居民死亡和成人致残的首位病因,其中缺血性卒中约占所有卒中的80%。急性缺血性卒中(AIS)治疗的关键在于尽早开始再灌注治疗,挽救缺血半暗带,其中静脉溶栓是恢复血流灌注的主要手段[1]。
替奈普酶(tenecteplase, TNK)是一种新型溶栓药物,近年来成为国际上AIS静脉溶栓研究的热点药物。2023年2月,欧洲卒中组织(ESO)正式发布了《替奈普酶治疗急性缺血性卒中的快速建议》[2],指南背后主要是基于哪些循证医学证据呢?让我们来一睹为快吧!
表1 TNK治疗AIS相关临床研究信息汇总
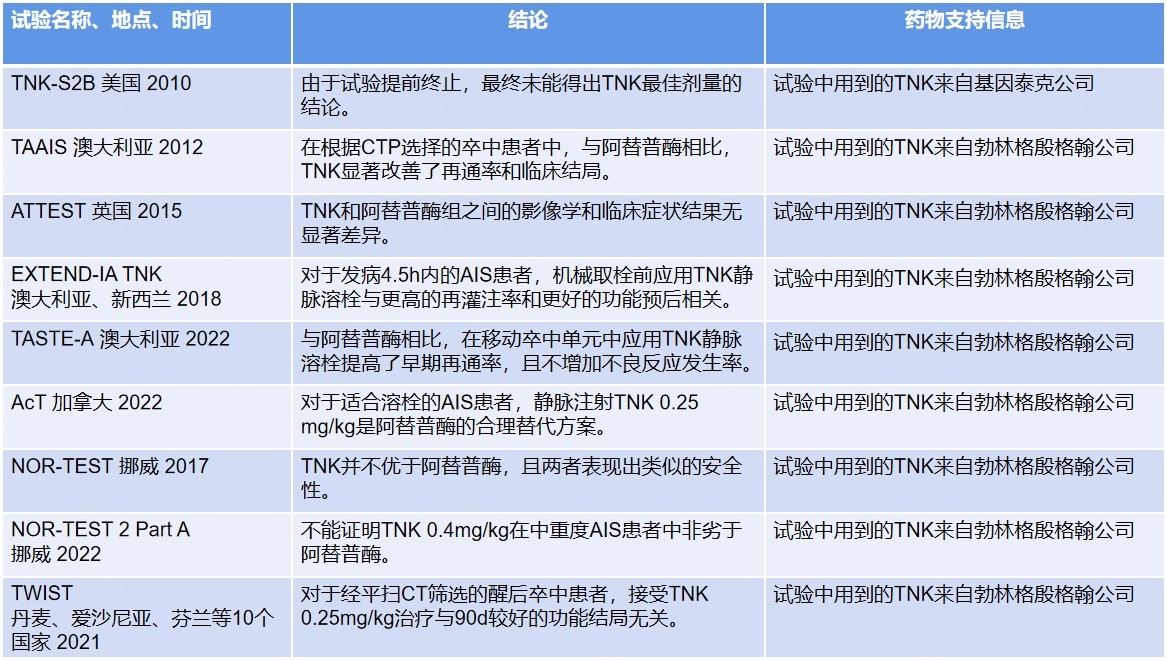

在TNK-S2B这项2b/3期随机双盲试验中[3],纳入112例发病3h内的卒中患者,随机分配至TNK 0.1mg/kg、0.25mg/kg、0.4mg/kg或阿替普酶0.9mg/kg组,旨在确定TNK的最佳剂量,并评估该最佳剂量在改善90d功能结局上是否优于标准剂量阿替普酶,由于入组非常缓慢,试验被提前终止。试验终止时,TNK 0.25mg/kg组和0.1mg/kg组在90d功能结局上与阿替普酶组无显著差异,TNK 0.4mg/kg组症状性颅内出血(sICH)率过高(15.8%)。最终该研究没有给出TNK最佳剂量的结论。
![]()
图1 TNK-S2B研究:主要疗效及安全性终点结果
试验二:
TAAIS是一项2b期前瞻性、随机、开放标签、盲法终点(PROBE)试验[4],75名发病6h内的经CTA证实有血管堵塞的AIS患者被随机分至TNK 0.10mg/kg、0.25mg/kg或阿替普酶 0.9mg/kg组,主要终点为24h后成功再灌注率和神经功能改善。结果显示TNK组患者主要终点指标均优于阿替普酶组,TNK 0.25mg/kg组所有疗效性指标均优于TNK 0.10mg/kg组和阿替普酶组,包括90d良好功能结局(mRS 0-1)的患者比例。三组之间严重不良事件发生率无显著差异。
图2 TAAIS研究:24h成功再通率及NIHSS评分变化
ATTEST是一项2期PROBE试验[5],比较了0.25 mg/kg TNK和标准剂量阿替普酶的疗效。104名发病4.5h内的幕上缺血性卒中患者随机分配至TNK 0.25mg/kg或阿替普酶0.9 mg/kg组,纳入患者均未进行机械取栓。主要终点为挽救的缺血半暗带百分比,定义为基线CTP上的半暗带体积减去24~48h后CT平扫所示梗死体积。结果显示,两组之间在影像学和临床结局中的疗效性和安全性指标上均无显著差异。
图3 ATTEST研究:缺血半暗带、梗死核心及最终梗死体积对比
图注:蓝色表示基线半暗带体积,红色表示基线梗死核心体积,绿色表示24-48h后最终梗死体积
EXTEND-IA TNK同样是一项2期PROBE试验[6],纳入202例发病4.5h内、符合机械取栓条件的AIS患者,随机分配至TNK 0.25 mg/kg或阿替普酶 0.9mg/kg组。主要终点是术后初次血管造影示缺血区域再灌注体积>50%或无可取血栓。结果显示,在接受桥接治疗的LVO患者中,0.25 mg/kg TNK可能与更高的再通率(22% vs 10%;P=0.002)以及更低的90d mRS评分(p=0.04)相关。
图4 EXTEND-IA TNK研究:90d mRS评分分布情况
TRACE是一项于国内开展的2期PROBE试验[7],将236例AIS患者随机分配至TNK 0.10、0.25、0.32mg/kg或阿替普酶0.9mg/kg组,主要终点是14天NIHSS评分的改善,安全终点是36h sICH发生率。结果显示,TNK 3个剂量组和对照组在发病14d NIHSS的改善上无差异(63.3%,77.2%,66.7% vs 62.7%)。sICH发生率分别为5.0%、0、3.3%和1.7%。严重不良事件在两组间无显著差异。
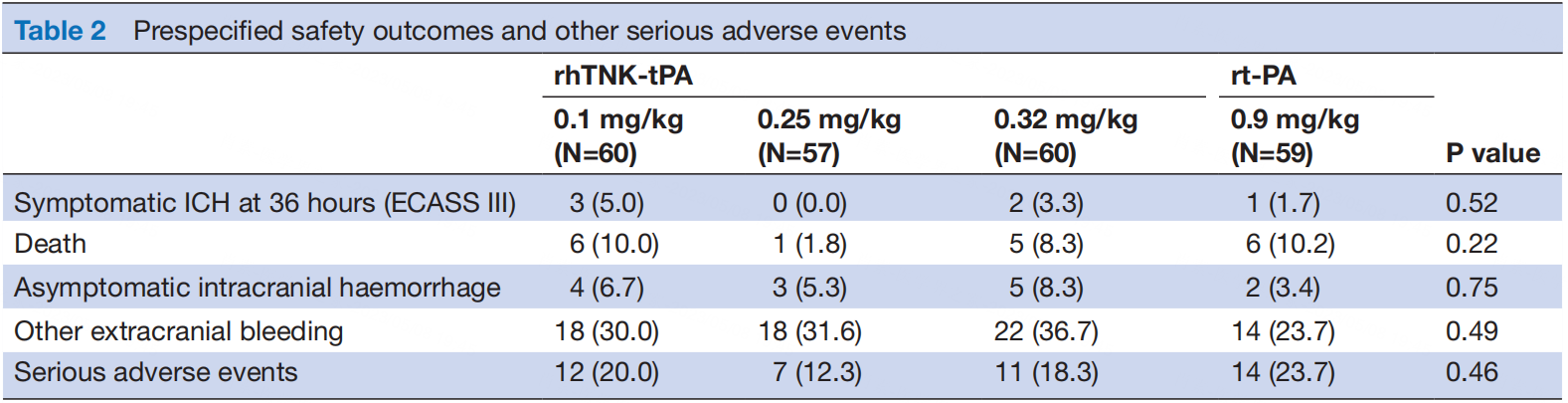
图5 TRACE研究:安全结局及其他严重不良事件发生率
TASTE-A是一项2期PROBE试验[8],为在移动卒中单元中使用TNK溶栓提供了循证依据,纳入104名发病4.5h内的AIS患者,随机分配至TNK 0.25 mg/kg或阿替普酶 0.9mg/kg组。主要终点是到院时经CTP评估的低灌注区体积。结果显示,TNK组患者到院时低灌注区体积中位数明显低于阿替普酶组(12ml vs 28ml,调整的发病率比值 0.55 ,95%CI 0.37–0.81;p=0.003),且不增加不良反应发生率,但两组在90d功能结局上无显著差异。
图6 TASTE-A研究:到院时低灌注区体积对比
AcT是一项3期非劣效性PROBE研究[9],纳入了来自加拿大22个卒中中心的共1600名发病4.5h内的AIS患者,旨在确定0.25 mg/kg TNK相较于0.9 mg/kg阿替普酶的非劣效性。主要终点为90d 良好功能结局(mRS 0-1)的患者比例。结果显示,在主要终点上TNK非劣于阿替普酶(36.9% vs 34.8%,未经调整的风险差异2.1%,95% CI -2.6~6.9,满足预先指定的非劣效性界值-5%)。但在二次分析中TNK并不优于阿替普酶,所有亚组中均未观察到两组之间治疗效果的异质性,两组间sICH及90d死亡率无显著差异。最终认为对于适合溶栓的AIS患者,静脉注射TNK 0.25 mg/kg是阿替普酶的合理替代方案。
图7 AcT研究:预先指定的亚组中主要终点风险差异森林图
NOR-TEST研究旨在评估0.4 mg/kg TNK与0.9 mg/kg阿替普酶治疗AIS的安全性和有效性[10],纳入了1100例在发病4.5h内、或醒后出现症状后4.5h内入院、或有条件接受桥接治疗的AIS患者。主要终点为90d良好功能结局(mRS 0-1)的患者比例。最终认为TNK并不优于阿替普酶(64% vs 63%,OR 1.08, 95% CI 0.84~1.38;p=0.52),二者具有相似的安全性,但该试验中大多数患者为轻型卒中。
图8 NOR-TEST研究:90d mRS评分分布情况
NOR-TEST 2 Part A研究是一项3期PROBE研究[11],旨在评估0.4mg/kg TNK相比0.9mg/kg阿替普酶的非劣效性,纳入216名发病4.5h内的中重度AIS患者(NIHSS≥6分),出于安全原因该试验提前终止,主要终点为90d良好功能结局(mRS 0-1)的患者比例。结果显示,TNK 0.4mg/kg组中90d良好功能结局(mRS 0-1)的患者比例更低(32% vs 51%,OR 0.45,95% CI 0.25~0.80;p=0.0064),并有增加sICH和死亡率的趋势。最后认为不能证明TNK 0.4mg/kg在中重度AIS患者中非劣于阿替普酶。
图9 NOR-TEST 2 Part A研究:90d mRS评分分布情况
本条建议还基于在1.1中已经提及的TNK-S2B研究,专家组成员对这3项研究进行了荟萃分析,结果未能证明0.4mg/kg TNK在90d良好功能结局(mRS 0-1)上非劣于0.9mg/kg阿替普酶,并有增加sICH的趋势,因此不建议对发病4.5h内的AIS患者使用0.4mg/kg TNK溶栓[2]。
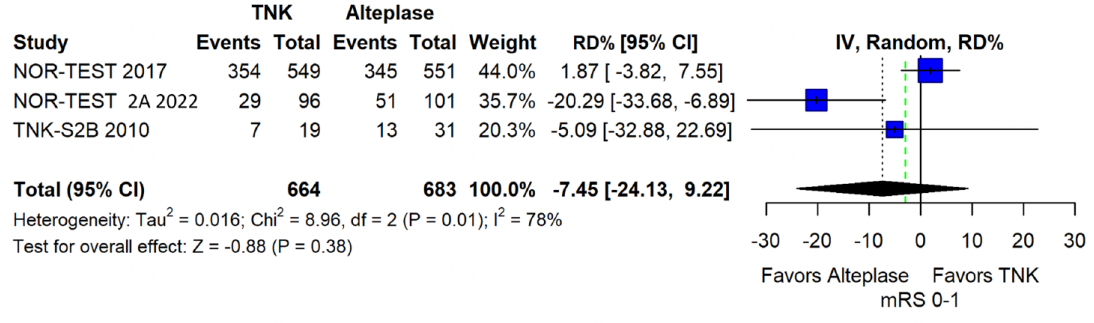
图10 TNK 0.4mg/kg vs 阿替普酶0.9mg/kg 90d良好功能结局的合并风险差异
图注:绿色虚线表示预先设定的非劣效性界值为-3%
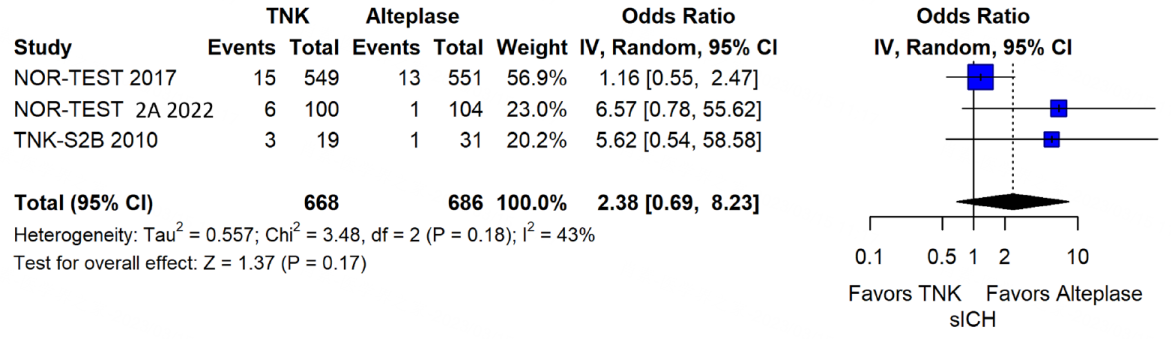
图11 TNK 0.4mg/kg vs 阿替普酶0.9mg/kg sICH发生率
这条建议基于1.1中提及的TASTE-A研究。在该研究中,尽管TNK治疗组的患者早期再通率更高,但两组在24h NIHSS评分、90d功能结局和90d死亡结局等指标上没有观察到显著差异,因此本条建议推荐强度较弱。
图12 TASTE-A研究:90d mRS评分分布情况

这条建议基于上文已经提及的TAAIS、ATTEST、EXTEND-IA TNK、AcT这4项研究,荟萃分析表明,与 0.9mg/kg 阿替普酶相比,0.25mg/kg TNK 在90d良好功能结局(mRS 0-2)上具备非劣效性与优效性,而两组之间在早期神经功能改善、早期再通率(无论有无机械取栓)、门到针时间、sICH、任何脑实质血肿、全因死亡率等指标上无显著差异[2]。
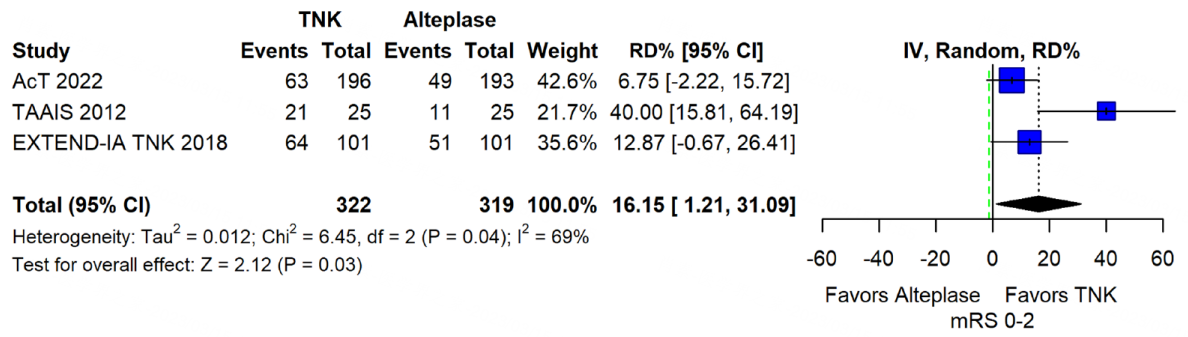
图13 TNK 0.25mg/kg vs 阿替普酶0.9mg/kg 90d良好功能结局(mRS 0-2)的合并风险差异
图注:绿色虚线表示预先设定的非劣效性界值为-1.3%
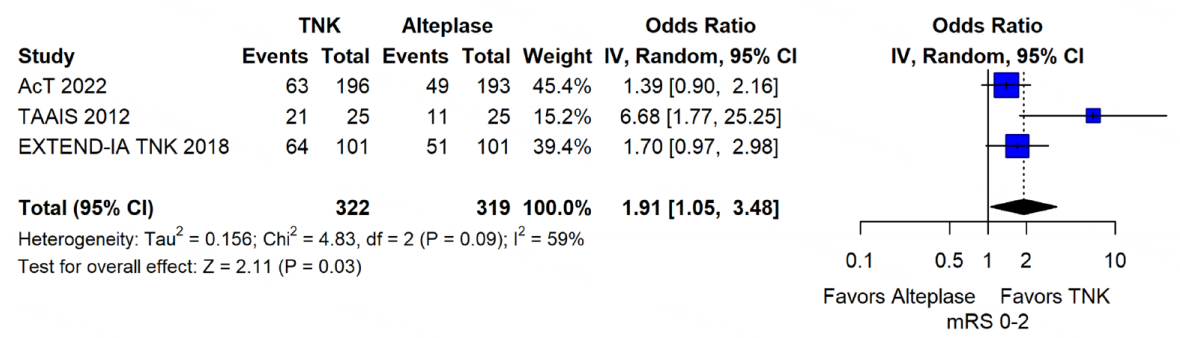
图14 TNK 0.25mg/kg vs 阿替普酶0.9mg/kg 90d良好功能结局(mRS 0-2)未调整的合并优势比

TWIST研究是一项3期PROBE试验[12],旨在探讨经平扫CT筛选的醒后卒中患者使用TNK 0.25mg/kg溶栓的疗效与安全性。该研究共纳入578名能在4.5h内接受溶栓的醒后卒中患者,主要结局为患者90d mRS 评分分布情况。结果显示,接受TNK治疗与90d较好功能结局(mRS至少减少1分)无关(校正OR 1.18,95%CI 0.88~1.58;p=0.27),两组在sICH、90d死亡率等安全性指标方面无显著差异。最终认为目前并不建议使用TNK 0.25mg/kg治疗经平扫CT筛选的醒后卒中患者。
图15 TWIST研究:90d mRS评分分布情况
此条建议目前尚无RCT可提供证据支持。

TNK便捷的给药方式及优越的药理学特性,使其成为目前极具前景的AIS静脉溶栓药物。此前国内外指南推荐TNK应用于轻型卒中或桥接治疗,但推荐力度弱,证据质量低[13,14],因此在临床实践中对TNK的使用仍然保持谨慎。今年ESO对TNK治疗AIS的研究证据进行检索与质量评价,最终在上述循证医学证据的支持下制定了《替奈普酶治疗急性缺血性卒中的快速建议》,有助于指导TNK的合理使用。期待未来有更多研究为TNK静脉溶栓治疗AIS提供更确凿的证据,为AIS的救治提供更多治疗选择。
吴波 教授
博士后,四川大学华西医院神经内科教授,科室副主任
博士研究生导师
哈佛大学医学院访问学者
世界卒中组织青年委员
中华医学会神经病学分会第七届青年委员会委员
中华医学会神经病学分会脑血管病学组委员兼秘书
国家卫健委脑卒中筛查与防治工程委员会中青年专家委员会常务委员
四川省神经病学专委会青年委员会副主任委员
四川省神经病学专委会脑血管病学组副组长
第十三批四川省学术和技术带头人
在Lancet Neurology,Neurology,Stroke,JNNP,JCBFM,International journal of stroke等杂志上发表论文50余篇,承担5项国家自然科学基金
参考文献:
1. 王春娟, 霍晓川, 冀瑞俊, 等. 急性缺血性卒中再灌注治疗医疗质量评价与改进专家建议[J]. 中国卒中杂志, 2021,16(07):705-715.
2. Alamowitch S, Turc G, Palaiodimou L, et al. European Stroke Organisation (ESO) expedited recommendation on tenecteplase for acute ischaemic stroke[J]. European Stroke Journal. 2023;0(0).
3. Haley E J, Thompson J L, Grotta J C, et al. Phase IIB/III trial of tenecteplase in acute ischemic stroke: results of a prematurely terminated randomized clinical trial[J]. Stroke, 2010,41(4):707-711.
4. Parsons M, Spratt N, Bivard A, et al. A randomized trial of tenecteplase versus alteplase for acute ischemic stroke[J]. N Engl J Med, 2012,366(12):1099-1107.
5. Huang X, Cheripelli B K, Lloyd S M, et al. Alteplase versus tenecteplase for thrombolysis after ischaemic stroke (ATTEST): a phase 2, randomised, open-label, blinded endpoint study[J]. Lancet Neurol, 2015,14(4):368-376.
6. Campbell B, Mitchell P J, Churilov L, et al. Tenecteplase versus Alteplase before Thrombectomy for Ischemic Stroke[J]. N Engl J Med, 2018,378(17):1573-1582.
7. Li S, Pan Y, Wang Z, et al. Safety and efficacy of tenecteplase versus alteplase in patients with acute ischaemic stroke (TRACE): a multicentre, randomised, open label, blinded-endpoint (PROBE) controlled phase II study[J]. Stroke Vasc Neurol, 2022,7(1):47-53.
8. Bivard A, Zhao H, Churilov L, et al. Comparison of tenecteplase with alteplase for the early treatment of ischaemic stroke in the Melbourne Mobile Stroke Unit (TASTE-A): a phase 2, randomised, open-label trial[J]. Lancet Neurol, 2022,21(6):520-527.
9. Menon B K, Buck B H, Singh N, et al. Intravenous tenecteplase compared with alteplase for acute ischaemic stroke in Canada (AcT): a pragmatic, multicentre, open-label, registry-linked, randomised, controlled, non-inferiority trial[J]. Lancet, 2022,400(10347):161-169.
10. Logallo N, Novotny V, Assmus J, et al. Tenecteplase versus alteplase for management of acute ischaemic stroke (NOR-TEST): a phase 3, randomised, open-label, blinded endpoint trial[J]. Lancet Neurol, 2017,16(10):781-788.
11. Kvistad C E, Naess H, Helleberg B H, et al. Tenecteplase versus alteplase for the management of acute ischaemic stroke in Norway (NOR-TEST 2, part A): a phase 3, randomised, open-label, blinded endpoint, non-inferiority trial[J]. Lancet Neurol, 2022,21(6):511-519.
12. Roaldsen M B, Eltoft A, Wilsgaard T, et al. Safety and efficacy of tenecteplase in patients with wake-up stroke assessed by non-contrast CT (TWIST): a multicentre, open-label, randomised controlled trial[J]. Lancet Neurol, 2023,22(2):117-126.
13. Berge E, Whiteley W, Audebert H, et al. European Stroke Organisation (ESO) guidelines on intravenous thrombolysis for acute ischaemic stroke[J]. Eur Stroke J, 2021,6(1):I-LXII.
14. 中国脑血管病临床管理指南. 中国卒中杂志, 2019, v.14(07):85-102.
审批编号:SC-CN-12802
有效期至:2025/8/16
仅供相关医药专业人士进行医学科学交流
↓↓↓
查看更多