查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






2025年10月4—7日,第33届欧洲消化疾病周(UEGW)在德国柏林举行。作为消化病学领域的国际盛会,UEGW一直是全球专家学者展示最新研究成果、交流前沿进展的重要平台。
遵义医科大学附属医院消化内科庹必光/刘雪梅教授团队,基于在离子通道与消化系统肿瘤领域的深厚积累,在本届大会上带来5项系列创新研究成果。其中,一项获选大会口头报告,一项入选专题主持壁报(Moderated Poster),三项被大会接收为壁报展示;同时,团队还荣获大会旅行奖学金(Travel Grant)。上述成果与荣誉,不仅是团队科研创新能力的直接体现,更标志着其研究水平获得国际同行的高度认可。
《中国医学论坛报》特别邀请庹必光/刘雪梅教授团队对研究成果进行介绍,以飨读者。
解痉多肽表达化生(SPEM)是胃癌演进中的关键癌前病变。传统理论认为其发生与胃壁细胞缺失密切相关。刘雪梅教授团队聚焦SPEM的细胞起源问题,构建壁细胞与主细胞特异性基因缺失模型,综合运用单细胞测序、免疫共沉淀、质谱分析等一系列前沿技术,系统揭示SPEM形成的双重驱动路径:
研究通过单细胞测序明确细胞群体特征,结合免疫共沉淀与质谱分析,首次证实CHIA基因缺失可引发内质网应激,进而激活NLRP3炎症小体及细胞焦亡通路,推动IL-33/ST2–M2型巨噬细胞极化,从而建立一条不依赖于壁细胞缺失的SPEM发生新路径。该研究获选大会口头报告。
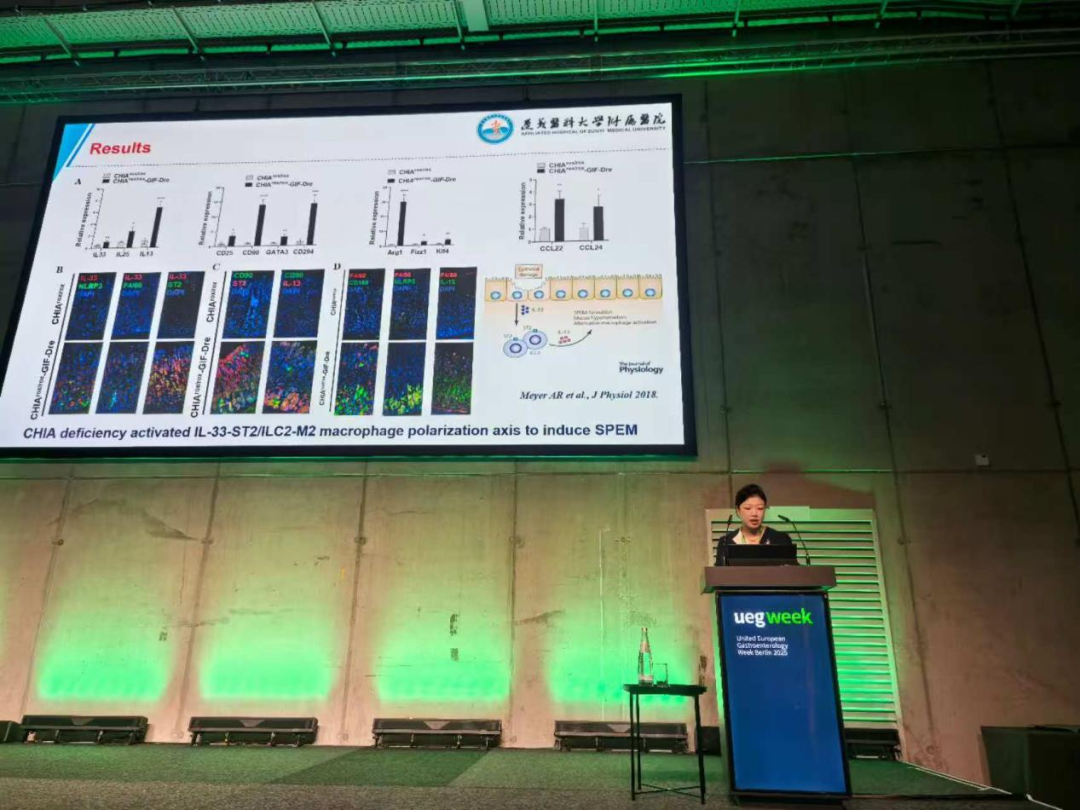

刘雪梅教授在UEGW2025大会现场进行口头报告
团队进一步运用单细胞测序与免疫共沉淀等技术,揭示Slc26a9缺失会通过Gasdermin D介导的线粒体损伤途径,诱发壁细胞自发性丧失,进而驱动IL-25–ILC2–M2巨噬细胞免疫重构,最终促成基于自身免疫性胃炎(AIG)的SPEM发生。该成果在Moderated Poster环节展示。

刘雪梅教授在Moderated Poster现场进行交流
该系列研究系统阐述了SPEM发生的“壁细胞线粒体焦亡—主细胞内质网应激”双驱动模式,实现了从亚细胞结构到免疫微环境的全景式机制解析,为胃黏膜损伤与胃癌前病变的防治提供了全新视角与理论依据。
团队在结直肠癌研究方面同样取得了重要进展。Slc26a9在结直肠癌脂质代谢调控中的作用机制研究亦入选本次大会壁报展示。该研究聚焦Slc26a9与RRBP1的相互作用,揭示其通过激活HSPA5介导的内质网应激通路,驱动线粒体与脂质代谢重编程,从而促进结直肠癌进展。这一发现不仅揭示了结直肠癌代谢调控的新机制,也为靶向Slc26a9–RRBP1–HSPA5信号轴提供了潜在治疗策略。
团队在肝纤维化及肝癌领域的两项研究亦获得大会壁报展示,共同揭示了离子通道在慢性肝病演进中的关键作用。
该研究聚焦氯离子通道在肝纤维化中的作用,发现阻滞剂DIDS可通过纠正肝星状细胞内的氯离子稳态失衡,有效抑制其活化。在多种肝纤维化动物模型中,DIDS均表现出显著的抗纤维化效果。该研究系统阐明了DIDS通过调控氯离子稳态抑制肝纤维化的新机制,为其临床转化提供了重要理论依据。
另一研究聚焦离子通道CLIC1在肝细胞癌中的作用。通过细胞与动物模型的双向验证,团队发现CLIC1是肝癌恶性进展的关键调控因子,揭示了其作为潜在治疗靶点的重要意义,为肝细胞癌的精准治疗提供了新方向。
这两项研究分别从纤维化抑制与肿瘤干预两个维度,拓展了离子通道在肝脏疾病研究中的深层次机制认知,也为相关靶向药物的开发奠定了科学基础。

刘雪梅教授与德国汉诺威医科大学 Prof.Ursula Seidler教授在UEGW2025会议现场交流合影
庹必光、刘雪梅教授团队深耕离子通道与消化系统恶性肿瘤,系列研究从癌前病变到进展机制,充分展现了其在消化系统肿瘤研究领域的系统布局与技术深度,也为临床转化提供了重要的理论依据与新靶点探索方向。
END
查看更多