查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





导读
1992年,美国食品与药物管理局(FDA)启动了“加速批准”通道,试图解决未被满足的危急重疾病的临床需求。加速批准通常采用替代终点作为评估条件,而药品制造商依旧需要继续进行验证试验,如果验证试验结果呈阴性,“加速批准”可能会被撤回,如果验证试验最终确认了临床获益,该药物获得的“加速批准”会转为常规“批准”。
过去10年中,85%FDA“加速批准”的都是肿瘤适应证,过去6年中,FDA批准了6个免疫检查点抑制剂(抗PD-1/抗PD-L1抑制剂),覆盖了超过75个肿瘤适应证,其中有35个都是“加速批准”。
自1992年“加速批准”程序启动以来,只有6%的加速批准药物最终从市场中被撤回,而在这半年之间,就有6个免疫治疗适应证被药企主动申请撤回。从比例来看,这个数量不可小觑的。
接下来我们就来梳理一下这6个“失败”的经验。
• Part1
免疫双药折戟小细胞肺癌
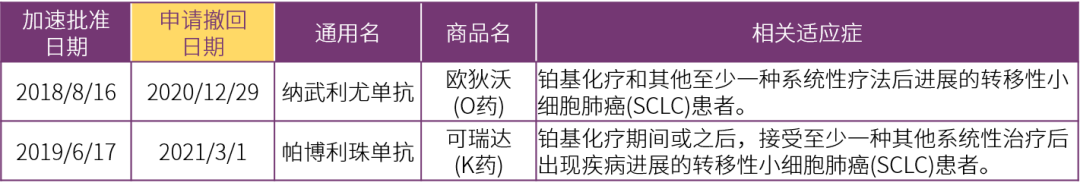
小细胞肺癌(SCLC)疾病进展快,早期即容易出现转移,预后极差。纳武利尤单抗和帕博利珠单抗是免疫治疗中获批适应证最多的两大药物,这两个药也都试图拿下SCLC治疗适应证,并且分别在2018年和2019年获得了FDA“加速批准”,获批的适应证也极其相似,却都分别在2020年底和2021年3月申请撤回SCLC治疗的相关适应证。
1.1
加速批准时的终点数据回顾及相关验证试验结果:
1.1.1 纳武利尤单抗:
• 加速批准终点(CheckMate-032):客观缓解率(ORR), 12% (95% CI, 6.5~19.5);疾病控制时间(DOR), 3.0~42.1个月;77%患者有≥6个月的持续响应;62%患者有≥12个月的持续响应。
• 验证试验(CheckMate-451/331):在不同治疗场景下进行了纳武利尤单抗的单药治疗验证,均未达到主要终点“总生存(OS)期”。
CheckMate-451:共入组834例进行了4周期化疗后疾病稳定的广泛期SCLC,1:1:1分别接受纳武利尤单抗+伊匹木单抗、纳武利尤单抗单药、安慰剂作为维持治疗,最终结果显示,与安慰剂相比,纳武利尤单抗单药 (HR, 0.84; 95% CI, 0.69-1.02)、纳武利尤单抗+伊匹木单抗 (HR, 0.92; 95% CI, 0.75-1.12; P=0.3693)均未带来OS期获益。
CheckMate-331:研究入组了803例铂基化疗后复发的SCLC患者,对比纳武利尤单抗与化疗在治疗复发SCLC患者中的OS获益,结果显示纳武利尤单抗单药治疗并没有带来显著OS改善(HR, 0.86 [95% CI, 0.72–1.04])。
1.1.2 帕博利珠单抗:
• 加速批准终点(KEYNOTE-28/158):入组83例,ORR,19% (95% CI, 11-29);DOR, 4.1- 35.8+月;16例响应的患者中,94%有≥6月的持续响应;63%有≥12月的持续响应。
• 验证试验(KEYNOTE-604):试验入组453例ES-SCLC,比较“帕博利珠单抗+化疗”对比单独化疗在一线治疗中是否能带来临床获益,试验结果只达到了PFS这一个主要终点(HR, 0.75; 95% CI, 0.61-0.91; P=0.0023),没有达到OS这个主要终点(HR=0.80 ,95% CI为0.64-0.98),最终以阴性结果告终。
1.2
在SCLC治疗中,有免疫治疗的获批适应证吗?
虽然两个PD-1抑制剂都在SCLC治疗中折戟,但是有两个PD-L1抑制剂在SCLC治疗中已经获得常规FDA批准,分别是“阿替利珠单抗”和“度伐利尤单抗”,被批准与化疗药联合用于广泛期小细胞肺癌(ES-SCLC)成人患者的一线治疗。

• Part2
两大PD-L1抑制剂折戟尿路上皮癌
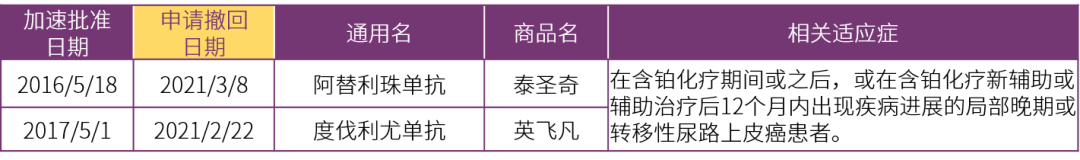
阿替利珠单抗和度伐利尤单抗分别在2016、2017年获“加速批准”应用于尿路上皮癌,作为这两个药的第一个获批适应证,对这两个药物而言,这个适应证是非常具有意义的。这两个药的药物机制和首个获批适应证都是相同的,遗憾的是,结局也是一样的,都在今年申请撤回了该适应证。
2.1
加速批准时的终点数据回顾及相关验证试验结果:
2.1.1阿替利珠单抗:
• 加速批准终点(IMvigor210):ORR,14.8% (95% CI, 11.1-19.3);DOR, 中位未达到(范围, 2.1+~13.8+月);
• 验证试验(IMvigor211/130) :IMvigor211:入组931例,对比阿替利珠单抗单药与化疗的临床获益,试验结果未达到主要终点OS(HR, 0.87; 95% CI, 0.63-1.21; P=0.41);
IMvigor130:随后FDA指定IMvigor130作为最终验证试验,该试验入组1213例患者,对比阿替利珠单抗联合化疗与单独化疗作为一线治疗的临床获益,虽然最终结果达到了主要终点PFS及OS,但是由于在该治疗场景下有新的治疗方案出现,基于“加速批准”的原则,药厂最终撤回了该适应证。
2.1.2度伐利尤单抗:
• 加速批准终点(NCT01693562):ORR,17% (95% CI, 11.9 to 23.3);DOR, 中位未达到(范围, 0.9+~19.9+月);45%有≥6月的持续响应;16%有≥12月的持续响应。
• 验证试验(DANUBE):入组1126例,对比度伐利尤单抗、度伐利尤单抗联合tremelimumab (CTLA-4抑制剂)与标准治疗在一线治疗中的临床获益,试验结果未达到主要终点OS、PFS。
2.2
尿路上皮癌治疗中当前可选的其他免疫治疗:
PD-L1抑制剂:
阿替利珠单抗:2017年4月,该药再次获得了尿路上皮癌的“加速批准”,但是与2016年获批的适应证不同的是,2017年的适应证对PD-L1表达做了要求。
Avelumab:2017年5月获批尿路上皮癌二线治疗,2020年6月获批维持治疗。
PD-1抑制剂:
纳武利尤单抗:2017年2月获得“加速批准”用于二线治疗。
帕博利珠单抗:2017年5月获得常规批准用于二线治疗;同月获“加速批准”用于PD-L1表达(CPS≥10)的一线治疗。
• Part3
胃或胃食管连接部腺癌
获批应用于消化道肿瘤的免疫治疗适应证本来就相对少,帕博利珠单抗的该项适应证最终撤回,意味着患者的免疫治疗机会又减少了。

3.1
加速批准时的终点数据回顾及相关验证试验结果:
帕博利珠单抗:
• 加速批准终点(KEYNOTE-059):143例,ORR,13.3% (95% CI, 8.2-20);DOR, 2.8- 19.4+月;19例响应的患者中,58%有≥6月的持续响应;26%有≥12月的持续响应。
• 验证试验:二线KEYNOTE-061/一线KEYNOTE-062:
•KEYNOTE-061:帕博利珠单抗(n=296)对比紫杉醇(n=296)二线治疗,OS和PFS的HR分别是 0.82 (95% CI, 0.66-1.03) ,1.27 (95% CI, 1.03-1.57),未达到主要终点。
•KEYNOTE-062:帕博利珠单抗(n=256), 帕博利珠单抗联合5-FU/顺铂 (n=257), 5-FU/顺铂(n=250)。帕博利珠单抗单药和化疗对比的OS、PFS 分别是0.91 (95% CI, 0.69-1.182) 、1.64 (95% CI, 1.36-1.98), 未达到主要终点。
3.2
胃食管肿瘤治疗中当前可选的其他免疫治疗

• Part4
肝细胞癌
肝细胞癌对化疗不敏感,相关药物的研发进展缓慢,可选择的治疗方案有限。
2007年FDA批准靶向药索拉非尼用于不可手术的晚期肝癌一线治疗,肝癌全身治疗的空白局面才首次被打破,而此后长达11年,晚期肝癌一线治疗都处于被索拉非尼“垄断”的局面(直至2018年乐伐替尼也被获批用于晚期一线治疗)所以当前肝细胞癌的二线治疗相关临床试验,基本都是基于“索拉非尼治疗后进展”而展开的。

4.1
加速批准时的终点数据回顾及相关验证试验结果:
纳武利尤单抗:
• 加速批准终点(CheckMate-040):154例,ORR,14.3% (95% CI, 9.2-20.8);DOR,3.2- 38.2+个月; 91%有≥6个月的持续响应;55%有≥12月的持续响应。
• 验证试验:一线CheckMate-459 :或许是由于已存在类似的二线治疗方案,验证试验要求在一线治疗中,对比纳武利尤单抗与索拉非尼的临床获益,主要终点OS未达到(HR=0.85 [95% CI: 0.72-1.02]; p=0.0752)。
4.2
肝细胞癌治疗中当前可选的其他免疫治疗
让人欣慰的是,在肝细胞癌的一线治疗中,阿替利珠单抗联合贝伐珠单抗获得了常规的批准。而其余的批准均为经索拉非尼治疗后的二线治疗,且都是“加速批准”,其中包括纳武利尤单抗联合依匹木单抗。

小结
这6个被撤回的适应证在加速批准时,依据的相关试验均为单臂试验,均选择客观缓解率(ORR)和持续响应时间(DOR)作为替代终点;ORR都在10%~20%之间,其实并没有显示出让人非常惊喜的数据,最终获得加速批准主要是由于对治疗获得了相对长时间的响应,并且在特定的场景下没有其他可用方案。
在大部分细胞毒性药物以及越来越多的靶向药的单臂试验中,如果观察到可观的ORR,大多数都意味着后续确实能带来临床获益,而这6个被撤回的适应证提示我们,在抗PD-1/PD-L1药物中,依据单臂试验的ORR作为加速批准的终点,是否需要打一个问号?
在进行验证试验的时候,通常不是在获得加速批准的相同适应证中进行,会在更早期的患者中,或者用药线数更提前等更加稀缺、特定的场景中进行验证。该策略一方面使得潜在的重要进展可以迅速扩展到可能受益的更多患者,但在抗PD-1/PD-L1这类药物中,这个策略或许也是促使验证试验结果阴性的一个原因。
此外,联合用药方案(联合化疗/联合靶向/免疫双联合)也是当前免疫治疗方案中的一个大方向,当前获得FDA常规批准的免疫一线治疗中,联合方案多达19个,“单药使用”的方案仅5个,且都集中在常见癌种中,其中3个都是用于NCSLC适应证。我们在这6个被撤回的适应证也可以看到,在多个验证试验中,是想要尽可能突破“联合治疗”,向着“单药治疗”的方向开展验证的。只是很遗憾最终并没有达到主要终点。
而对于这些被撤回的适应证,也许不仅是加速批准的失败,也是对于这些癌症治疗方案、相关药物开发等方面的一种负反馈。最终或许还是要回归到生物标志物指导免疫治疗中去,除了当前的标志物之外,新的标志物、免疫微环境需要被更多的研究和认识。
来源:臻和基因

查看更多