查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





导语:新型检测方法基于定量测定,弥补现有检测方法的不足,实现对HER2低表达乳腺癌的精准检测。
一些新型药物开启了HER2低表达乳腺癌靶向治疗的新时代,但是如何筛选出最佳获益人群成为目前亟待解决的问题,这是因为传统HER2检测旨在区分HER2扩增和未扩增病例,其灵敏度不足以针对HER2低表达乳腺癌进行准确区分。近期,病理学权威期刊Laboratory Investigation发表的一篇研究报道“Quantitative measurement of HER2 expression to subclassify ERBB2 unamplified breast cancer”中,研究者为确定乳腺癌中未扩增HER2检测的最佳动态范围,构建并验证了一种检测HER2表达的新方法。这种检测方法能够实现HER2的定量检测,有利于基于不同HER2表达水平进行更加精准的患者分层。
现有检测方式不能覆盖HER2低表达,新型方式亟待探索
HER2阳性或者ERBB2基因扩增约占乳腺癌的15%,包括单克隆抗体、小分子酪氨酸激酶抑制剂(TKI)、ADC药物等一系列抗HER2靶向治疗显著改善了HER2阳性乳腺癌患者的临床结局。但是既往抗HER2靶向治疗仅针对免疫组化(IHC)染色为3+或HER2/CEP17荧光原位杂交(FISH)扩增比率≥2.0且HER2拷贝数信号/细胞≥4的患者有效。因此,大多数乳腺癌患者(85%)被认为是HER2“阴性”(IHC 0或IHC 1+或IHC 2+/FISH-)。
基于在HER2 IHC评分为1+和2+(未扩增)的患者中观察到新型HER2靶向ADC药物的抗肿瘤活性,与治疗疗效紧密相关的HER2扩增概念正在逐渐发生变化。由于目前使用的HER2检测旨在区分HER2扩增和未扩增肿瘤,HER2 IHC在低表达范围(0和1+)的评分准确性较差。在一项80个美国病理学家学会成员水平测试的调研案例中,15例评定者间的一致性低于70%。这可能是由于在低表达范围内,通过HER2蛋白对肿瘤的染色非常弱。在一些研究中,HER2在肿瘤中的表达范围很广泛,从每个细胞表达约1000个分子至超过1,000,000个分子。极少数检测方法能覆盖HER2表达水平的3个数量级动态范围。例如,IHC染色法能覆盖的线性动态范围通常仅在一个数量级以内。因此,为了准确评估乳腺癌中HER2蛋白表达,需要使用不止一种抗体浓度进行多次检测,或者选择具有3个数量级动态范围的检测方法。
虽然对HER2表达进行全动态范围的检测可能具有价值,但现有的HER2检测方法仅可以区分HER2扩增和未扩增,只适用于曲妥珠单抗和其他靶向HER2扩增的药物。鉴于这些检测方式不包含HER2低表达范围,有必要构建一种分辨率在HER2低表达范围内的新型检测方法。这可能通过显色测定得到实现,该研究使用定量免疫荧光结合质谱标准化的HER2阵列形成一种可定量的检测方法,可在常规组织切片上测量以attomol/mm2为单位的HER2蛋白的绝对量,检测方法开发概述见图1。研究者旨在开发一种针对HER2低表达的特异性检测方法,并从系列回顾性乳腺癌病例集中检测HER2低表达的发生率。
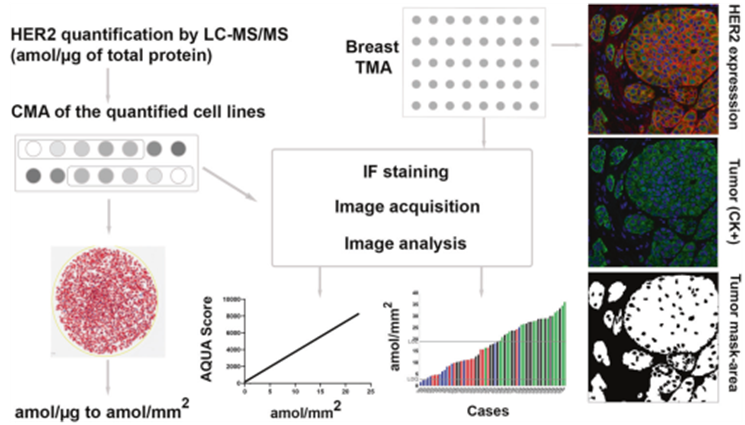
图1. HER2低表达检测示意图。通过LC-MS/MS定量检测HER2表达范围的细胞系用于生成细胞微阵列(CMA)标准。测定细胞面积(mm2),可以将总蛋白中HER2表达的单位从amol/ug转化为amol/mm2。采用不同抗HER2抗体浓度对CMA进行染色,确定检测限(LOD)/定量限(LOQ)和线性度(LOL)。AQUA评分和amol/mm2之间的线性回归分析可以生成一条标准曲线,用于计算以amol/mm2为单位的HER2表达。使用AQUA分析乳腺癌染色组织。经过分析,HER2表达/病例可以amol/mm2为单位进行定量。
材料和方法
细胞系和培养条件
7个细胞系来自美国模式培养物集存库(ATCC, Manassas, VA 20110, USA),包括:JURKAT#TIB-152、BT20#HTB-19、T47D#HTB-133、ZR-75-1#CRL-1500、BT483#HTB-121、AU565#CRL-2351和BT474#HTB-20。按照ATCC提供的培养方法培养各细胞系。来自这些细胞系的细胞团被冷冻并送至Protypia公司测定总蛋白中以attomoles(amol)/μg为单位的HER2表达。
液相色谱-串联质谱(LC-MS/ MS)
Protypia公司通过LC-MS/MS分析7种细胞系中HER2的蛋白丰度。根据生产商说明,使用M-PERTM试剂盒(ThermoFisher Scientific, Rockford, IL)从冷冻细胞团块中提取蛋白质,并加入HALTTM蛋白酶抑制剂(ThermoFisher Scientific)。用BCA试剂盒(ThermoFisher Scientific)分析蛋白含量,并将100 μg蛋白还原、烷基化并用胰蛋白酶消化。向胰蛋白酶消化物中加入HER2肽[13C6, 15N4-Arg]-DPPFCVAR和[13C6, 15N4-Arg]-ELVSEFSR(99.5%同位素纯度;Vivitide, Gardner, MA)标准品,通过高pH反相色谱和一次性离心柱(Thermo-Fisher Scientific)分离提取。含有目标肽的组分,通过如前所述的LC-MS/MS平行反应监测分析。使用Skyline20分析样品中标记标准肽和未标记HER2肽的MS/MS裂解,并根据肽序列的三个最强MS/MS裂解的信号总和与加入的标准品量的比值,计算HER2蛋白丰度(以amol/μg蛋白计)。
HER2校准CMA
HER2校准细胞微阵列(CMA)由Array Science LLC(Sausalito, CA)构建。细胞系排列成两列,如图2所示。
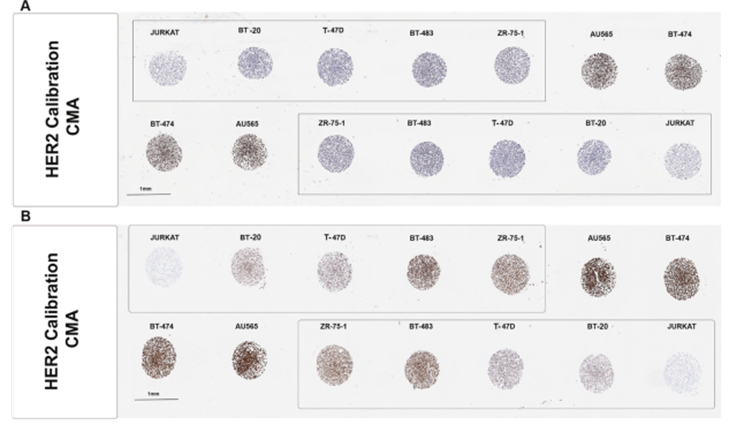
HER2标准化耶鲁TMA(YTMA263)、乳腺癌队列(YTMA489、YTMA499)和乳房成形术来源的乳腺组织队列(YTMA540)
HER2标准化组织微阵列(TMA)的构建,来自于提取从1998年至2011年在耶鲁病理学系收集到的80例FFPE乳腺癌的空心针取样、10例乳腺细胞系对照(在耶鲁制备)和10例非肿瘤乳腺组织空心针取样。如前所述,根据HER2状态将样本进行排列。本研究中使用的两个乳腺癌队列(YTMA489和YTMA499)分别由2011~2012年和2013~2014年在耶鲁病理学系收集到的263例和190例FFPE系列乳腺癌组成。从病理学报告中提取CLIA认证的IHC和FISH检测结果。每个队列的两个重复TMA来自两个独立的YTMA489和YTMA499区组,每个区组包含每例患者的一个不相邻的肿瘤空心针样本。类似地,YTMA540提取至2011年至2014年之间进行乳房缩小成形术(整容手术)的没有任何已知乳腺疾病的16名女性患者(年龄18~62岁,中位数36.5岁)的FFPE乳房组织空心针样本。在TMA上使用每个队列的3份重复样本。
抗体、免疫组化和定量免疫荧光
染色和蛋白表达的验证
为了抗体验证,对靶向HER2胞内结构域的两种不同HER2抗体进行了检测;29D8(CST#2165;R-IgG),识别人HER2蛋白酪氨酸1248周围的残基,PATHWAY抗HER-2/neu(4B5)(Roche_#107918,R-IgG),识别人HER2蛋白的TAENPEYLGL表位(残基1242–1254)。首先,使用相同的工作浓度,在相同的染色条件比较YTMA263相同肿瘤位点中两个克隆的染色模式。用29D8和4B5测定的HER2水平高度相关(rS=0.87,P<0.0001)(图3A)。由于4B5已被证明与ERBB4有交叉反应,在本研究中的分析仅使用29D8测定的HER2水平。此外,考虑到批间/操作员间的差异,在定义HER2低表达测定的优化条件后,由两名独立的操作员对标准化YTMA263和校准CMA进行染色,结果显示批间/操作员间具有高度一致性和重现性。(图3B, C)
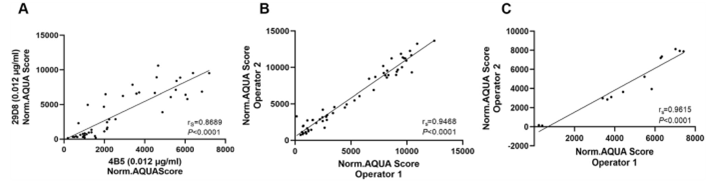
图3. 抗体试剂的验证和质量控制。A HER2 ICD两个不同克隆之间的相关性散点图显示Operator 1和Operator 2在C的校准CMA和B的YTMA263的相关性,使用HER2低表达检测。
染色方法(IHC)
进行显色染色(Liquid DAB + Substrate Chromogen, Dako),然后用Tacha苏木精(Biocare Medical, Concord, CA, USA)复染3分钟,并用乙醇和二甲苯脱水。在耶鲁CLIA实验室,使用Leica Bond III Refine polymer DAB Detection和HER2/ErbB2 clone EP3 Epitomics 1:100,上以低pH提取40分钟(图2A)。Rimm Lab则使用1.28 μg/mL的HER2/ErbB2 29D8(克隆29D8,#2165,Cell Signaling Technology)和压力煮沸容器(PT Module, Lab Vision, Thermo Scientific, Waltham, MA)(图2B)。最后,使用Cytoseal 60(Thermo Scientific, Waltham, MA)封片,并在Aperio ScanScope XT平台中成像。
在x40下使用Aperio ScanScope XT平台对载玻片进行数字化扫描。使用QuPath评估每个细胞系的面积(mm2)/细胞,进行自动细胞分割可检测单个细胞核或细胞,并支持测算每个细胞所占面积。使用4个独立的CMA片子,每个片子具有两倍冗余。使用每个细胞系8次测量的平均细胞面积计算面积(mm2)/细胞。
TMA/CMA切片脱蜡后,在压力煮沸容器(PT Module, Lab Vision, Thermo Scientific, Waltham, MA)中用EDTA pH 8缓冲液在97 °C下进行抗原孵育20 min。然后将载玻片在0.3%过氧化氢甲醇溶液中孵育30 min,以抑制内源性过氧化物酶活性,然后与0.3%牛血清白蛋白和0.05%吐温-20封闭液再孵育30 min。将抗HER2的一抗(克隆29D8,Cell Signaling)用于组织,在4 ℃下以7种不同浓度/稀释度(0.000128 μg/mL~12.8 μg/mL)与细胞角蛋白(CK)以1:100稀释(单克隆小鼠抗人细胞角蛋白,克隆AE1/AE3;广谱筛选,Dako,Glostrup,Denmark)过夜孵育。使用的二抗包括anti-rabbit EnVision试剂(Dako)和anti-mouse Alexa Fluor 546(Invitrogen, 1:100),分别用于HER2和CK。Cy5酪胺(PerkinElmer, 1:50)用于显像HER2阳性细胞。使用4′,6-二脒基-2-苯基吲哚(DAPI)复染和显示细胞核,用ProLong Gold Antifade试剂(Invitrogen)封片。
此外,使用HER2低表达测定方式,在同一天对来自两个独立YTMA489和YTMA499组织块(每个组织块含有一个非相邻肿瘤核心)的两个载玻片进行相同的染色程序,以观察批次差异。
使用PM-2000系统(Navigate Biopharma, Carlsbad, CA, USA)采集荧光图像,并使用QIF的AQUATM方法测定表达水平。如前所述,通过目标像素强度之和除以分子指定的隔室面积产生AQUA评分。为了区分肿瘤与组织基质和其他成分,通过将CK信号二值化并创建上皮隔室,创建了上皮肿瘤“掩模”。将AQUA评分标准化为采集图像的曝光时间和位深,以补偿任何变异性。对所有采集的TMA位点进行评估,分析时去除染色伪影或肿瘤(CK染色)小于2%的病例。
研究结果
细胞系HER2水平的定量测定
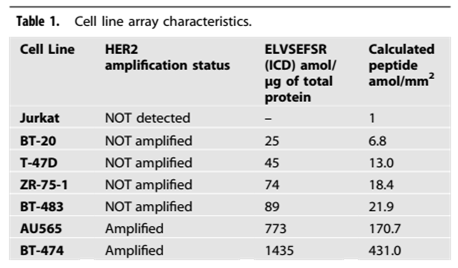
为生成标准化CMA,使用LC-MS/MS方法测定来自6种乳腺癌细胞系(BT-20、T-47D、ZR-75-1、BT-483、AU565、BT-474)和一种作为阴性对照的非乳腺癌细胞系(JURKAT)的细胞团块中的HER2表达。通过LC-MS/MS测定中连续一式三份稀释的BT-474(HER2高表达)和JURKAT(HER2无表达)的细胞混合实验,对LC-MS/MS试验的线性范围进行了探索。
通过LC-MS/MS测定以amol/ug为单位的总蛋白中7个细胞团块的DPPFCVAR(HER2蛋白的胞外域)和ELVSEFSR肽(HER2蛋白的胞内域)。以attomole/ug为单位的HER2定量范围从BT-20(最低未扩增细胞系)中的25 amol/ug至最高扩增细胞系(BT-474)中的1435 amol/ug。在JURKAT细胞中未检测到HER2。通过DPPFCVAR和ELVSEFR测定的HER2水平高度相关(Spearman系数r=1.00,P=0.004)。由于在乳腺癌细胞中观察到细胞膜表面的HER2胞外域被酶切,并且大多数常见的临床试验使用细胞质结构域抗体,因而在本研究中使用细胞内ELVSEFSR肽测量作为HER2的分析物。
HER2校准CMA和DIA
在测定每个细胞系总蛋白中以amol/μg为单位的HER2浓度后使用相同的细胞系构建了CMA(Array Science, LLC)(图2,表1),因此可以将amol/ug转换为amol/mm2。为了建立优化的HER2低表达测定方式,重点关注该阵列的非扩增细胞系(JURKAT、BT-20、T-47D、ZR-75-1和BT-483)。为了将细胞中总蛋白的单位amol/μg转换为玻片上细胞占据的amol/面积,研究使用QuPath(开源软件)评价CMA上每个细胞系的面积(mm2)/细胞。使用4个不同后续载玻片中测量的平均值作为面积/细胞(mm2)的参考值。
表1. 细胞系阵列特征
测定方法开发以及检测限和定量限的确定
如先前Gonzalez和Herrador所述,分析信号与分析物浓度之间的响应函数或校准曲线为单调函数。一些数学模型,如数学变换以及加权回归,可以检测响应度如何随分析物浓度的变化而变化。分析方法中常见的最简单模型是线性回归分析,根据公式(1)预测响应度。
Y=aX+β(公式1)
其中α为斜率,β为截距,标准差分别为sα和sβ。
在本研究中,Y对应AQUA评分,X对应amol/mm2。
检测限(LOD)和定量限(LOQ)是从分析灵敏度相互推导出来的两个参数,用于评估性能特性。LOD是可以检测到并与系统噪声水平准确区分的分析物最低浓度,但不一定定量;测量值大于相关不确定值的浓度。LOD可表示为响应单位(YLOD),并使用公式进行计算:
YLOD =Yblank +3 Sblank(公式2)
其中Yblank和Sblank分别是通过测量至少10份独立样品空白获得的空白信号的平均值及其相应的标准偏差。在这种情况下,空白样本定义为染色过程中省略一抗的样本(见下文)。
LOQ是可定量测定的分析物最低浓度,具有可接受水平的精密度。通过测量至少10份独立样品空白并使用因子10而不是3进行计算,评价LOQ的公式与LOD的公式相似:
YLOD =Yblank +10 Sblank(公式3)
为了评估Yblank,使用标准化的HER2 YTMA263阵列,它有超过10例HER2低表达病例。当IF方案中不加入抗HER2一抗时,获得HER2低表达病例的AQUA评分(IHC为0、1 +、2 +/未扩增)后,评估Yblank和Sblank,如上所述。
为了将以信号单位(YLOD、YLOQ)表示的LOD和LOQ转换为分析物浓度单位(ZLOD、ZLOQ),研究中使用了以下校准函数:
Z=(Y-β)/α (公式4)
使用范围在1.28 ng/mL到12.8 μg/mL之间的7个稀释度的一抗(HER2/ErbB2 29D8)对YTMA263进行染色和校准CMA。图4显示了标准化CMA的信号响应(标准化AQUA评分)和分析物浓度(amol/mm2)的线性回归分析。使用公式1-4能够鉴别各试验的LOD和LOQ。确定HER2低表达定量的最佳检测方法是29D8一抗的1.28 μg/mL,该浓度的抗体在未扩增细胞系(BT-483)中产生最高水平的信号,而噪声水平最低(来自Jurkat细胞的信号)。在1.28 μg/mL HER2 29D8抗体下,计算的LOD为0 amol/mm2,LOQ为2.8 amol/mm2。此外,为了评估试验线性限度,评价了每次试验的响应因子RF。响应的线性范围对应于从y=1.05α相交点至y = 0.95α相交点的分析物浓度,假设该模型呈线性且无截距。对于1.28 μg/mL含量测定,线性上限(LOL)为19 amol/mm2。
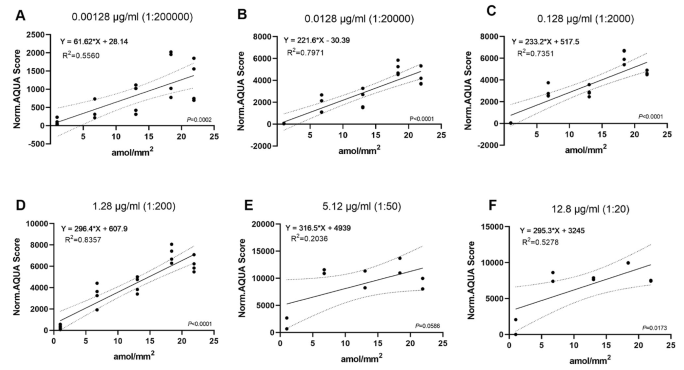
图4. 对照细胞系的回归显示了各检测抗体浓度下的重现性和相关性。以amol/mm2为单位的每种抗体(29D8)浓度作为X,AQUA评分为Y,进行线性回归。使用2-4倍冗余,使用线性回归方程测定各试验的LOD和LOQ。
在364例通过IHC/ISH表征的临床病例和11例乳房缩小成形术病例中探索HER2低表达测定的LOQ和LOL
在确定了最佳的线性HER2低表达检测方法后,研究者试图将其应用于一个大型队列,该队列包含2011-2014年间在YNHH采集的乳腺癌患者样本。使用364个肿瘤核心的TMA,在两倍冗余中,测量了HER2的表达水平。使用每例患者的两个空心针样本的平均值进行分析。根据最佳测定方式的回归分析方程(Y=296.4X+607.9,图4D)。图5显示了病理学家评分显色的所有病例的直方图(0=蓝色,1=红色,2=黑色,3=绿色)。Y轴显示了364个乳腺癌组织TMA空心针样本中的HER2水平(amol/mm2)。IHC 1 + 和2 + 病例的示例图像如图6A–D所示。使用该测定法,364例中有61例(17%)低于LOQ,58/264例(16%)高于LOL。大多数病例(67%)在试验的线性范围内。有趣的是,IHC 2+、1+和0的病例具有广泛的HER2表达动态范围,与之前的观察一致,即病理学家使用常规IHC检测对低表达范围病例进行准确评分具有挑战性或不可能。还应注意的是,定量测量是在组织微阵列点上进行的,而病理学家评分是来自整个组织切片。
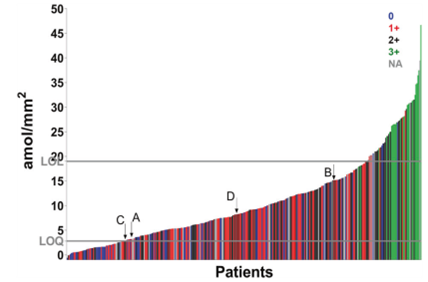
图5. 连续收集的人群中乳腺癌病例的分布显示许多病例高于LOQ,而常规分析认为是阴性。364例乳腺癌患者中HER2低表达测定的直方图,以amol/mm2测量。颜色编码对应HER2 IHC评分;绿色(3+)、黑色(2+)、红色(1+)、蓝色(0)、灰色(NA,不适用)。LOQ定量限;LOL线性限;IHC免疫组织化学。A到D是图6中所示的情况。
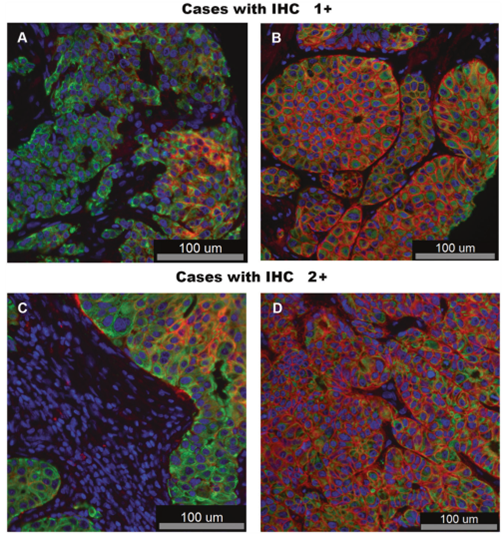
图6.具有膜性表达模式的HER2低表达病例的图示。图5中病例的代表性图像显示IHC 1+(A)3.2 amol/mm2(B)、15 amol/mm2和IHC 2+(C)2.8 amol/mm2和(D)7.8 amol/mm2
一些病理学家使用术语“HER2正常”而不是“HER2阴性”来描述正常乳腺上皮细胞的HER2表达。为了研究无已知疾病的乳腺组织中HER2表达的动态范围,研究者对YTMA540的11个可用样本进行了HER2低表达检测,YTMA540是一个由2011-2014年乳房缩小成形术病例建立的队列。值得注意的是,这些病例均未超过10amol/mm2的阈值。尽管未来将使用该测定方式研究更多病例,但初步数据显示正常乳腺导管的HER2表达水平在2.5和10 amol/mm2范围内。未来观察哪些患者能从ADC药物治疗中获益以及其肿瘤HER2表达水平是否高于“正常”临界点(10 amol/mm2)十分有意义。
研究总结
本研究使用定量免疫荧光和一系列表达HER2蛋白但ERBB2基因未扩增的细胞系,建立和验证了一种在组织样本中检测HER2表达的新方法。该方法基于质谱测量HER2蛋白量,并结合阵列形式进行标准化。HER2的表达在细胞系中以attomols/ug总蛋白测定,然后通过图像分析和面积测定转换为attomols/mm2,其中使用的AQUA分析方法可以评估单位面积的信号而不是单个细胞。这样形成的检测在2~20 attomols/mm2范围内是线性的,这个范围低于HER2扩增的细胞系或肿瘤的水平,但却在正常乳腺上皮细胞的HER2表达范围内。因此,研究者认为这个检测方法可在HER2靶向ADC药物有效的关键范围内检测HER2表达,而当前检测方法在这个范围内缺乏可重复性。
参考文献
Moutafi M, Robbins CJ, Yaghoobi V, et al. Quantitative measurement of HER2 expression to subclassify ERBB2 unamplified breast cancer. Lab Invest. 2022 May 20.
* 本文由阿斯利康提供支持,仅供医疗专业人士参考
审批编号:CN-102687
有效期至:2023-9-19
查看更多