查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)是指肝内二级胆管至肝内最小胆管分支的衬覆上皮及其胆管周腺体发生的恶性肿瘤,并表达胆管细胞标志物。
ICC占原发性肝癌的10%~20%,占胆管癌的20%~30%。近30年肝内胆管癌的发病率在全世界范围内呈明显上升趋势。肝内胆管癌发病隐匿,极易侵犯肝脏周围器官、组织和神经,发生淋巴结和肝外远处转移,大部分病人确诊时通常已处于晚期,缺乏有效治疗方法。对于部分早期肝内胆管癌病人,肝切除治疗已获得广泛肯定。然而,即使行根治性切除术,肝内胆管癌术后仍然极易复发和转移,病人术后5年总体生存率为25%~40%,预后远差于肝细胞癌。因此,ICC的转移机制及治疗新靶点研究显得极为必要。
近日,上海东方肝胆外科医院王葵/沈锋教授团队在Hepatology(IF:15.8)发表《肝内胆管癌肿瘤微环境异质性及进展机制的单细胞与空间转录组研究》的重要成果。
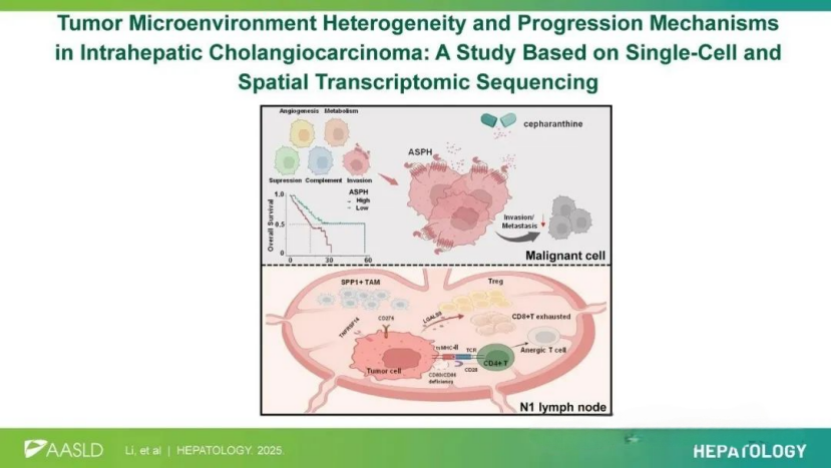
研究通过整合初治ICC患者的单细胞测序(scRNA-seq)、空间转录组(ST)及RNA-seq数据,结合多重免疫荧光与小鼠模型验证,首次揭示:
① ICC细胞存在5种功能亚型,其中侵袭亚型高表达天冬氨酸β-羟化酶(ASPH)驱动转移;
② cepharanthine作为新型ASPH抑制剂显著抑制肿瘤进展;
③ 淋巴结转移灶中肿瘤细胞通过MHC-II高表达但缺失CD80/CD86共刺激因子,从而诱导CD4⁺T细胞失能进,通过此“诱饵机制”促进肿瘤细胞在淋巴结中的免疫逃逸。
该研究通过多组学整合分析,阐明了ICC淋巴转移的ASPH驱动机制与免疫逃逸新路径,确证了cepharanthine作为靶向治疗药物的潜力,为ICC患者提供了“精准分型-靶向干预-免疫重塑”的综合治疗框架。
此外,研究通过揭示ASPH在ICC侵袭中的作用及其抑制剂的治疗潜力,以及ICC细胞在淋巴结中通过MHC-Ⅱ分子诱导免疫逃逸的机制,本研究为改善ICC患者的预后提供了新的方向。未来的研究可以进一步探索这些靶点在不同分子亚型ICC患者中的普适性,并开发基于这些发现的新疗法。
肝外二科主任,主任医师、教授、博士生导师。擅长综合应用外科手术等多种治疗方式提高肝癌患者的生存率和生活质量。获得上海市科技进步奖一等奖、上海市医学科技二等奖、上海市三八红旗手、第八届吴孟超青年医学基金奖、首届人民好医生“金山茶花”杰出贡献奖、“国之名医”等荣誉。获得专利授权5项。主持国家科技重大专项基金子课题、国家自然科学基金、军队人才计划、上海市等十余项省部级课题,先后获得科研经费1000余万元。以第一/通讯作者(含并列)在J Hepatol、Theranostics、Hepatology等杂志上发表SCI论著和综述40余篇。担任中国抗癌协会肝癌专业委员会常委、CSCO肝癌/放射介入专委会常委、上海市医学会普外科专科分会委员兼秘书及肝脏外科学组组长。
来源:上海东方肝胆外科医院
查看更多