查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





对于局部晚期食管癌,术前新辅助化疗/放化疗可以有效降低肿瘤分期,提高根治性手术切除率(R0),延长术后生存时间,因此在国内外食管癌治疗中均备受重视。但关于新辅助治疗疗效的判断,一直存在较大的争议,现有的PET-CT和超声胃镜等,对于新辅助治疗后的再分期准确性均在50%-60%以下,不能满足临床的需要。病理分期是评估食管癌新辅助治疗疗效的金标准,但仍欠全面和一致性。一篇发表在Annals of surgery 上的文章[1]详细总结了151名潜在可切除的 (T1N+/ T2-T4aN0-3/ M0) 局晚期食管癌患者的病理资料,发现全组患者中疗效达到pCR的DFS生存数据为最好,而新辅助治疗后N+对患者DFS有负面影响,肉眼残留肿瘤患者的DFS则明显比外膜中仅有镜下残留的患者更差。

张百华 教授
◆ 湖南省肿瘤医院胸外科副主任
◆ 医学博士,2018年美国MD Anderson访问学者
◆ 湖南省抗癌协会肿瘤腔镜微创治疗专业委员会秘书
◆ 湖南省抗癌协会食管癌专业委员会委员
◆ 世界华人肿瘤医师协会胸外科分会青年委员
◆ 海峡两岸医药交流协会胸外科分会委员
◆ 担任《中国普通外科杂志》、《中国胸心血管外科临床杂志》青年编委,《Journal of Thoracic Disease》杂志审稿人。
◆ 在SCI、中华级杂志发表第一作者论文10余篇,主持省级课题2项,吴阶平基金1项,参与国家级课题2项
研究方法
作者团队回顾性总结151名潜在可切除的 (T1N+/ T2-T4aN0-3/ M0) 局晚期食管癌患者的病理资料,这些患者在2009年10月至2018年3月期间在Groningen大学医学中心接受了新辅助放化疗+根治性手术。新辅助放化疗方案:紫杉醇:50mg/m2 d1,8,15,22,29 +卡铂: AUC2,d1,8,15,22,29 + 同步放疗: 41.4 Gy/23次,新辅助放化疗完成后6至10周进行经胸开放或微创食管切除术以及二野淋巴结清扫术。由2名经验丰富的胃肠道病理学家盲态下对手术标本进行病理评估,使用Mandard肿瘤消退等级(TRG)系统评估新辅助放化疗的反应程度。
研究结果
患者多为男性(78.8%),中位年龄为66岁;R0切除率达到90%(136/151),其中pCR率达19.8%(27/136),pNR(TRG 4-5)率为14%(19/136),pPR(TRG 2-3)率为66.2%(90/136);pCR 病理完全缓解(ypT0N0),即Mandard TRG1达到17.9%(27/151)肿瘤残留部位多见于外膜层37.7%(57/151),见表1。
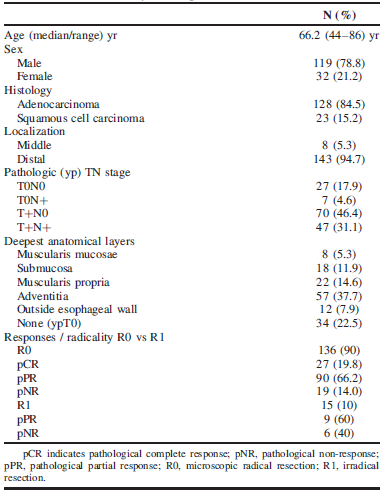
表1:新辅助放化疗后患者及其肿瘤特征
90例pPR患者中,仅在食管壁(ypT+N0)中发现残留肿瘤的比例为58.9%,仅在淋巴结中(ypT0N +)的比例为7.8%。pPR中最常见的解剖部位是外膜占38.9%,黏膜肌层(ypT1a)和黏膜下层(ypT1b)分别为7.8%和18.9%,见表2。
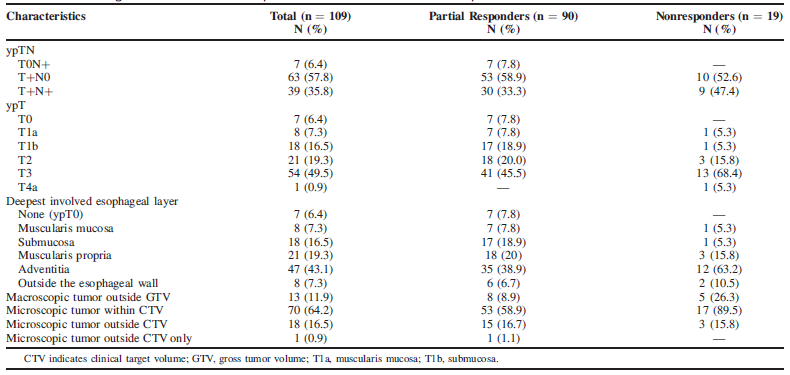
表2:R0切除标本中残留病灶在食管壁的分布
在pPR(TRG 2-3,n = 90)中,肿瘤靶体积(GTV)内、外的肉眼残留率分别为33.3%(n = 30)和8.9%(n = 8),而临床靶体积(CTV)内、外的镜下残留率分别为58.9%(n = 53)和16.7%(n = 15);在pNR(TRG 4-5,n=19)中残留率很高,GTV内的肉眼残留率为42.1%(n = 8),CTV内的镜下残留率为89.5%(n = 17),见表3。
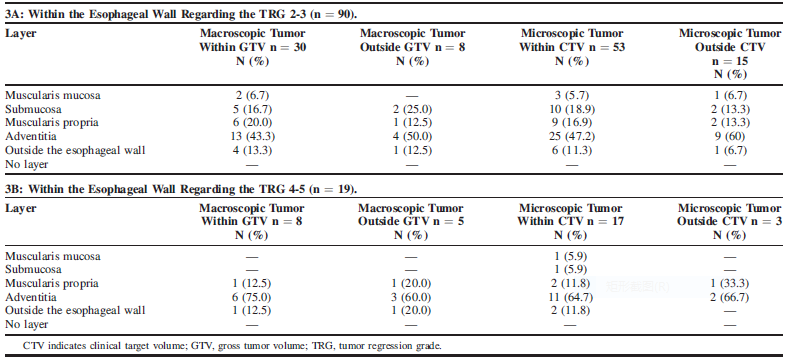
表3:R0切除标本中残留病灶在GTV / CTV的分布
R0切除标本中共46个(42.2%)观察到有淋巴结残留(ypT0N + / ypT + N +),有7个(6.4%)的残留病灶出现在CTV外。pPR中发现37个(41%)淋巴结残留,ypN1为72.9%(n = 27)、 ypN2 为24.3%。pPR中有24个有明确的残留病灶定位,GTV中的占37.5%(n = 9),而CTV中占33.3%(n = 8);pNR中CTV和GTV之间淋巴结残留分布均匀。见表4。
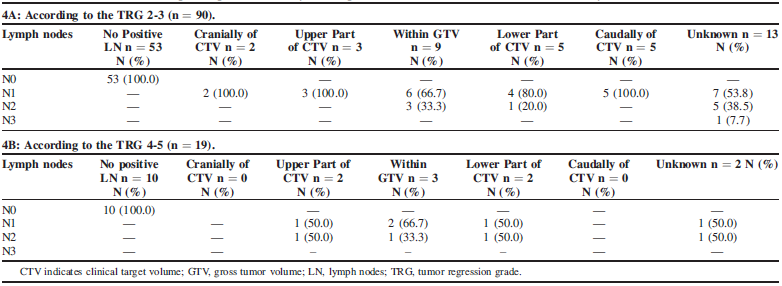
表4:R0切除标本中残留病灶在淋巴结和放疗区域的分布
手术后生存时间超过90天的整个组(R0和R1切除)的中位DFS为33(20-45)个月。食管壁浅表层肿瘤残留(ypT0-1N+)(44个月)或ypT1-4aN0(33个月)的患者的中位DFS比深层肿瘤残留的患者(ypT2-4aN+)(18个月)更好(P = 0.002)。DFS还与TRG 1-5(n = 143)肿瘤残留的解剖层有关,包括肌层黏膜,黏膜下层,固有肌层和外膜(中位DFS:16-29个月; P = 0.028)。见图1。
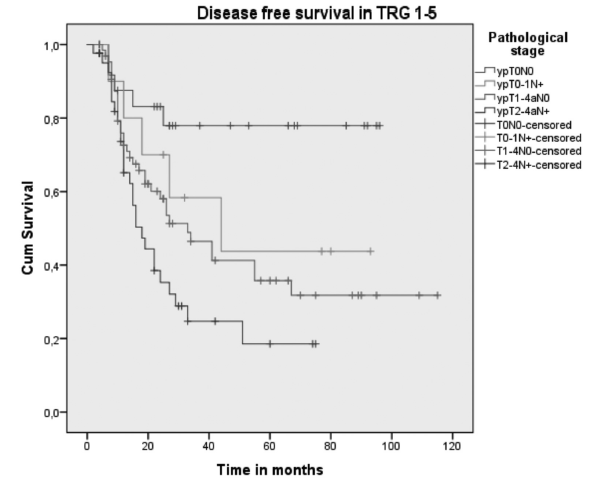
图1:所有患者(TRG1-5)的DFS
TRG2-5(n = 118)中,中位DFS为26(19-32)个月。与仅有镜下残留病灶的患者相比,肉眼残留病灶的患者的DFS明显较差(16 vs 33个月; P = 0.022)。R0患者中,与仅在外膜有镜下残留的患者相比,外膜有肉眼残留的患者的DFS显著降低(平均DFS:14个月vs 51个月;P = 0.039)。TRG2-5患者(n = 118)经组织病理学证实GTV外有肉眼残留(n = 15)的DFS更差(9个月vs 27个月;P = 0.009)。见图2。
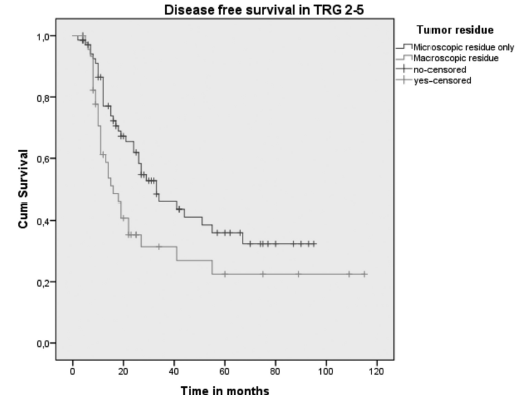
图2:pPR和pNR患者(TRG2-5)的DFS
专家观点
本研究从病理学角度对食管癌新辅助放化疗疗效进行评价,研究数据非常详细,且有几个比较有意思的发现,值得我们在相关研究中进行借鉴。
首先,本研究中R0切除患者的pCR率仅为19.8%,与CROSS研究和NEOCRTEC5010研究[2]中的23%-49%有一定差别,但考虑到本研究中84.5%的患者为食管腺癌,这与CROSS研究中食管腺癌的pCR率23%差距不大。生存结果显示新辅助放化疗达到pCR的食管癌患者似乎比有残留肿瘤的患者有更好的长期预后,且局部复发率更低。因而,对于这一部分患者,是 “观察与等待”还是积极手术,目前仍没有定论。“观察与等待”的最大优势在于保留了食管的正常结构和功能,也避免了手术相关的并发症和由此导致的死亡风险,但目前最大的困难仍在于临床缺少判断cCR的可靠方法,有研究[3]显示现有临床手段判断为cCR的患者中有超过1/3仍然有肿瘤细胞残留,因而准确的临床分期是采取“观察与等待”策略的必备条件。在已开展的大规模前瞻性临床研究ESOSTRATE和SANO研究[4]中,均采取定期进行内镜和PET-CT检查的方式对cCR患者观察,一旦发现可疑病变立即进行手术治疗,我们期待着这些研究能一定程度上回答“是观察与等待还是积极手术”这一疑问。
其次,值得关注的是,本研究发现食管壁肿瘤原发灶达CR的患者有较高的淋巴结转移率(ypT0N+)(6.4%;n = 7),与文献[2, 5]中2.9%-14.6%的发生率一致,这提示我们,食管癌原发灶达到CR的患者中,仍有一定比例的淋巴结肿瘤残留,在术前进行疗效评价时同样需要特别注意对于淋巴结疗效的判断,依靠单一的超声胃镜不能轻易下cCR的结论,还需要联合其他检查比如PET-CT等进行综合判断,以有效降低漏诊率。在Heneghan等[6]的研究中,在138例食管癌新辅助放化疗结束后4-6周行PET-CT和超声胃镜检查,最大SUV值<4且无淋巴结摄取为完全代谢缓解,内镜下无残留黏膜异常为完全内镜缓解,PETCT联合内镜均诊断为完全缓解定义为临床完全缓解(cCR),发现三组对于pCR的预测敏感性和特异性分别为55.9%和57.7%、40.7%和62.7%、32.4%和80.8%,提示PET-CT和超声胃镜联合检查对食管癌新辅助放化疗疗效预测的特异性更好。其次,在cCR患者的根治性食管癌切除术中,淋巴结的清扫同样重要,不能因为原发灶退缩明显而忽视对于区域淋巴结的清扫。还有荟萃分析[7] [纳入8项研究(n = 837)] 显示,ypT0N+患者的局部和远处复发率均很高,3年和5年DFS和总体生存率(OS)均显著下降。
再者,本研究发现R0切除者中食管壁残留病灶最常见于肌肉层之外(65.6%),尤其是外膜层(45.6%),而黏膜(ypT1a)和黏膜下层(ypT1b)分别为7.3%和16.5%。有研究[8]显示这也可能与肿瘤组织学类型有关,食管鳞状细胞癌更倾向于在浅表层残留,而腺癌更倾向于在肌肉层和外膜层以外残留。而DFS还与肿瘤残留的解剖层次有关,包括黏膜肌层、黏膜下层、固有肌层和外膜(中位DFS:16-29个月; P = 0.028)。这提示我们在制定食管癌新辅助放化疗后临床再分期策略时,对于不同的病理类型,观察的重点可能会有所差别,比如食管腺癌,更应当注意食管壁肌层和外膜层病变的退缩情况。
最后,研究还显示食管壁浅表层肿瘤残留(ypT0-1N+)或ypT1-4aN0患者的中位DFS分别为44、33月,均比深层肿瘤残留患者(ypT2-4aN+)的18月更好(P = 0.002)。这与以往的一些研究结果一致。
总之,关于食管癌新辅助放化疗疗效预测手段和分子标志物尚有巨大探索空间,尤其随着新辅助免疫治疗的加入,如何更精准地预测疗效和副反应成为了迫在眉睫需要解决的问题。本研究从病理学角度进行详细的回顾性分析,纳入的病例数量较多,为临床制定食管癌新辅助放化疗疗效判断策略提供了有力的参考。不足之处在于本研究为单中心的回顾性研究,研究结论有待进一步验证;其次,病例中大多数为食管下段腺癌,而国内以食管中段鳞癌为主,两者对新辅助放化疗的病理反应方面可能存在一定差异,因而尚有待进一步研究。
参考文献:(滑动查看所有文献)
1. Zohra Faiz., et al.,Locoregional Residual Esophageal Cancer after Neo-adjuvant Chemoradiotherapy and Surgery Regarding Anatomic Site and Radiation Target Fields:A Histopathologic Evaluation Study. Annals of surgery.2020 Jul 24.
2. Yang, H., et al., Neoadjuvant Chemoradiotherapy Followed by Surgery Versus Surgery Alone for Locally Advanced Squamous Cell Carcinoma of the Esophagus (NEOCRTEC5010): A Phase III Multicenter, Randomized, Open-Label Clinical Trial. 2018. 36(27): p. 2796-2803.
3. Piessen, G., et al., Is there a role for surgery for patients with a complete clinical response after chemoradiation for esophageal cancer? An intention-to-treat case-control study. 2013. 258(5): p. 793-9; discussion 799-800.
4. Noordman, B., et al., Neoadjuvant chemoradiotherapy plus surgery versus active surveillance for oesophageal cancer: a stepped-wedge cluster randomised trial. 2018. 18(1): p. 142.
5. Shapiro, J., et al., Residual esophageal cancer after neoadjuvant chemoradiotherapy frequently involves the mucosa and submucosa. 2013. 258(5): p. 678-88; discussion 688-9.
6. Heneghan, H., et al., Can CT-PET and Endoscopic Assessment Post-Neoadjuvant Chemoradiotherapy Predict Residual Disease in Esophageal Cancer? 2016. 264(5): p. 831-838.
7. Lv, H., et al., Remnant lymph node metastases after neoadjuvant therapy and surgery in patients with pathologic T0 esophageal carcinoma impact on prognosis: A systematic review and meta-analysis. 2017. 96(26): p. e7342.
8. Mandard, A., et al., Pathologic assessment of tumor regression after preoperative chemoradiotherapy of esophageal carcinoma. Clinicopathologic correlations. 1994. 73(11): p. 2680-6.
审批号:MI-PD1-1717-CN
本资讯由默沙东医学团队提供,旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
转载来自医默相通
查看更多