查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






第62届欧洲肾脏病协会年会(ERA2025)于 6月4—7日于奥地利维也纳召开,本次会议围绕“肾脏病学领域的革新力量(Game Changers in Nephrology)”这一主题展开,并以“Beyond Nephrology”为口号。
本次大会评选出了 TOP 10 研究,中国医学论坛报特邀东部战区总医院 国家肾脏疾病临床医学研究中心 刘志红院士团队,对TOP 10 研究进行深入解读。
作者:东部战区总医院 国家肾脏疾病临床医学研究中心 董建华

常染色体显性多囊肾病(ADPKD)是导致终末期肾脏病的最常见的遗传性疾病。妊娠相关血浆蛋白A(PAPP-A)和胰岛素样生长因子(IGF)信号通路已被证实与ADPKD的发病机制相关,以PAPP作为治疗靶点可能延缓ADPKD病情进展。2025年6月5日,第62届欧洲肾脏病协会年会(ERA2025)公布了一项来自美国Calico Life Sciences的关于一种新型抗PAPP-A抗体治疗ADPKD的研究,旨在评估其在ADPKD临床前模型中的治疗潜力。

ABBV-CLS-628是一种人源单克隆IgG1单克隆抗体,该抗体能够与PAPP-A结合并中和其蛋白水解活性。通过表面等离子体共振(SPR)和体外效价实验对ABBV-CLS-628进行表征,并制备了ABBV-CLS-628的小鼠嵌合抗体(抗PAPP-A抗体)。
三种不同的ADPKD小鼠模型,pcy(快速进展的非同源疾病模型) 、Pkd1fl/flPax8rtTA TetO-Cre(Pkd1fl/fl,可诱导且快速进展的疾病模型)以及Pkd1RC/RC (缓慢进展的同源疾病模型)。
通过监测肾脏总体积(TKV,MRI测量)和肾功能(MediBeacon® tGFR经皮肾小球滤过率测量)评估抗PAPP-A抗体的疗效。Pcy、Pkd1fl/fl和Pkd1RC/RC模型小鼠每周接受一次抗PAPP-A抗体或同型对照抗体治疗,分别持续22周、12周和62周。

研究显示,ABBV-CLS-628与PAPP-A高亲和力结合,并在体外抑制其底物IGFBP-2、IGFBP-4和IGFBP-5裂解,从而抑制IGF信号通路。
在ADPKD小鼠模型中,与同型对照相比,抗PAPP-A治疗显著抑制了TKV增大,Pcy、Pkd1fl/fl和Pkd1RC/RC模型小鼠TKV分别减少了480 mm3(52%)、1436 mm3(62%)和164 mm3(45%)(图1)。
图1 在三种ADPKD小鼠模型中,抗PAPP-A治疗与对照相比,总肾脏体积(TKV)增大的平均减少量
抗PAPP-A治疗对TKV变化的影响与肾功能下降改善和生存率提高相关。肾脏组织的转录组学分析显示,与同型对照相比,抗PAPP-A治疗对三种ADPKD小鼠模型中的ADPKD相关通路进行了调控(例如氧化磷酸化和TGF-β信号传导)(图2)。
图2 在人类ADPKD肾脏(第1列)和小鼠疾病模型(第2列和第3列)中富集的标志性基因集。与同型对照相比,抗PAPP-A治疗的小鼠肾脏中基因集逆向调节(第4-6列)
ABBV-CLS-628是一种新型人源单克隆抗体,可作为PAPP-A的特异性强效抑制剂。抗 PAPP-A治疗在三种不同的ADPKD小鼠模型中均显著改善了TKV和GFR,并调节了疾病相关通路。ABBV-CLS-628目前正处于ADPKD治疗的临床开发阶段。

ADPKD主要由PKD1和PKD2基因突变引起。肾小管上皮细胞的过度增殖导致囊肿形成,囊肿扩张最终导致肾脏增大和ESRD。虽然托伐普坦已用于延缓ADPKD进展,但其副作用限制了其临床应用。
目前ADPKD治疗策略仍以支持性治疗为主。多种信号通路参与ADPKD的发病和进展,包括cAMP、MAPK/ERK、mTOR、AMPK和生长因子通路。因此,深入研究肾囊肿形成和囊肿扩张的分子机制,对于制定新的ADPKD治疗策略至关重要。
约80%的ADPKD患者由PKD1基因突变引起,15%由PKD2突变引起。患者通常携带PKD1或PKD2的一个等位基因的种系突变,需要另一个野生型等位基因的体细胞失活或杂合性缺失才能启动囊肿形成。多囊蛋白复合物参与调节Ca2+、cAMP和mTOR等多种信号级联成分,其功能缺失导致细胞自主性肾小管上皮细胞囊肿形成。肾小管上皮细胞中Ca2+内流减少、cAMP水平升高以及MAPK/ERK通路异常激活是囊肿生长和扩张的关键。肾脏囊肿扩张过程涉及细胞增殖失调,生长因子通路参与ADPKD发病,尤其是IGF-1信号通路。
IGF-1与IGF-1受体(IGF-1R)结合后激活PI3K-Akt和MAPK通路,调控细胞代谢和增殖,参与ADPKD发病机制。IGF结合蛋白(IGFBP)通过结合IGF-1,抑制其与IGF-1R结合发挥调节作用。
PAPP-A具有蛋白水解活性,能水解IGFBP-4,使与IGFBP-4结合的IGF-1解离,具有生物活性的IGF-1与其受体作用并触发下游信号通路,提高了局部IGF-1的生物利用度。PAPP-A不是IGF-1信号通路的直接抑制剂,通过水解IGFBP-4调节IGF-1信号通路,在组织局部发挥作用(图3)。
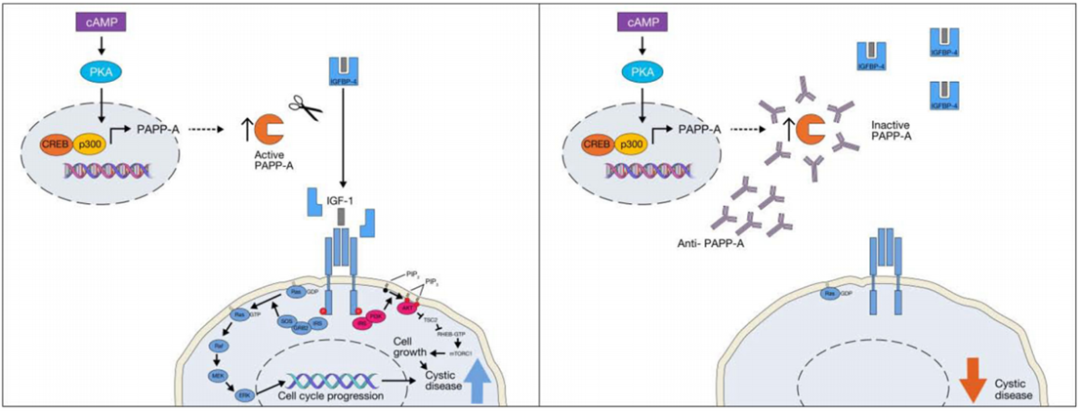
图3 PAPP-A在ADPKD发病中的作用
PAPP-A在ADPKD发病机制中发挥核心作用。在ADPKD模型小鼠(Pkd1RC/RC)肾脏中,IGF-1通路多个基因表达上调,其中PAPP-A表达增加最为显著,在其他模型小鼠中也观察到肾脏PAPP-A表达增加。PAPP-A表达与囊肿指数和肾脏大小呈正相关,PAPP-A水平随疾病进展而升高。
与正常肾脏相比,ADPKD患者囊液中PAPP-A含量显著升高,肾脏组织囊性上皮细胞中PAPP-A表达更显著,而且囊性上皮细胞PAPP-A表达高于正常肾皮质小管上皮细胞。
在ADPKD中,PAPP-A通过cAMP通路诱导表达,通过PKA/CREB/CBP/p300通路激活PAPP-A转录。PAPP-A基因缺失能有效抑制Pkd1RC/RC模型小鼠肾脏囊肿形成, 并显著改善肾脏损伤、炎症和纤维化,即使是PAPP-A基因单拷贝缺失,也能改善ADPKD小鼠囊性病变、肾小球滤过率和存活率,证实了PAPP-A在ADPKD发病机制中的作用。
PAPP-A缺失导致IFG-1下游信号通路成分(如ERK、Akt和PCNA)表达降低,同时诱导AMPK表达,血循环中IFG水平没有差异。PAPP-A在ADPKD中发挥作用,主要通过调控IGF-1通路和促进细胞增殖实现。
单克隆抗体阻断PAPP-A对IGFBP4的蛋白水解活性,可在体内(Pkd1RC/RC模型小鼠)和体外(胚胎肾脏)显著缓解ADPKD肾囊肿负荷。PAPP-A/IGF-1通路在ADPKD疾病发生和进展中发挥重要作用,为ADPKD治疗提供了新的靶点。
PAPP-A是一种胞外酶,可以通过特异性抗克隆抗体靶向抑制其蛋白水解活性。抑制PAPP-A不会直接抑制IGF-1/IGF1R信号转导,但会限制IGF组织特异性生物利用度。本研究证实了抗PAPP-A抗体能有效抑制肾囊肿增大,改善肾脏功能,为ADPKD患者治疗提供了可行性手段,期待药物的进一步研发和转化。
查看更多