查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





点击图片查看更多精彩内容
近期,欧洲药品管理局(EMA)网站就伊布替尼(Ibrutinib,商品名:亿珂/Imbruvica)的严重心脏事件及新的风险最小化措施发布了致医务人员函(direct healthcare professional communications, DHPC)。
内容摘要
· 伊布替尼增加致命的严重心律失常和心力衰竭风险。
· 高龄、东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)体能状况评分≥2或有心脏并发症的患者,发生包括心源性猝死在内的严重心脏事件的风险更高。
在启动伊布替尼治疗前,应对患者的心脏病史和心功能进行临床评估。
对于具有心脏事件危险因素的患者,启动伊布替尼治疗前应评估获益及风险;可以考虑使用替代药物。
用药期间,应密切监测患者是否有心功能恶化的迹象,一旦出现,应予临床干预。
出现任何新发的或恶化的2级心力衰竭或3级心律失常,应暂停使用伊布替尼。恢复治疗时应根据后文所述方案调节剂量。
背景信息
伊布替尼的获批适应证包括:
· 单独用于复发或难治性套细胞淋巴瘤(mantle cell lymphoma, MCL)成年患者的治疗;
· 单独用药或与利妥昔单抗或奥妥珠单抗或维奈克拉联合用药,用于既往未经治疗的慢性淋巴细胞白血病(chronic lymphocytic leukemia, CLL)成年患者的治疗;
· 单独用药或与苯达莫司汀及利妥昔单抗(BR)联合用药,用于既往接受过至少1次治疗的CLL成年患者的治疗;
· 单独用于既往接受过至少1次治疗的华氏巨球蛋白血症(WaldenstrÖm’s macroglobulinemia, WM)成年患者的治疗,或作为不宜进行化疗的WM患者的一线治疗。伊布替尼与利妥昔单抗联合用于WM成年患者的治疗。
随机临床试验(randomised clinical trials, RCT)汇总数据显示,伊布替尼组心源性猝死、猝死、心源性死亡的粗发生率(11例,0.48%)是对照组(2例,0.10%)的近5倍。校正暴露量后,心源性猝死、猝死、心源性死亡的发生率(EAIR,用发生事件的观察对象数除以具有风险的患者人月数进行计算),伊布替尼组(0.0002)是对照组(0.0001)的2倍。
基于对现有的伊布替尼心脏毒性证据的评估,在产品信息中纳入了进一步的心脏风险最小化措施。高龄、ECOG体能状况评分≥2或有心脏并发症的患者,发生包括心源性猝死在内的严重心脏事件的风险更高。
启动伊布替尼治疗前,应进行适当的心脏病史和心功能临床评估。用药期间,应密切监测患者是否有心功能恶化的迹象,一旦出现,应予临床干预。对于有心血管问题的患者,考虑行进一步的评估(如心电图、超声心动图)。
对于具有心脏事件危险因素的患者,启动伊布替尼治疗前审慎评估获益/风险,可以考虑使用替代药物。
伊布替尼产品特性概要(SmPC)的4.4节已进行了相应更新,并在4.8节增加“心脏停搏(cardiac arrest)”不良反应。
此外,上市许可持有人还审查了经历3+级心脏事件的患者的临床数据,评估事件发生后,减少伊布替尼剂量的患者与未减量者的心脏事件复发率。分析显示,减量者的复发率低于未减量者。
在此基础上,欧盟SmPC的4.2节进行了如下更新:
出现任何新发的或恶化的2级心力衰竭或3级心律失常,应暂停使用伊布替尼。当毒性症状缓解至1级或基线水平(恢复)后,按照下表的推荐剂量恢复用药。
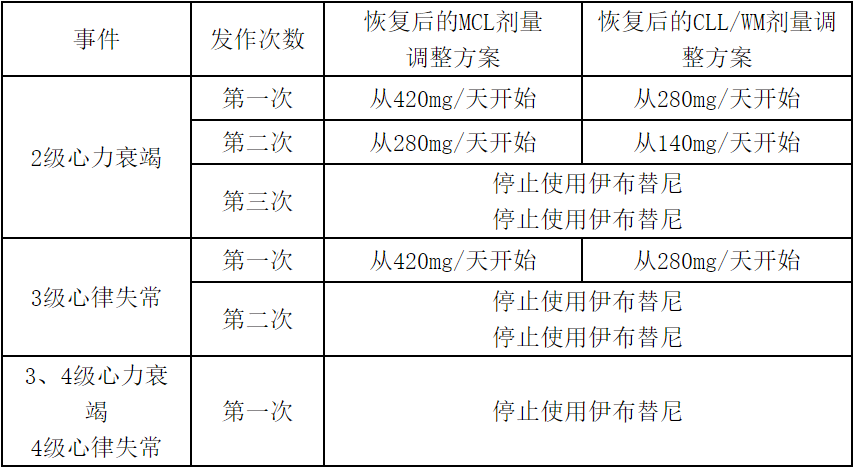
重新使用伊布替尼前,进行获益-风险评估。
对于非心脏事件(≥3级非血液学毒性,≥3级中性粒细胞减少伴感染或发热,或≥4级血液学毒性)的剂量调整方案基本保持不变,在表格下增加了一条脚注:“恢复用药时,根据获益-风险评估按原剂量或减量用药。如果毒性事件再次发生,则日剂量减少140mg。”
鼓励报告
医务人员应通过国家自发报告系统,报告所有与使用伊布替尼有关的疑似不良反应。
来源:国家药品监督管理局

查看更多