查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





世界卫生组织已宣布细菌耐药是全球公共卫生的头号威胁。多重耐药菌 (MDRO) 感染的治疗选择有限,特别是由碳青霉烯类耐药肠杆菌目细菌、产超广谱β-内酰胺酶的肠杆菌目细菌、碳青霉烯类耐药铜绿假单胞菌和鲍曼不动杆菌引起的感染。迫切需要非碳青霉烯类的抗生素,因为对此类抗生素的耐药越来越普遍。头孢地尔是一种新型的可注射铁载体头孢菌素,专为治疗MDRO感染而开发。通过“劫持”细菌的铁转运途径促进细胞摄入从而实现高周质浓度,其对革兰阴性菌(包括多重耐药病原菌)具有广谱体外抗菌活性。美国食品与药物管理局批准该药用于复杂性尿路感染和医院获得性肺炎的治疗。
《临床感染性疾病》(Clinical Infectious Diseases)在2021年9月发表了一篇综述,总结了现有的体外和临床数据,包括来自2个Ⅲ期临床试验(APEKS-NP和CREDIBLE-CR)的最新证据,并讨论了头孢地尔治疗MDR革兰阴性菌感染的临床地位。
头孢地尔包含一个头孢菌素核心以及2个类似于头孢他啶和头孢吡肟的侧链(图1)。C-7侧链具有氨基噻唑环和羧丙基-氧亚胺基(图1),两者都改善了其对革兰阴性菌外膜的跨膜转运,并赋予了其对几种β-内酰胺酶水解的稳定性。C-3侧链有一个吡咯烷基,通过赋予其两性离子特质来增强其水溶性。
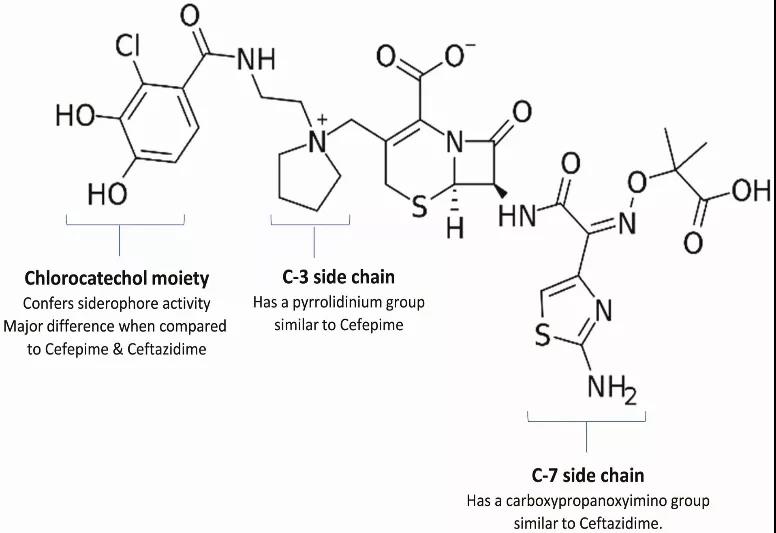
图1 头孢地尔的抗菌活性部分归功于其化学结构
C-3位的儿茶酚部分将头孢地尔与头孢吡肟和头孢他啶区分开,并通过铁载体发挥作用,螯合细胞外铁,形成头孢地尔-铁复合物。因此,虽然头孢地尔与其他β-内酰胺类药物一样,通过孔蛋白被动扩散穿过细胞外膜,但它也能通过铁摄取系统主动转运到微生物中。一旦头孢地尔被转运到胞外间质,它就会与铁离子分离并结合青霉素结合蛋白 (PBP),主要是PBP3,以抑制肽聚糖的合成,导致细胞死亡。头孢地尔对多重耐药革兰阴性菌的强大抗菌活性至少部分是由于其能够克服由孔蛋白突变导致的细菌耐药,并通过主动转运使其在胞外间质达到高浓度。其他原因包括它对PBP3的高亲和力,相对不明显的外排泵表达增加,以及对多种β-内酰胺水解酶的抗性,包括对大多数丝氨酸碳青霉烯酶和一些金属β-内酰胺酶的耐受——这可能取决于它的C-3侧链。头孢地尔对革兰阳性菌和厌氧菌没有显著抗菌活性(后者生长对铁载体转运系统的依赖性较小)。
两项大型研究——SIDERO 2014和SIDERO 2015,证实了头孢地尔对革兰阴性杆菌强效的体外广谱抗菌活性,包括对美罗培南不敏感的肠杆菌目分离株、铜绿假单胞菌和鲍曼不动杆菌。在18 000多株革兰阴性杆菌分离株中,累计超过99%显示头孢地尔MIC < 4 µg/ml。此外,SIDERO 2015进一步证明,头孢地尔对头孢他啶-阿维巴坦和头孢洛扎-他唑巴坦不敏感的肠杆菌目和假单胞菌分离株保持体外抗菌活性,其MIC 90均< 4 µg/ml。尽管头孢地尔具有固有的β-内酰胺酶抗性(L1金属-β-内酰胺酶和L2丝氨酸-β-内酰胺酶),它对嗜麦芽窄食单胞菌也表现出体外抗菌活性。有限的数据表明,头孢地尔可能对某些洋葱伯克霍尔德菌分离株有效。根据β-内酰胺酶分层的头孢地尔耐药头孢地尔对多重耐药肠杆菌目细菌、铜绿假单胞菌和鲍曼不动杆菌的体外抗菌活性已根据β-内酰胺酶的Ambler分类进行了进一步表征。在肠杆菌目中,耐药性没有因物种而异。总体而言,头孢地尔对产生丝氨酸-β-内酰胺酶、头孢菌素酶和苯唑西林酶的肠杆菌目、假单胞菌属和不动杆菌属分离株保持强效抗菌活性。然而,尽管头孢地尔在大多数金属-β-内酰胺酶存在的情况下仍具有抗菌活性,但体外数据表明其对产生新德里金属-β-内酰胺酶(NDM)的分离株的抗菌活性降低。描述头孢地尔在NDM酶存在下抗菌活性的数据主要局限于肠杆菌目分离株。在这些研究中,头孢地尔MIC值不固定,并且这些产生NDM的分离株中有很大一部分对头孢地尔不敏感。类似地,更有限的数据证明了头孢地尔对产NDM假单胞菌和不动杆菌分离株具有较宽的MIC范围和不同体外抗菌活性。这些数据提示,在使用头孢地尔单药治疗由产NDM微生物引起的感染之前,药敏试验很重要。来自6项研究的体外试验数据表明,头孢地尔确实对大多数产非NDM-内酰胺酶的肠杆菌目、假单胞菌和不动杆菌分离株保持抗菌活性。然而,有报道称头孢地尔在Ambler分类或β-内酰胺酶中的效价降低且没有明确的模式。例如,在产丝氨酸-β-内酰胺酶的肠杆菌目分离株中,MIC范围较宽。此外,一项大型研究表明,在不同肺炎克雷伯菌碳青霉烯酶 (KPC) 亚型内和之间,头孢地尔对其效价不同。β-内酰胺酶内和之间这些不一致的耐药模式表明头孢地尔耐药不完全由β-内酰胺酶的存在决定。尽管数据有限,但有研究已开始揭露头孢地尔耐药的机制。尽管头孢地尔耐药似乎不是仅由β-内酰胺酶引起(潜在例外是产NDM菌株),但一些研究表明,头孢地尔的抗菌活性可能会通过添加β-内酰胺酶抑制剂来增强。这些数据表明头孢地尔耐药可能是由多种耐药机制介导的,加入β-内酰胺酶抑制剂可能足以恢复该药对其中一些机制的活性。提出的其他头孢地尔耐药机制包括铁转运通道的突变,这阻碍了头孢地尔进入细菌的新型机制。与其他革兰阴性杆菌不同,头孢地尔耐药似乎不是由孔蛋白和外排泵突变介导的。为了进一步明确头孢地尔耐药的细微差别,未来的研究应特别关注NDM酶和耐药机制的组合,包括β-内酰胺酶和铁转运突变。
动物研究与其他头孢菌素类药物相似,时间依赖性杀伤是对头孢地尔抗菌活性的最好描述,与1小时输注相比,头孢地尔延长3小时输注会增强其抗菌作用。在小鼠大腿中暴露与人体剂量相当的头孢地尔(相当于每8小时静脉输注2 g,输注3小时)诱导细菌停滞或大多数MIC < 4 µg/ml的革兰阴性杆菌的细菌菌落形成单位减少> 1 log 10;然而对于MIC > 8 µg/ml的分离株而言,达到目标的可能性显著降低。这些体内研究证明了头孢地尔的有效性,并支持将MIC为4 µg/ml作为肠杆菌目、假单胞菌、不动杆菌和窄养单胞菌的药敏折点。此外,体内研究表明重复给药与头孢地尔耐药的发展无关,但这些动物研究的结果需要与临床试验数据相结合。临床研究头孢地尔表现出线性动力学特征。它主要通过肾脏排泄,未表现出明显的肝脏代谢。肾损害需要调整剂量,但肝损害不需要。早期的人体药代动力学研究支持使用头孢地尔治疗肺部、尿路感染和可能的血流感染。Ⅰ期临床研究表明,头孢地尔在肺内可达到与血浆浓度相似的浓度。在复杂性尿路感染(cUTI)和无并发症肾盂肾炎的Ⅱ期研究显示,感染后药物清除率随之略有增加,但头孢地尔的血浆浓度仍足以治疗cUTI。规模最大的一项研究使用了从516名患者中收集的血浆头孢地尔浓度,包括健康志愿者和参加临床试验的患者,以建立群体药代动力学模型。肾功能是模型中最重要的变量。该模型分析表明,无论感染部位在何处,MIC< 4的革兰阴性菌分离株达到治疗目标的可能性> 95%(高于MIC的时间为75%)。该模型预测,对于肺炎和cUTI的MIC < 4的分离株,达到治疗目标的可能性> 90%(高于MIC的时间为100%),但对于血流感染(BSI)则下降到85%。目前还没有关于脑脊液渗透的数据。
对于肾功能正常的患者,推荐的头孢地尔给药剂量为2 g,每8小时静脉给药持续3小时以上。间歇性血液透析可以去除高达60%的头孢地尔,因此在血液透析后补充头孢地尔剂量可能有效。目前,尚无对于肥胖患者基于体重的给药剂量推荐,也没有关于脑脊液渗透的数据。由于给药方案复杂以及在疾病状态下的药代动力学数据较少,治疗药物监测可能会有所帮助。
复杂性尿路感染APEKS-cUTI研究是一项Ⅱ期、多中心、双盲、平行组非劣效性试验,评估了头孢地尔与亚胺培南-西司他丁对cUTI的疗效。患者随机接受头孢地尔(2 g)或亚胺培南-西司他丁(1 g),每8小时静脉输注1小时,持续7~14天。主要疗效终点是抗菌药物治疗结束后7天(±2天)的临床和微生物学疗效。共有452名患者随机接受头孢地尔(n = 303)和亚胺培南-西司他丁(n = 149)。其中,头孢地尔组252例和亚胺培南-西司他丁组119例被纳入改良意向治疗(mITT)人群。最常见的基线尿路病原体是大肠杆菌和肺炎克雷伯菌,接近一半是泛敏感的(头孢地尔组n = 117/252,46%;亚胺培南-西司他丁组n = 60/119,50%),头孢地尔被认为不劣于亚培南西司他丁,因为头孢地尔组与亚胺培南-西司他丁组的主要疗效终点分别为73% (n = 183)和55% (n = 65),调整后的治疗差异为 18.58%(95%置信区间[CI] 8.23%~28.92%)。治疗组之间的临床反应率相似(预设的非劣效性下限为15%)。然而,头孢地尔组在治疗试验中的微生物学疗效更高(73% vs 56%;差异17.25%;6.92%~27.58%)。综合和微生物结果的敏感性分析与mITT队列的结果一致。医院获得性肺炎APEKS-NP研究是一项Ⅲ期、随机、双盲、多中心、非劣效性试验,比较头孢地尔与大剂量、延长输注的美罗培南治疗成人医院获得性肺炎(HAP)、呼吸机相关性肺炎(VAP)或由革兰阴性菌引起的医疗保健相关肺炎(HCAP)。患者按1:1随机分配,每8小时接受头孢地尔2 g或美罗培南2 g静脉输注3小时,持续7~14天。所有患者还接受开放标签的利奈唑胺(600mg,每12小时)静脉给药至少5天。主要终点是mITT人群中第14天的全因死亡率。共有300例患者随机接受头孢地尔(n = 148)或美罗培南(n = 152)。其中,头孢地尔组145例和美罗培南组147例被纳入mITT人群(所有接受至少1次研究药物给药的患者,不包括单革兰阳性菌感染患者)。头孢地尔不劣于大剂量延长输注美罗培南,因为两组的主要结局(第14天的全因死亡率)相似(12.4%头孢地尔 vs 11.6%美罗培南;调整后差异 0.8%;95% CI -6.6% to 8.2%),基于12.5%的非劣效性边际。两组患者中临床治愈和微生物学根除的比例相似。最常见的病原体是肺炎克雷伯菌,其次是铜绿假单胞菌和鲍曼不动杆菌。预定义的亚组分析显示,HCAP患者头孢地尔组的死亡人数更多(死亡9例 vs 2例),但所有其他亚组中两组的死亡率相似。mITT人群中第14天和第28天全因死亡率的敏感性分析与微生物学上可评估的每个方案人群的分析相似(mITT人群中所有遵循研究方案并且革兰阴性菌培养阳性的患者)。严重碳青霉烯类耐药菌感染CREDIBLE-CR研究在设计和研究人群方面与之前的两项研究不同。这项Ⅲ期、随机、开放标签、多中心、描述性研究在患有严重碳青霉烯耐药革兰阴性菌感染的成人患者中评价了头孢地尔与临床指导的最佳可用疗法(BAT)的比较。研究人群包括因疑似或已确诊的耐碳青霉烯革兰阴性菌引起的医院获得性肺炎(HAP、VAP、HCAP)、BSI、cUTI 或败血症(病历不完善)而住院的患者。受试者按2:1的比例分配,接受头孢地尔2克每8小时静脉输注3小时或BAT,持续7~14天(可延长至21天,由临床医生自行决定)。对于医院获得性肺炎、BSI或败血症的患者,主要终点是治疗完成后的临床治愈(治疗结束后7天±2天)。cUTI患者的主要终点是治愈试验中的微生物学根除。共有152例患者随机接受头孢地尔(n = 101)或BAT(n = 51)。入组时最常见的诊断是医院获得性肺炎(n = 67, 45%),其次是BSI/败血症NOS (n = 47, 31%) 和cUTI (n = 36, 24%)。初步分析包括118例确诊为耐碳青霉烯类感染的患者(头孢地尔 n = 80,BAT n = 38)。在头孢地尔组中,83%(66/80)患者接受单药治疗,而在BAT组中,71%(27/38)接受联合治疗(其中大部分是以黏菌素为基础的方案)。最常见的碳青霉烯类耐药病原菌是鲍曼不动杆菌、肺炎克雷伯菌和铜绿假单胞菌(头孢地尔MIC 90分别为1 µg/ml、4 µg/ml 和2 µg/ml)。对于医院获得性肺炎患者,各组的临床治愈率相似(头孢地尔50% [20/40],95% CI 33.8%~66.2%;BAT 53% [10/19],95% CI 28.9 %~75.6%),BSI或败血症NOS(头孢地尔43% [10/23],95% CI 23.2%~65.5%;BAT 43% [6/14],95% CI 17.7%~71.1%)。对于 cUTI患者,在治愈试验中头孢地尔的微生物根除率为53%(9/17,95% CI 27.8%~77.0%)在BAT组中为20%(1/5,95% CI 0.5%~71.6%)。与接受BAT治疗的患者相比,头孢地尔组中死亡的患者更多(33.7% [34/101] vs 18.3% [9/49])。头孢地尔组的术后全因死亡率在第28天(差异6.4%;95% CI -8.6%~19.2%)和第49天(差异13.3%;95% CI -2.5%~27.8%)更高。探索性分析还发现,潜在感染和感染性微生物的死亡率有所不同。与BAT组相比,研究裁决委员会将头孢地尔组相比于BAT组更多的死亡归因于治疗失败(15.8% [16/101] vs 8.2% [4/49]),其中大部分发生在研究开始的15天内; 其余的死亡归因于潜在的合并症。头孢地尔组中大多数治疗失败死亡发生在不动杆菌感染患者中(13/16),而BAT组中仅1例死亡(1/4)。15名接受头孢地尔治疗的患者有证据表明治疗出现了体外耐药性,头孢地尔MIC较基线增加了4倍;其中10例患者经历了治疗失败。FDA 发布了对CREDIBLE数据的分析并描述了限制其解释的研究设计方面,包括开放标签设计、样本量小、研究组之间的不平衡以及有限的描述性分析方案。值得注意的是FDA对头孢地尔的批准完全基于APEKS-cUTI和APEKS-NP的数据,除了APEKS-NP试验中的HCAP亚组外,这些数据并未显示接受头孢地尔的患者死亡率增加。无论如何,FDA建议临床医生密切监测接受头孢地尔的患者,以寻找治疗失败的证据。欧盟的药品管理机构欧洲医学署部分基于CREDIBLE试验数据,发布了一项针对病原体的批准——将头孢地尔用于治疗选择有限的需氧革兰阴性菌感染。案例报告和案例系列有限的病例报告表明头孢地尔的超说明书使用取得了不同程度的治疗成功。尽管CREDIBLE数据涉及使用头孢地尔治疗碳青霉烯类耐药不动杆菌感染的治疗失败,但病例报告表明头孢地尔治疗泛耐药不动杆菌感染(包括骨科感染)取得了不同程度的成功。安全性和不良事件Ⅰ期研究表明头孢地尔对健康人是安全的且耐受性良好。在Ⅱ期和Ⅲ期临床试验中,头孢地尔组和对照组报告的不良事件发生率相似,且大多数为轻度或中度。在这些试验中报告的最常见的不良事件是恶心、腹泻、皮疹、肝功能检查升高和低钾血症。这些研究中未见提示头孢地尔影响患者铁凝血的实验室异常报告。根据CREDIBLE试验的数据,FDA的批准包括一项警告,即治疗碳青霉烯类耐药革兰阴性菌感染的全因死亡风险增加。它还包含适用于其他β-内酰胺类药物的警告,包括艰难梭菌相关腹泻的风险、头孢菌素类相关的癫痫发作风险(类似于头孢吡肟)和过敏反应。头孢地尔的R1侧链与头孢他啶、氨曲南的完全相同,与头孢洛林的相似。这样的结构相似赋予了其发生交叉过敏反应的潜在可能,临床医生在为药物过敏患者开具替代β-内酰胺类处方时应特别注意这些相似性。治疗和处方考虑中的地位头孢地尔在治疗MDR革兰阴性菌感染中的作用仍不确定。尽管其体外活性抗菌谱很有前景,但迄今为止,头孢地尔的临床试验仅证明了其与对照药物(即碳青霉烯类)治疗结果相似,且成本更高。尽管无法解释,但在CREDIBLE试验中观察到的死亡率增加使人们对头孢地尔在治疗碳青霉烯耐药鲍曼不动杆菌和其他可能的非发酵革兰阴性杆菌感染中的作用产生了怀疑。药敏试验中的挑战也阻碍了其临床使用。在获得更多数据之前,头孢地尔极有可能被保留用于特定MDR革兰阴性菌感染的二线或挽救治疗。
头孢地尔是一种新型的可注射铁载体头孢菌素药物,具有广谱的体外抗革兰阴性菌活性,包括碳青霉烯类耐药的病原菌。FDA批准该药用于治疗cUTI和医院获得性肺炎,需要根据肾功能调整剂量,且耐受性良好。早期数据表明头孢地尔是治疗某些碳青霉烯类耐药菌感染的有前景的替代药物,但其在治疗碳青霉烯类耐药假单胞菌和不动杆菌感染中的作用尚不明确。病原体特异性试验将有助于评价头孢地尔在临床治疗中的地位。
头孢地尔是首个被批准的铁载体头孢菌素,具有独特的穿透革兰阴性菌细胞膜的作用机制,能够克服革兰阴性菌尤其碳青霉烯类耐药菌对抗菌药物的多种常见耐药机制(孔蛋白通道改变、β-内酰胺酶水解作用、外排泵高表达),从而允许头孢地尔在胞外周质中达到高浓度,与青霉素结合蛋白结合并抑制细菌细胞壁合成。虽在体外研究中其展现出强大的抗菌活性,但现尔的临床数据并不支持它作为治疗多重耐药革兰阴性菌感染的一线用药,因为高昂的成本以及碳青霉烯类耐药革兰阴性菌感染的治疗失败。目前尚需更多的研究数据以明确头孢地尔在多重耐药革兰阴性菌感染治疗中的地位。
摘译:张楚晗
审校:杨洋
本文转发自华山抗生素所
查看更多