王共强 安徽中医药大学神经病学研究所
导读:帕金森病(Parkinson’s disease, PD)是由英国医生詹姆斯帕金森(JamesParkinson)在1817年一篇关于震颤性麻痹的文章中提出的,是世界上发病率仅次于阿尔兹海默病的第二常见慢性神经退行性疾病。随着老龄化社会来临,帕金森病患病率逐年增长,发展形势十分严峻,已成为继肿瘤、心脑血管疾病之后危害我国中老年人健康的“第三大杀手”。中国帕金森病治疗指南(第四版)指出,到2030年,我国帕金森病患者数将达500万,几乎占到全球患者数的一半。患病人数的激增将给各国的卫生体系带来巨大挑战。近年来,得益于基因检测技术、影像学技术、人工智能等技术的迅猛发展,帕金森病诊断性生物标志物的开发,已经取得许多实质性的研究进展。为此神经科学论坛每年一度评选出2022年帕金森病十大科学研究进展,以期促进中国帕金森病诊疗事业迅速发展。
CeIl Rep:首次发现跑步运动
改善帕金森病的机制
由美国拉什大学医学中心an领衔的研究团队,在Cell Reports期刊上发表了题为Treadmill exercise reduces α-synuclein spreading via PPARα.一项研究成果。他们首次发现了规律的跑步训练,可以延缓帕金森病小鼠模型的病理进展和运动表现。具体来说,他们发现规律的跑步训练能够延缓α-突触核蛋白(α-Syn)在小鼠大脑中的扩散,并保护黑质多巴胺能神经元。
跑步训练或药物介导的PPARα激活,可能有助于预防α-Syn病理扩散和相关神经元变性。Pahan团队的这个研究给帕金森病及其他神经退行性病患者延缓病情进展和提高生活质量带来了全新的希望。
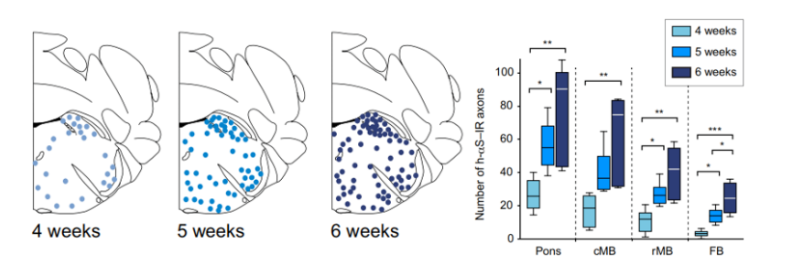
在实验过程中,研究人员运用脑立体注射技术,在2月龄的A53T小鼠(帕金森病模式小鼠)的内囊位置注射PFF,让α-Syn在A53T小鼠脑内经两个月的自然传播。随后,研究人员将所有小鼠随机分成两组,一组进行为期两个月的跑步机训练,训练频率为每天30min,每周6天;另一组作为对照组不进行跑步训练。两个月后进行组织学和行为学检测。
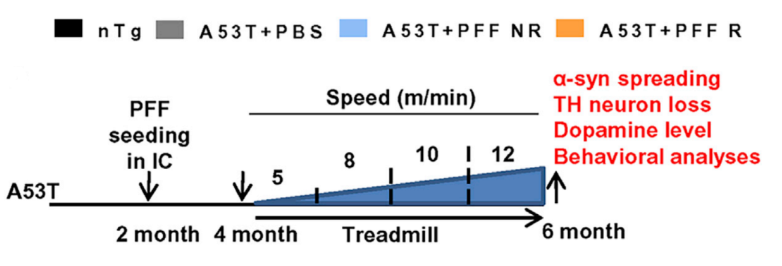
研究人员首先对黑质区域的α-Syn和磷酸化的突触核蛋白(pSyn129)进行免疫组织化学染色。结果表明,与未进行跑步训练组的A53T小鼠(A53T+PFF NR)相比,进行跑步训练组的A53T组小鼠(A53T+PFF R)黑质区域的不可溶的病理性α-Syn明显降低。并且,黑质区域的pSyn129含量也显著减少。实验结果表明,跑步训练可以抑制α-Syn在A53T小鼠黑质中的病理性传播。小鼠使用PPARα激动剂后,能够延缓α-Syn病理性播散并保护酪氨酸羟化酶神经元。
Sci Adv:揭示帕金森病病情
进展速度不同的机制
在临床上,同样是帕金森病,不同的患者临床进展情况却千差万别:有的病人发病十几年依然症状很轻,服用多巴胺替代药物后与正常人无异;有的病人却在5年之内迅速进展至病理晚期,生活无法自理,这可能就与α-Syn传播速度与介导神经元死亡的程度有关。
近日,来自德国神经退行性疾病研究中心和美国帕金森病研究协会的科学家依据“肠脑轴”的理论,联合研究发现α-Syn由延髓传向中脑的速度与神经元活性密切相关,神经元过度激活导致的氧化应激可加速α-Syn的传播。该成果发表在Science advances杂志上
由于在“肠脑轴”的学说中,延髓迷走神经背核是病理蛋白传播入脑的起点,研究者们使用LoxP-Cre技术,在小鼠迷走神经背核中特异性表达人源性α-Syn。在小鼠中转入人源性α-Syn表达序列,该序列只有在Cre诱导下才能表达,通过在迷走神经中注射Cre-AAV,在注射4-6周后可以观察到迷走神经背核中人源性α-Syn RNA和蛋白水平的增加。而在上游脑区(脑桥、中脑、端脑),无法观察到人源性α-Syn mRNA的转录,但却观察到人源性α-Syn的沉积。这说明人源性α-Syn在小鼠大脑中可以自发由延髓向中脑及端脑传播。
接下来为了观察神经元活动对传播的影响,研究者们使用了另一种工具:只由特定药物激活性受体(DREADD)。同样通过AAV病毒注射,分别在迷走神经背核内表达hM3D(激动受体)和hM4D(抑制受体)两种受体。在这两种受体在神经元表达的情况下,向小鼠腹腔内注射CNO这种药物,神经元放电就会被药物调控。表达hM3D的神经元会被显著激活而表达hM4D的神经元被显著抑制。通过c-fos染色和电生理实验,我们可以明确神经元的激活情况。
人源性α-Syn可在小鼠神经元间传播。在神经元过度激活时,可以同时观察到α-Syn传播能力增强、硝基化水平增加,和神经元氧化应激增强、线粒体损伤加剧。
本研究的发现将神经元活动,氧化应激与线粒体损伤和α-Syn传播与沉积相关的证据连成一条线索,向我们展示了它们的因果关系。也许我们不能调控神经元的活动,但我们却可以调节氧化应激反应,也许未来的一天,我们可以迎来帕金森病新的疾病修饰治疗手段。
Cell Metabol:靶向作用大脑的能量代谢有助于治疗帕金森病
来自挪威海于克兰大学医院等机构的研究者在Cell Metabolism期刊上发表题为The NADPARK study:A randomized phase I trial of nicotinamide riboside supplementation in Parkinson’s disease的研究成果,该研究发现靶向作用大脑中的能量代谢或有望帮助治疗人类帕金森疾病。研究结果表明,NR或许能作为治疗帕金森疾病的潜在神经保护性疗法,但后期研究人员还需要深入研究证实其具体作用机制和功效。
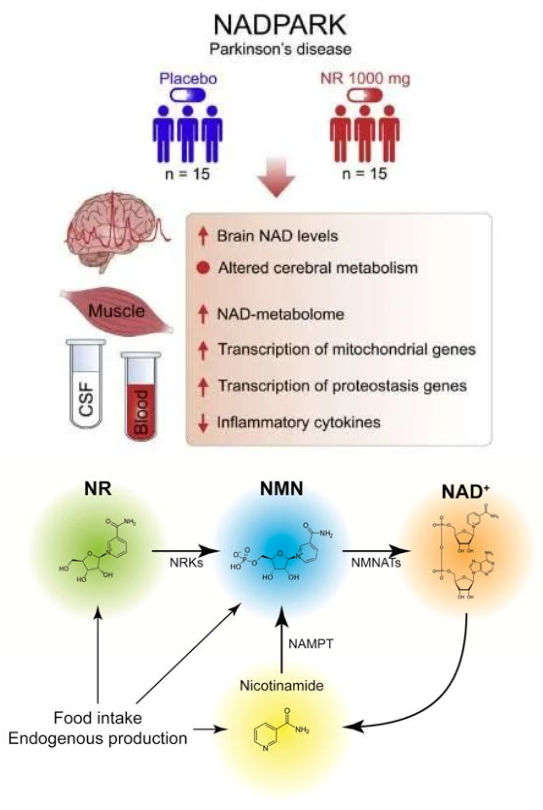
研究评估了口服NR后患者血清和脑脊液中相关细胞因子的变化,采用ELSIA方法检测了线粒体功能障碍相关的细胞因子FGF21和GDF15水平,采用simoa技术检测了神经损伤相关细胞因子Nf-L的水平,通过细胞因子液相芯片检测了35种炎性细胞因子的水平。结果发现,血清中GDF15水平显著下降,但脑脊液中没有。血清中FGF21不变,低于脑脊液检出限。NR治疗组的血清和/或脑脊液中的几种常见炎症细胞因子(如MIP-1β、IL-7等)显著降低。神经元损伤的指标Nf-L水平在血清和脑脊液中没有变化。此前已有多项动物实验显示,通过补充NAD+前体(NMN和NR),有助于保护神经系统,预防和改善神经退行性疾病。这也让人十分期待,提升NAD+水平能否对人类的神经系统起到同样的保护作用。
Nat Commun:肠道菌群与
帕金森病发病密切相关
一项来自美国阿拉巴马大学伯明翰分校的研究人员在 Nature Communications 期刊发表题为Metagenomics of Parkinson’s disease implicates the gut microbiome in multiple disease mechanisms 的研究论文。这项大规模研究发现,帕金森病患者的肠道微生物群组成普遍失衡,这些肠道微生物群参与了帕金森病发病的多个途径。
研究团队对直接从帕金森病患者(490人)和健康对照组(234人)的粪便微生物组进行了宏基因组学分析,发现帕金森病宏基因组是促进帕金森病疾病进展的微生物组标志。
研究团队对其中的257种肠道微生物进行了分析,结果显示,其中84种(33%)与帕金森病相关。在这84种与帕金森病相关的肠道微生物中,55种在帕金森病患者的肠道中丰度异常高,29种丰度异常低。这表明帕金森病患者普遍存在肠道微生物失衡。在帕金森病患者中,齿双歧杆菌(Bifidobacterium dentium)丰度增加了7倍,黏性放线菌(Actinomyces oris)丰度增加了6.5倍,变形链球菌(Streptococcus mutans)丰度增加了6倍。肠道罗斯拜瑞氏菌(Roseburia intestinalis)丰度减少了7.5倍,Blautia wexlerae 丰度减少了5倍。总体而言,36%的与帕金森病相关的肠道微生物群丰度变化超过2倍。
这项研究建立了迄今为止最高分辨率的帕金森病肠道微生物组大型数据库,这一数据库将免费公开以促进科学开放。这项研究证明了帕金森病患者中普遍存在肠道微生物失衡,这种失衡为帕金森病等神经退行性疾病创造了环境。随着样本量的增加,以及其他研究团队进行的宏基因组研究,将会有更多信息被揭示。预计在不久的将来,将用于更多工具和分析能力以探究帕金森病的异质性,寻找生物标志物,深入研究其起源和发展,并通过调控微生物组来预防、治疗和阻止帕金森病的发生发展。
NPJ Parkinsons Dis:睡眠质量是帕金森病发生异动症的独立危险因素
一项来自中国同济大学附属同济医院的研究团队在npj Parkinson’s Disease期刊发表题为High PSQI score is associated with the development of dyskinesia in Parkinson's disease研究论文。研究发现高PSQI(Pittsburgh Sleep Quality Index, PSQI≥6)是帕金森病(Parkinson’s Disease, PD)患者发生异动症(dyskinesia)的独立危险因素,并构建异动症的预测模型,有望为PD异动症的机制研究和防治策略的制定提供新的有价值的靶点。
异动症是帕金森病(PD)中最致残的运动并发症之一。睡眠对于保持神经回路的稳态至关重要,而帕金森病患者经常遭受睡眠障碍。然而,很少有前瞻性研究调查睡眠质量与帕金森病运动障碍的关系。当前研究的目的是调查睡眠质量和运动障碍之间的关系,并建立一个帕金森病运动障碍的预测模型。
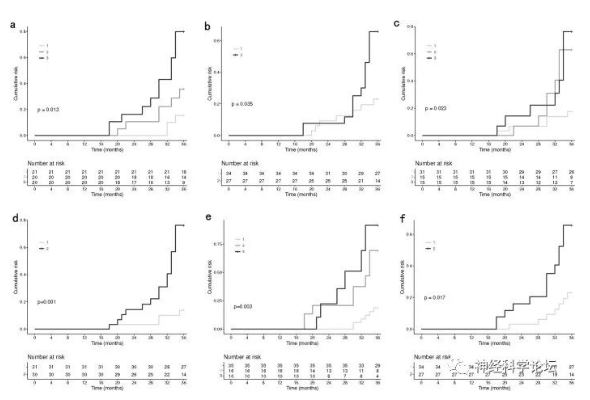
研究中前瞻性地随访了一组基线时无异动症的帕金森病患者,最长随访时间为36个月。采用逐步变量选择的单变量和多变量Cox回归来研究异动症的危险因素。通过受试者操作特征曲线下的时间依赖面积(AUC)评估模型的性能。随访结束时,32.8%的患者出现运动障碍。睡眠质量差的患者与睡眠质量好的患者相比,运动障碍的比例明显更高(48.1%比20.6%,p = 0.023)。多变量Cox回归选择PD持续时间、睡眠质量、认知、情绪和左旋多巴剂量。值得注意的是,高匹兹堡睡眠质量指数(PSQI)评分与异动症风险增加独立相关(HR = 2.96,95% CI 1.05–8.35,p = 0.041)。该模型实现了良好的区分能力,在35个月时最高的AUC为0.83。研究结果表明,高PSQI评分可能增加帕金森病发展为异动症的风险,这意味着以改善睡眠质量为目标的治疗干预可能是一种预防或延缓帕金森病发展为异动症的有前途的方法。
Cell:揭示抑制PAAN核酸酶可预防帕金森病中的神经退化
一项来自约翰霍普金斯大学医学部的研究人员在Cell期刊上发表题为PAAN/MIF nuclease inhibition prevents neurodegeneration in Parkinson’s disease最新研究成果。在针对小鼠的研究中,发现一种化合物可以阻止与帕金森病中脑细胞死亡有关的通路中的最后事件。这一实验结果可能推动一种药物的开发,这种药物可以安全在人体中使同一通路短路,并防止帕金森病、中风和其他神经退行性疾病特有的破坏性影响。
帕金森病的特点是错误折叠的α-突触核蛋白(alpha synuclein)在负责产生一种叫做多巴胺的神经递质的脑细胞中堆积起来。随着更多错误折叠的蛋白聚集在一起,它们通过Dawson和其他约翰霍普金斯大学研究人员确定的所谓“程序化”细胞死亡过程杀死脑细胞。这一过程被称为PARP-1依赖性细胞死亡(parthanatos),可导致运动、情绪调节和思维方面的障碍。
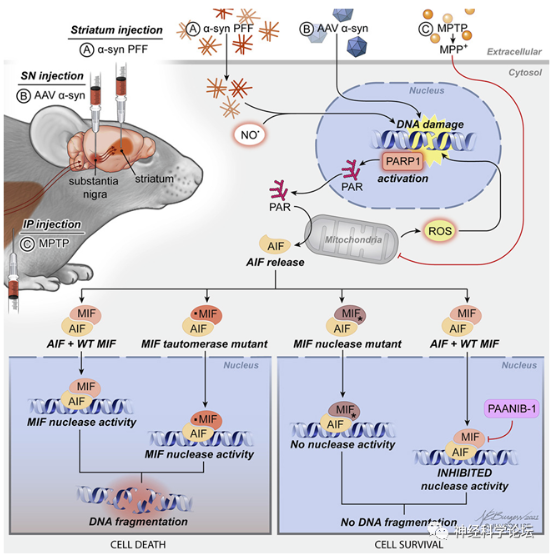
研究测试中发现了一种能阻断PAAN而不影响其他重要PAAN活性的化学物,并将它命名为PAANIB-1(PAAN inhibitor 1, 即PAAN抑制剂1)通过测量了每只小鼠能用前爪抓取一个杠杆的时间。通常情况下,与未受影响的小鼠相比,有帕金森病症状的小鼠的握力下降。然而,用PAANIB-1治疗的帕金森病小鼠的握力与未受帕金森病症状影响的小鼠相当,这表明PAANIB-1阻止了与运动控制能力下降有关的细胞退化。随后研究用PAANIB-1治疗的帕金森病小鼠的大脑时,他们发现脑细胞的死亡明显减少。
PAANIB-1能够特异性地阻断脑细胞死亡而不影响PAAN蛋白的其他功能,是寻找治疗帕金森病的新药的一个有希望的线索。研究者计划继续筛选可安全用于人类的化学物,以阻断PAAN在细胞死亡中的功能,并将继续研究PAAN对其他神经退行性疾病的影响。
Neurology:富含类黄酮类食物可明显降低帕金森疾病患者的死亡风险
一项来自美国宾夕法尼亚州立大学等机构的研究团队在Neurology期刊上发表题为Intake of Flavonoids and Flavonoid-Rich Foods, and Mortality Risk Among Individuals With Parkinson Disease:A Prospective Cohort Study的研究成果。研究发现摄入更多类黄酮化合物的帕金森疾病患者要比不摄入类黄酮化合物的患者而言拥有更低的死亡风险,这些类黄酮化合物主要存在于诸如浆果、可可和红酒等色彩丰富的食物中。
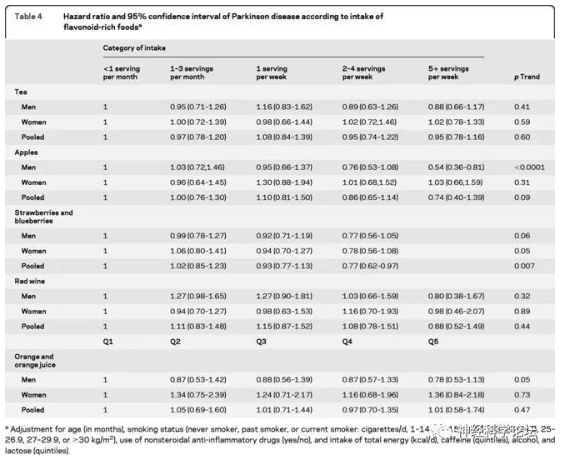
研究人员对599名女性和652名男性帕金森疾病患者的数据进行分析,这些参与者都被问及其摄入特定富含类黄酮化合物的频率,比如茶、苹果、浆果、橙子和橙汁、红葡萄酒等;随后研究者通过将这些食物中类黄酮的含量乘以其食用频率来计算参与者类黄酮的摄入量。
当控制了诸如年龄等因素和多种饮食因素(比如总的卡路里和整体饮食质量)后,他们发现,类黄酮输入量最高的25%组的参与者要比最低摄入组的生存率高出70%。而且最高摄入组参与者每天会摄入673毫克的类黄酮化合物,最低摄入组仅为134毫克。研究人员还分析了单一类黄酮化合物所产生的影响效应,结果发现,针对存在于红葡萄酒和浆果中的花青素而言,摄入量最高的25%组参与者要比摄入量最低的25%组参与者的生存率高出66%;此外,摄入黄烷-3-醇(flavan-3-ols)(存在于苹果、茶和红葡萄酒中)的最高25%组的生存率要比最低摄入组高出69%。
研究结果表明在患有帕金森疾病的患者中,更多地摄入类黄酮化合物(尤其是花青素和黄烷-3-醇)以及富含黄酮类的食物(比如浆果和红酒等)或与其死亡风险较低直接相关。
Nat Commun:AI通过成纤维细胞形态准确预测帕金森病
来自美国纽约干细胞基金会研究所等机构的研究团队在Nature Communications期刊上发表题为Integrating deep learning and unbiased automated high-content screening to identify complex disease signatures in human fibroblasts的研究成果。通过研究开发了一种能帮助发现疾病细胞特征的新平台,其或能将研究患者细胞的机器人系统与进行成像分析的人工智能方法相结合,利用这种自动化的细胞培养平台,研究人员通过创建并分析来自91名患者和健康对照个体的超过100万个皮肤细胞图像,成功识别出了帕金森疾病的新型细胞标志。
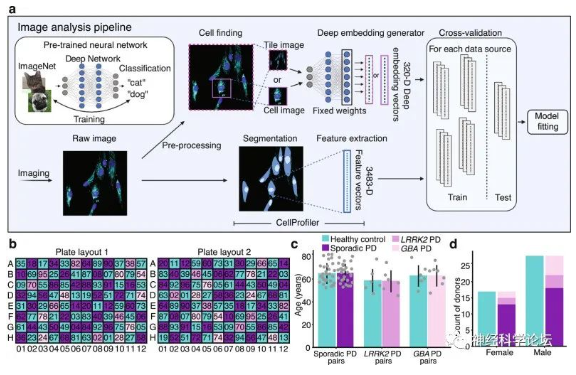
值得注意的是,新平台与疾病无关,只需要患者容易获得的皮肤细胞。它还可以应用于其他类型的细胞,包括NYSCF创造的用于模拟多种疾病的诱导多能干细胞衍生物。这是首次能以如此高精确度和灵敏度成功识别疾病特征的工具,其识别患者亚群的能力对于多种难治性疾病的精准化医疗和药物开发具有非常重要的意义。
一项来自宾夕法尼亚大学(University of Pennsylvania)佩雷尔曼医学院的研究团队在Science期刊上发表题为GPNMB confers risk for Parkinson’s disease through interaction with α-synuclein的最新研究成果。研究通过计算生物学、细胞生物学和基于人体组织的研究发现,检测帕金森病患者血液中的一种糖蛋白含量,将有助于尽早了解日后的疾病风险。
帕金森病前驱期可能出现的症状包括便秘、睡眠障碍(包括经常做噩梦)、记忆减退等。但显然有很多其他的疾病也可能涉及这些症状。因此,要及早干预帕金森病的进展,有必要开发一组可靠的生物标志物来准确识别有疾病风险的个体,并预测疾病的进展程度。这项新研究的突破便在于此。
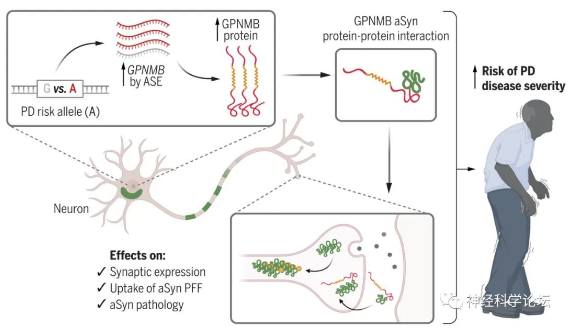
研究团队首先利用全基因组关联研究(GWAS)的发现,这类分析找出了80多个导致帕金森病风险的遗传位点,但其中大部分位点的目标基因与帕金森病在生物学机制上有何关联尚未得到充分的研究。进一步结果来自731名帕金森病患者的样本。研究人员检测了他们血浆样本中的GPNMB浓度,并以59名神经系统健康的个体作为对照,发现帕金森病患者血浆中GPNMB浓度普遍升高,并且血浆GPNMB浓度较高的患者相应地疾病程度也更严重。
该研究重点关注了其中7号染色体上的一个风险位点,这个位点与编码糖蛋白GPNMB的基因有关。GPNMB是一种跨膜糖蛋白,经切割后形成细胞外的可溶形式。研究表明GPNMB与α-突触核蛋白(aSyn)相互作用,并影响aSyn在帕金森病病理发展中所起的关键作用。GPNMB有潜力作为帕金森病疾病进展的生物标志物,在临床试验中检测这一指标,有助于识别出处于帕金森病早期阶段的患者。
Nat Biomed Eng:帕金森病无创深脑电刺激治疗新突破
一项来自韩国浦项科技大学的研究团队在Nat Biomed Eng期刊上发表题为Deep brain stimulation by blood-brain-barrier-crossing piezoelectric nanoparticles generating current and nitric oxide under focused ultrasound最新研究成果。研究团队开发一种可用于刺激大脑深部组织的压电纳米颗粒,该纳米颗粒在聚焦超声作用下可释放一氧化氮,从而打开血脑屏障并进入脑实质,同时可由超声诱导产生压电效应,从而发出电流刺激多巴胺能神经元释放多巴胺,缓解PD模型小鼠的症状,同时无明显的毒副作用。
研究团队首先验证了该纳米颗粒是否可以在超声作用下释放出一氧化氮。结果显示,与没有超声波作用时相比,在超声波(490W,40kHz,5.2W/cm²)作用下BNN6可从BTNP表面分离,并释放出更多的一氧化氮,且不影响材料的压电特性。然后利用膜片钳技术检测了BTNP–pDA在生理条件下的超声诱导压电效应,发现BTNP-pDA可产生与超声强度呈正比的电流。
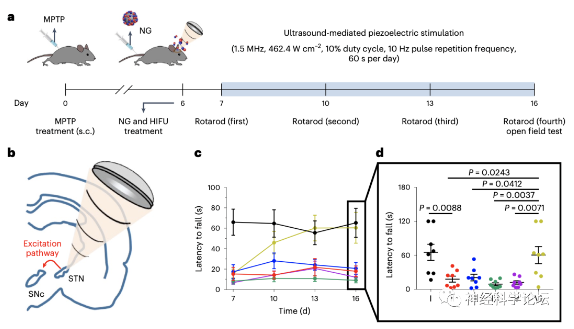
研究发现BTNP–pDA可在超声作用下引起脑切片中兴奋性突触后电流的强度和频率升高,对神经元的兴奋性起到调控作用。这些结果表明BTNP–pDA的压电特性可在超声作用下对神经元进行电刺激。
研究发现超声联合BTNP–pDA–BNN6作用减少了黑质中多巴胺能神经元的死亡,这同样可起到减轻PD症状的作用。最后,他们评估了超声联合BTNP–pDA–BNN6作用是否具有明显的毒副作用。通过对小鼠血液样本、脑组织以及心、肝、肺、脾、肾等进行活检,他们并未发现该疗法具有明显的毒副作用。
研究团队还探究该纳米颗粒打开血脑屏障的机制,研究发现BTNP–pDA–BNN6释放的一氧化氮可显著升高基质金属蛋白酶-9(MMP9)的表达水平,从而降解紧密连接蛋白ZO-1,进而打开血脑屏障。通过实验证实,BTNP–pDA–BNN6释放一氧化氮后造成的血脑屏障打开并不是永久的,大约在2小时之内,血脑屏障会重新关闭。
该研究对防止血脑屏障永久性破坏可能造成的缺血性卒中、神经炎症和神经退行性疾病等至关重要。这种BTNP–pDA–BNN6纳米颗粒使非侵入性、安全地对脑内靶区实行电刺激成为现实,PD等神经退行性疾病有望迎来新疗法。