查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





炎症性肠病(IBD)是一组原因不明的主要累及消化道的慢性非特异性炎症性疾病,包括克罗恩病(CD)、溃疡性结肠炎(UC)和未定型IBD(IBDU)。IBD最早发现于西方国家,在过去的数十年,其发病率呈上升趋势。近年来,在亚洲、南美等新兴工业化国家,IBD发病率逐年增长,目前已成为一类影响人类健康的全球性疾病。IBD病因尚不完全清楚,目前一致认为是基因、环境、微生物及免疫因素共同参与,相互影响的结果。IBD通常被认为是一种多基因疾病。早期研究显示,IBD的单卵双胞胎共患率高、有家族聚集现象。目前通过大规模全基因组研究 (GWAS) 发现了200多个基因位点,包含300多个候选基因与IBD有关。
20%~30%的IBD患者初次发病年龄在20岁以下。儿童IBD占所有IBD患者的20%~25%,其发病率在全球范围内呈现增长趋势。文献报道儿童IBD发病率为0.47/10万~15.9/10万。
根据蒙特利尔分型,起病年龄<17岁为儿童IBD。
在后来的巴黎分型中对儿童IBD做了进一步细化:
起病年龄在10~17岁为A1b;
起病年龄<10岁为A1a,称为早发IBD(EO-IBD);
<6岁为极早发IBD(VEO-IBD);
<2岁为婴儿型IBD(IO-IBD);
<28 d为新生儿型IBD(neonatal IBD)。
与成人及大年龄段儿童IBD不同之处在于,VEO-IBD,尤其IO-IBD,起病年龄早,临床过程复杂,发病与单基因突变关系更为密切。这些单基因缺陷多与原发性免疫缺陷病有关 。
单基因缺陷导致细胞因子信号传导异常、T 淋巴细胞免疫耐受缺陷、上皮细胞屏障障碍、中性粒细胞功能障碍、联合或孤立T、B淋巴细胞功能缺陷和高炎症反应,进而出现IBD及IBD样肠炎的表现。目前已发现70多种基因缺陷与IBD的发生有关,详见表1。
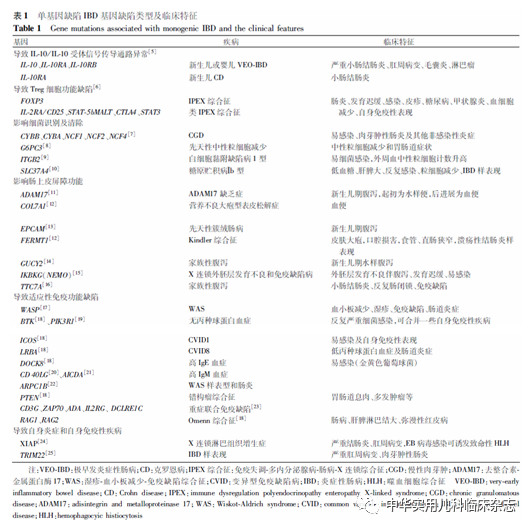
在临床工作中,哪些患儿需要进行基因检测?
(1)起病年龄早,多在6岁以下,尤其<2岁;
(2)病程复杂,临床表现重,很难用单一疾病解释;
(3)有严重肛周病变;
(4)既往有反复感染病史;
(5)有阳性家族史;
(6)常规治疗效果不佳;
(7)早期接受手术治疗;
(8)病理学证实存在细胞凋亡或微绒毛缺失;
(9)合并噬血细胞综合征或早发性肿瘤等情况,提示存在单基因缺陷可能性大,应尽早完善基因检测明确诊断。
通过基因检测,首先可以明确基因缺陷类型,做到明确诊断,指导后续治疗。其次可以发现一些可疑致病突变,进行深入分析及功能验证,为确定新的致病突变及致病途径提供突破口及线索,促进IBD发病机制及治疗方法的研究。最后,对患儿家庭给予遗传学咨询和建议,减轻家庭及社会的负担。
全外显子基因测序(WES)是目前最常用的二代测序方法。WES是对基因组的所有外显子进行测序,大概占人类基因组序列的2%。WES不仅能够发现已知的基因突变,还能发现一些新的致病基因或相同基因的新发突变位点。所需费用及时间适中,临床工作中可行度高。缺点就是不适用于结构变异及非外显子区域变异。目标序列测序(panel sequencing)主要是对一些选定的基因进行测序,通常是一些已知致病基因或感兴趣的基因。测序准确度更高,所需费用和时间更少,可行度高。但其测序范围只能限定在指定的基因。全基因组测序(WGS),是对整个基因组的所有碱基进行测序。覆盖面最广,能够检测各类基因组变异,特别是结构变异。但所需费用及时间成本高,临床可行性不高。
作者:深圳市儿童医院消化内科 苟静 王朝霞
内容节选自《分子诊断技术在儿童炎症性肠病诊治中的意义》
查看更多