查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





胆道恶性肿瘤(Biliary tract carcinoma, BTC),主要包括胆囊癌(Gallbladder cancers,GBC)和肝内外胆管癌(Cholangiocarcinomas,CC),约占所有消化系肿瘤的3%[1]。BTC绝大多数为腺癌,侵袭性强,发现时多为晚期,预后极差,5年存活率低于5%[2]。目前,BTC全球发病率呈现上升趋势,以亚洲国家最为常见。
由于其早期症状不显著,绝大多数患者初诊时已处于晚期,失去手术切除机会。近十年来,晚期BTC的系统治疗进展缓慢,直至目前,国内外指南推荐的晚期BTC标准治疗方案仍为化疗。所谓化疗即采用化学药物阻断细胞分裂以抑制癌细胞生长[3],利用不同的细胞对于化疗药物敏感性的不同进行的。增殖旺盛的细胞对于化疗的敏感性高于增殖缓慢的细胞,幼稚细胞对化疗的敏感性高于成熟细胞。而癌细胞是身体的增殖旺盛细胞,而且含有幼稚细胞很多,而身体的其他细胞则多数是成熟细胞。因此癌细胞是身体内的化疗敏感组织,也就是说化疗药物对在这些细胞的作用最大。
目前在中国,晚期一线化疗推荐3个化疗方案,分别是吉西他滨联合顺铂,吉西他滨联合替吉奥和卡培他滨联合奥沙利铂。证据分别来自3个随机对照临床试验。ABC-02研究[4]结果显示,吉西他滨联合顺铂将晚期BTC病人的OS从8.1个月提高到11.7个月。III期JCOG1113/FUGA-BT研究[5]表明,吉西他滨联合替吉奥用于晚期BTC的一线治疗,其OS可达15.1个月,疗效不劣于吉西他滨联合顺铂方案(OS 13.4个月),可作为晚期BTC的一线治疗选择。Kim等[6]人报告了卡培他滨联合奥沙利铂一线治疗胆道癌症的研究结果,总生存10.6个月,与对照组吉西他滨+奥沙利铂的10.4个月一致,也作为一线治疗推荐,但上述化疗方案给胆道癌患者带来的生存获益十分有限,临床亟待新的治疗方案。
随着免疫治疗的兴起以及对免疫微环境的探究,免疫治疗逐渐成为胆管癌治疗的新思路。其中,免疫治疗和化疗的联合使用在胆道肿瘤治疗中也取得了较单纯化疗更优的效果。也具有一定的理论基础:
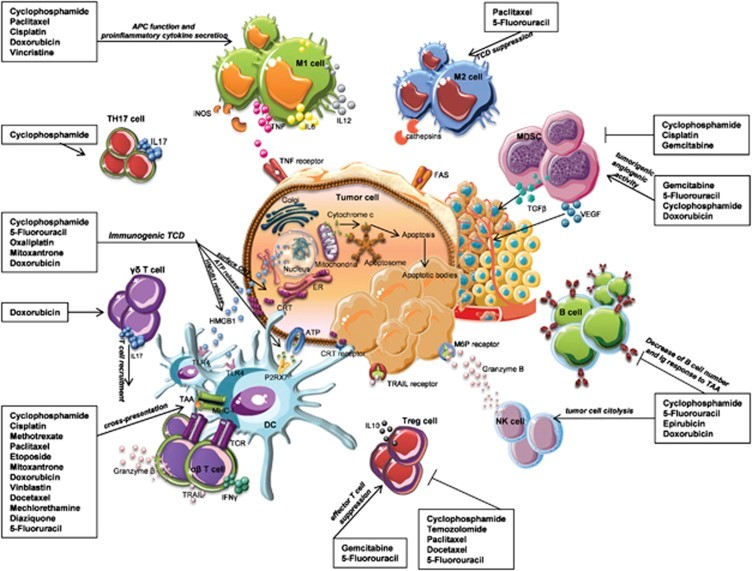
图1. 细胞毒性药物的免疫调节机制
源于细胞毒性药物干扰DNA合成和复制的事实,传统的化疗历来被认为是通过直接杀死肿瘤细胞发挥作用。然而,越来越多的证据表明,化疗的抗肿瘤活性也依赖于几种非靶向效应,尤其是针对宿主免疫系统的效应,这些效应共同作用于肿瘤的成功根除。化疗药物通过几种方式刺激免疫系统的固有和适应性免疫[7]:(i)通过促进死亡肿瘤细胞的特异性重排,使其可被免疫系统发现;(ii)通过短暂的淋巴细胞耗竭和免疫细胞池的反弹补充,影响造血室的内环境稳定;(iii)通过破坏肿瘤诱导的免疫抑制机制和(iv)通过对免疫效应器施加直接或间接的刺激作用。在免疫细胞刺激的间接方式中,一些细胞毒性药物已被证明可诱导肿瘤细胞中的免疫原性细胞死亡,导致释放特定信号,触发细胞碎片的吞噬并促进树突状细胞的成熟,最终导致诱导有效的抗肿瘤反应。低剂量环磷酰胺和吉西他滨会消耗调节性T细胞或髓系抑制细胞,并促进效应物的肿瘤攻击。 紫杉醇、顺铂和阿霉素诱导肿瘤细胞表面甘露糖-6-磷酸受体的上调,使其对颗粒酶B具有渗透性。紫杉醇诱导巨噬细胞分泌促炎细胞因子,导致DC、NK和t细胞活化。蒽环类、奥沙利铂和环磷酰胺可促进肿瘤细胞外显crt的表达,并通过死亡肿瘤细胞释放HMGB1和ATP,从而刺激DC吞噬抗原和抗原递呈(见图1)。
免疫应答包括体液免疫与细胞免疫,其中,T细胞是细胞免疫的主要效应细胞,其激活依赖于“双信号”的共同调控。此外,为了限制T细胞不被过度激活,还存在着抑制T细胞功能负性调节[8],主要包括PD‑1/PD‑L1通路、细胞毒性T淋巴细胞相关蛋白4(CTLA‑4)通路、T细胞免疫受体(TIGIT)通路等。PD‑1/PD‑L1通路在生理情况下的作用主要为控制抗原表达部位的炎症程度、抑制过度的免疫应答,以保护正常组织免受损伤。在T细胞未被激活时,其PD‑1表达量极低甚至无,只有在T细胞活化后,PD‑1才会被诱导表达。当T细胞接触抗原递呈细胞并识别出MHC表达的抗原时,即会激活相应的免疫应答并释放炎性细胞因子,启动炎症过程。过量的炎性细胞因子会进一步激活靶细胞PD‑L1表达,通过活化的T细胞高表达PD‑1与靶细胞高表达PD‑L1结合,抑制T细胞活性,从而减轻过度的免疫应答及炎症反应。PD‑1/PD‑L1抑制信号会阻碍T细胞对肿瘤组织的杀伤作用,而阻断PD‑1/PD‑L1通路可重新激活T细胞对肿瘤的免疫应答,促进肿瘤特异性CD8+T细胞的活化、增殖以及抗肿瘤细胞因子的分泌。而PD‑1/PD‑L1单克隆抗体正是通过抑制该通路,以促进T细胞对肿瘤细胞的杀伤作用。
综上,化疗药物被证明可诱导免疫调节作用,而PD‑1/PD‑L1单克隆抗体可阻断PD-L1与PD-1之间的信号通路,从而防止肿瘤细胞逃避免疫系统。基于此,化疗联合免疫治疗可导致疗效增强。希望未来能有更多新的有效的治疗方案,造福更多的BTC患者。
参考文献:
1.BENAVIDES M, ANTON A, GALLEGO J, et al. Biliary tract cancers: SEOM clinical guidelines. Clin Transl Oncol, 2015, 17: 982-987.
2.KHAN SA, THOMAS HC, DAVIDSON BR, et al. Cholangiocarcinoma. Lancet, 2005, 366(9493):1303-1314.
3.李世珍, 田凤. 肿瘤病人化疗毒副反应的预防及护理[J]. 中华临床医药杂志, 2002.
4.VALLE JW, WASAN HS, PALMER DH, et al. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Eng J Med, 2010, 362:1273-1281.
5.MORIZANE C, OKUSAKA T, MIZUSAWA J, et al. Combination gemcitabine plus S-1 versus gemcitabine plus cisplatin for advanced/recurrent biliary tract cancer: the FUGA-BT (JCOG1113) randomized phase III clinical trial. Ann Oncol, 2019, 30:1950-1958.
6.KIM ST, KANG JH, LEE J, et al. Capecitabine plus oxaliplatin versus gemcitabine plus oxaliplatin as first-line therapy for advanced biliary tract cancers: a multicenter, open-label, randomized, phase III, noninferiority trial. Ann Oncol, 2019, 30:788-795.
7.Bracci L, Schiavoni G, Sistigu A, Belardelli F. Immune-based mechanisms of cytotoxic chemotherapy: implications for the design of novel and rationale-based combined treatments against cancer. Cell Death Differ 2014;21(1):15-25.
8.缪康,张力.程序性死亡受体1及其配体1单克隆抗体抗肿瘤机制的研究进展[J].中华内科杂志,2021,60(11):1005-1009.
作者简介
吴振宇
主任医师,肝胆外科副主任
北京大学航天临床医学院
肝脏亚学科带头人
北京中西医结合学会肝胆外科专业委员会委员
中国研究型医院学会智能医学专业委员会委员
海峡两岸医药卫生交流协会肝胆胰专业委员会委员
中国抗癌协会肝胆胰分会委员
中国老年保健协会肝胆胰外科专业委员会委员
声明:本文的采访/撰稿/发布由阿斯利康提供支持,仅供医疗卫生专业人士参考
审批编号:CN-93172 有效期至:2023/3/23
查看更多